
翻译:李志磊a;审校:韦青b
a中国科学院大学附属肿瘤医院-温州医科大学联合培养硕士研究生;b中国科学院大学附属肿瘤医院肝胆胰胃内科
引用此文:Emmanouil Fokas, et al. Chemoradiotherapy Plus Induction or Consolidation Chemotherapy as Total Neoadjuvant Therapy for Patients With Locally Advanced Rectal Cancer: Long-term Results of the CAO/ARO/AIO-12 Randomized Clinical Trial. JAMA Oncol. 2022 Jan 1;8(1):e215445. doi: 10.1001/jamaoncol.2021.5445.
摘要
全新辅助治疗(TNT)是指在术前进行放化疗(CRT)或短程放疗(SCRT)加化疗,或作为非手术治疗手段[NOM],已越来越多地用于多模式直肠癌治疗。与标准的CRT/SCRT、手术和辅助化疗相比,全新辅助治疗具有一些优势,例如更早地进行全身治疗,毒性更小,依从性更好,可以减少远处转移,提高无病生存率(DFS)。此外,TNT(以及从开始治疗到手术的较长时间间隔)也可能提高局部肿瘤消退、病理完全反应(pCR)和R0(完全)切除率,并可能指导NOM或局部切除的患者选择。注意事项包括TNT在低风险或中风险直肠癌患者中的潜在过度治疗和不必要的毒性,以及对无反应或反应差的肿瘤行根治性手术的严重延迟。
目前存在两种TNT顺序:诱导化疗后进行CRT/SCRT,以及CRT/SCRT后进行巩固化疗。正如PRODIGE23和RAPIDO随机3期试验所证明的,与标准CRT和手术加或不加辅助化疗相比,这两个顺序都显著改善了它们的主要终点—分别是DFS和疾病相关治疗失败。然而,CRT/SCRT和化疗的最佳时间安排仍存在争议。事实上,据我们所知,这两种TNT顺序的头对头比较仅在两个随机试验中进行了研究,即美国的OPRA)试验和德国的CAO/ARO/AIO-12试验。
2019年报告了CAO/ARO/AIO-12的第一个结果,结果显示,先行CRT后行巩固化疗可改善pCR(17% vs 25%;pCR+cCR:21% vs 28%),对CRT的依从性更好,但对化疗的依从性更差。我们在这里介绍了中位随访43个月(范围35-60个月)后试验的长期结果,包括DFS、慢性毒性、生活质量(QoL)和大便失禁的次要结果。
方法
病人选择
CAO/ARO/AIO-12是一项多中心、随机的2期试验。入选标准包括18岁或以上的患者,根据严格的直肠镜检查,直肠腺癌患者位于肛门边缘以上12cm处;ECOG评分为0到1,器官功能正常;cT3肿瘤距离肛缘不到6cm,cT3肿瘤位于直肠中三分之一(≥6-12cm),根据强制性的磁共振成像,壁外肿瘤扩散到肠系膜脂肪超过5mm(>cT3b)、cT4肿瘤或淋巴结受累。对腹部和胸部进行计算机断层扫描以排除远处转移。没有收集有关种族和民族的数据。试验在德国进行,纳入德国公民。法兰克福大学伦理委员会批准了这项研究,所有患者都签署了同意书。本研究遵循了CONSORT的报告指南。
治疗
患者被随机分为A组在CRT前进行诱导化疗,或B组在CRT后进行巩固化疗(附录1中的图1)。对原发肿瘤、直肠系膜、骶前和髂内淋巴结进行强制性调强放疗,总剂量为50.4 Gy/28F。根据之前的第3阶段试验(CAO/ARO/AIO-04),同时进行化疗,在开始治疗的第1-14日和第22-35日持续输注氟尿嘧啶(250mg/m2),同时在放疗的第1、8、22和29日输注2小时的奥沙利铂(50mg/m2)。诱导和巩固化疗使用奥沙利铂(100 mg/m2)作为2小时的输注,然后输注2小时的亚叶酸(400 mg/m2),然后连续46小时输注氟尿嘧啶(2400 mg/m2),在第15天重复共3个周期(试验方案见附录2)。全直肠系膜切除术(TME)是独立于肿瘤反应的强制性手术,计划在TNT开始后约123天进行。非手术治疗被视为违反方案,但由拒绝TME的临床完全反应(cCR)患者子集(n=10)选择。不建议在TME后进行辅助化疗。
目的
主要终点是病理完全反应(pCR),之前已有报道。关于手术和病理目标的细节见附录1中的eMethods。本分析的次要终点包括DFS、局部区域复发和远处转移的累积发生率、总生存率(OS)以及根据4.0版《不良事件通用术语标准》(CTCAE)分级的慢性毒性。生活质量评估基于欧洲癌症研究与治疗组织(EORTC)问卷QLQ-C30和CR29作为患者报告的结果测量(PROMs)。根据Wexner评分对大便失禁进行分级,并在基线检查时、手术前后、随机化后6个月、12个月、24个月和36个月进行测量。
统计分析
主要和次要终点的统计分析、DFS的随机化和定义、局部区域复发和远处转移的累积发生率以及OS的详细说明见附录1中的eMethods。慢性毒性、生活质量和大便失禁在接受方案规定治疗且在评估时无疾病的患者中报告。QLQ-C30(问题29-30)评估了全球健康状况(GHS)/QoL评分,而其他地方将对所有PROMs进行详细分析。EORTC指南用于缺失数据的分析,而项目响应则从7点Likert型量表线性转换为0到100量表,并计算平均值(SD)。14名造口患者被排除在慢性腹泻和大便失禁分析之外。Wexner大便失禁评分显示为方框图(Tukey定义;见附录1中的eMethods)。使用R软件3.6版(R基金会)进行统计分析。在这里介绍的探索性分析中,双侧P<0.05被认为是显著的。统计分析于2015年6月15日至2018年1月31日进行。后续分析在2018年1月31日至2020年11月30日期间进行。
结果
临床试验参与和患者特征
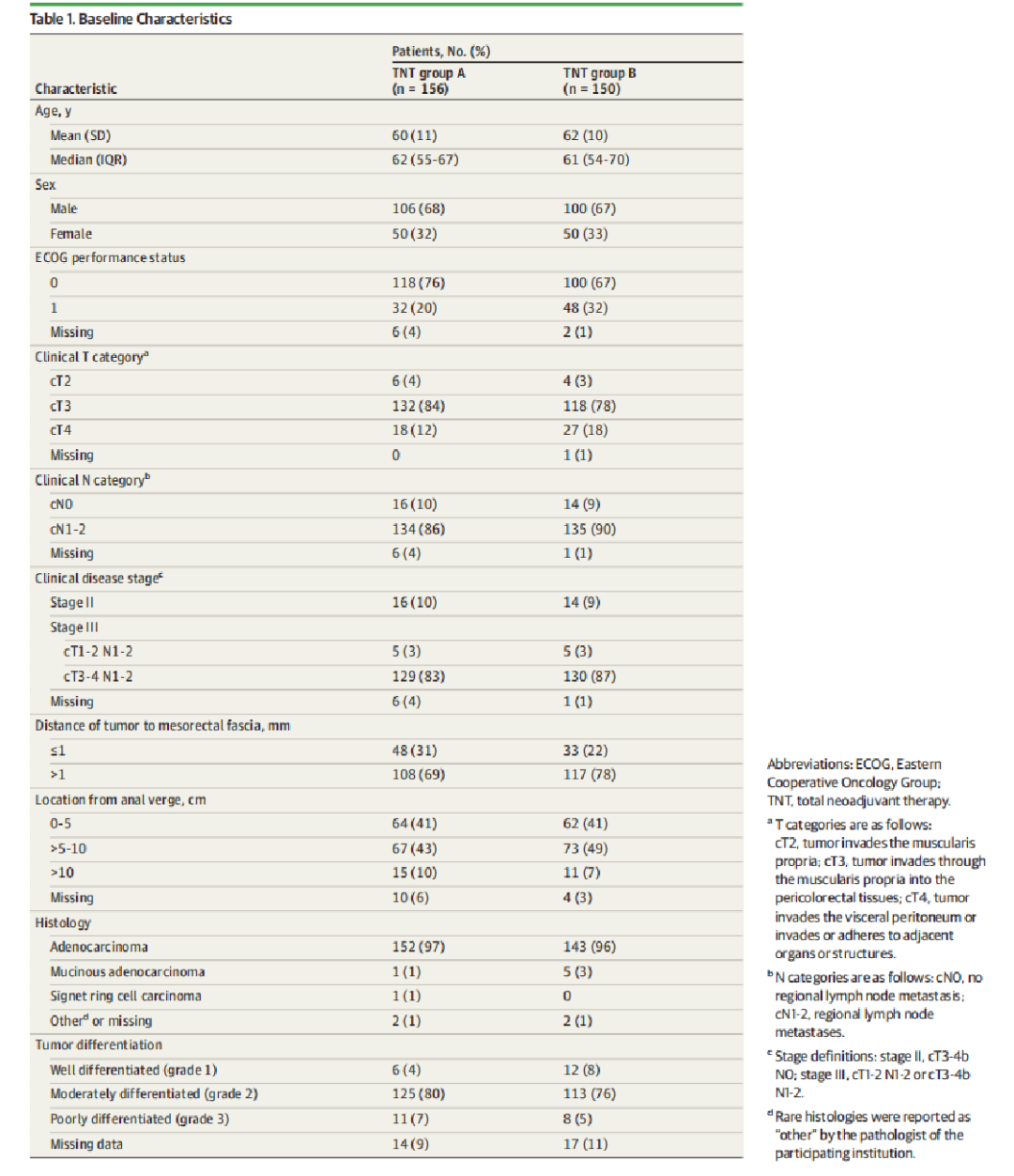
从2015年6月15日至2018年1月31日,在德国18个中心共招募了311名患者(附录1中的eMethods)。5名患者在登记后因撤回同意或违反协议而不合格。在剩下的306名符合条件的患者中,156名患者被随机分为A组(平均[SD]年龄,60[11]岁;106名男性[68%]和50名女性[32%]),其中治疗顺序为化疗、CRT和手术,150名患者被随机分为B组(平均[SD]年龄,62[10]岁;100名男性[67%]和50名女性[33%]),其中治疗顺序为CRT、化疗和化疗,和手术(图1)。总体而言,两组之间的基线特征较平衡;然而,在B组中,更多患者的ECOG为1分(A组156例中有32例[20%] vs B组150例中有48例[32%]),而肠系膜筋膜受累(≤1mm)在A组(156例中48例[31%] vs B组150例中有33例[22%])中,1 mm)的出现率略高。肛门边缘的肿瘤位置也显示出一些不平衡(表1)。在A组,156例患者开始诱导化疗,151例(97%)进行CRT,143例(92%)进行手术。在B组中,149(99%)接受了CRT,140(93%)开始了巩固化疗,143(95%)接受了手术(图1)。

疗效
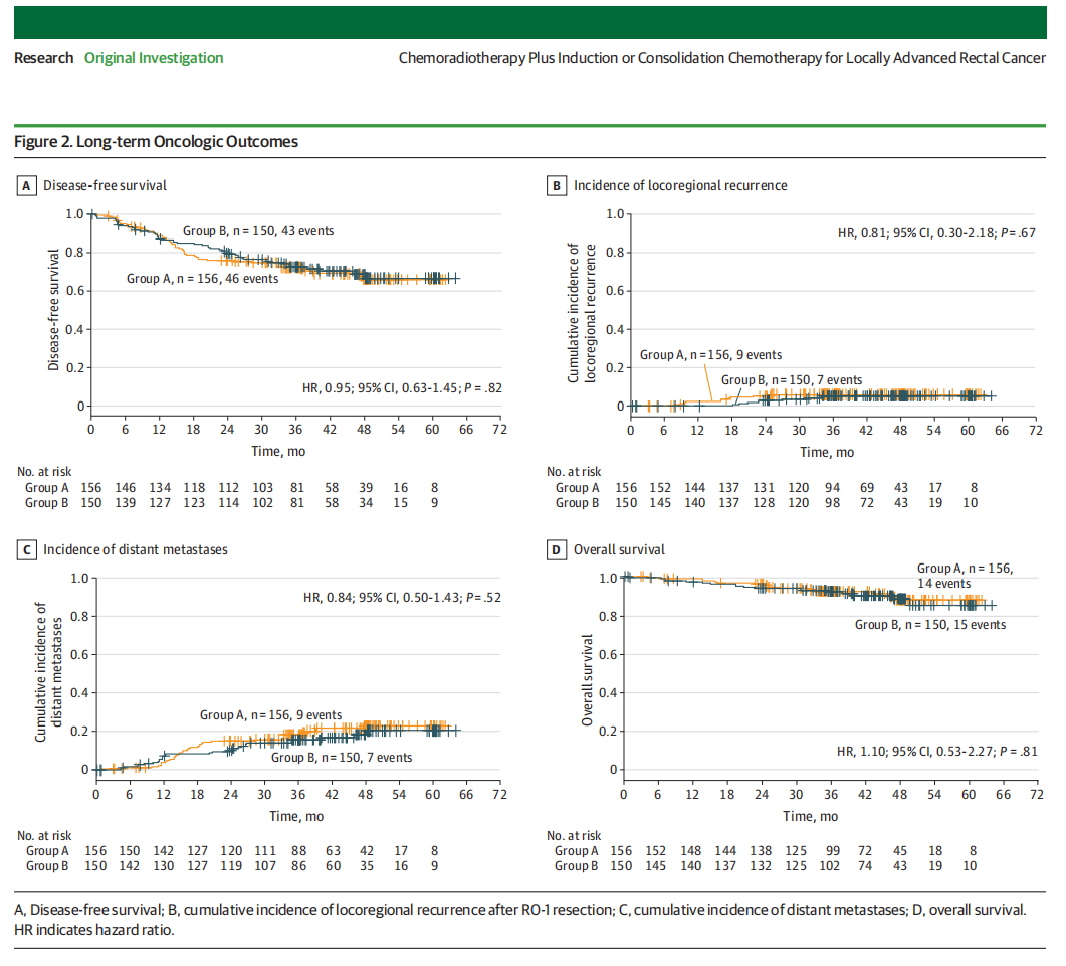
早期疗效结果,包括pCR、R0切除、急性毒性、手术发病率和治疗依从性之前已有报道。中位随访时间为43个月(范围35-60个月;IQR 35-49个月)。值得注意的是,我们的目标是对所有患者进行至少36个月的随访,而最后招募的患者的随访期为35个月。在死亡病例中(分别为A组和B组),2例(1例和1例)与治疗有关,14例(8例和6例)与直肠癌有关,1例(0例和1例)由第二原发肿瘤引起,12例(5例和7例)由其他原因引起(1例肾炎、1例心脏病发作、1例心律失常、1例非闭塞性肠系膜缺血、3例多器官衰竭、2例自杀和3例未知)。A组的3年无病生存率为73%(95%CI,66%-80%),B组为73%(95%CI,66%-80%)(HR,0.95;95%CI,0.63-1.45;P=0.82)。我们还对DFS进行了单独的多变量Cox比例风险模型分析,包括TNT组和两组之间存在潜在不平衡的基线参数(ECOG表现状态、肿瘤到直肠系膜筋膜的距离以及从肛门边缘的位置)(表1);在单独的多变量分析中,我们未能检测到两个TNT组之间的DFS差异(附录1中的表1)。A组和B组的3年累积局部复发率分别为6%(95%CI,2%-10%)和5%(95%CI,1%-9%)(HR,0.81;95%CI,0.30-2.18;P=0.67),A组和B组的远处转移率分别为18%(95%CI,12%24%)和16%(95%CI,9%-22%)(HR,0.84;95%CI,0.50-1.43;P=0.52)。两组的总生存率相似,A组为92%(95%CI,88%-97%),B组为92%(95%CI,88%-97%)(HR,1.10;95%CI,0.53-2.27;P=0.81)(图2)。根据基线特征对意向性治疗人群中的DFS进行亚组分析,未发现明显受益于一种TNT顺序而非另一种TNT顺序的患者亚组(附录1中的图2)。
A组156例患者中有6例(4%),B组150例患者中有4例(3%)在再手术时出现cCR,并拒绝手术。附录1中的图3总结了他们的临床结局。在这些患者中,A组1例在3个月后出现腔内肿瘤复发,通过腹会阴切除术治愈(R0),并在进一步随访期间保持无病状态。B组1例在TNT开始后27个月诊断为局部复发和远处转移(肝和肺),并接受姑息性化疗。其他8名患者持续cCR,到最后一次随访检查时仍无肿瘤。
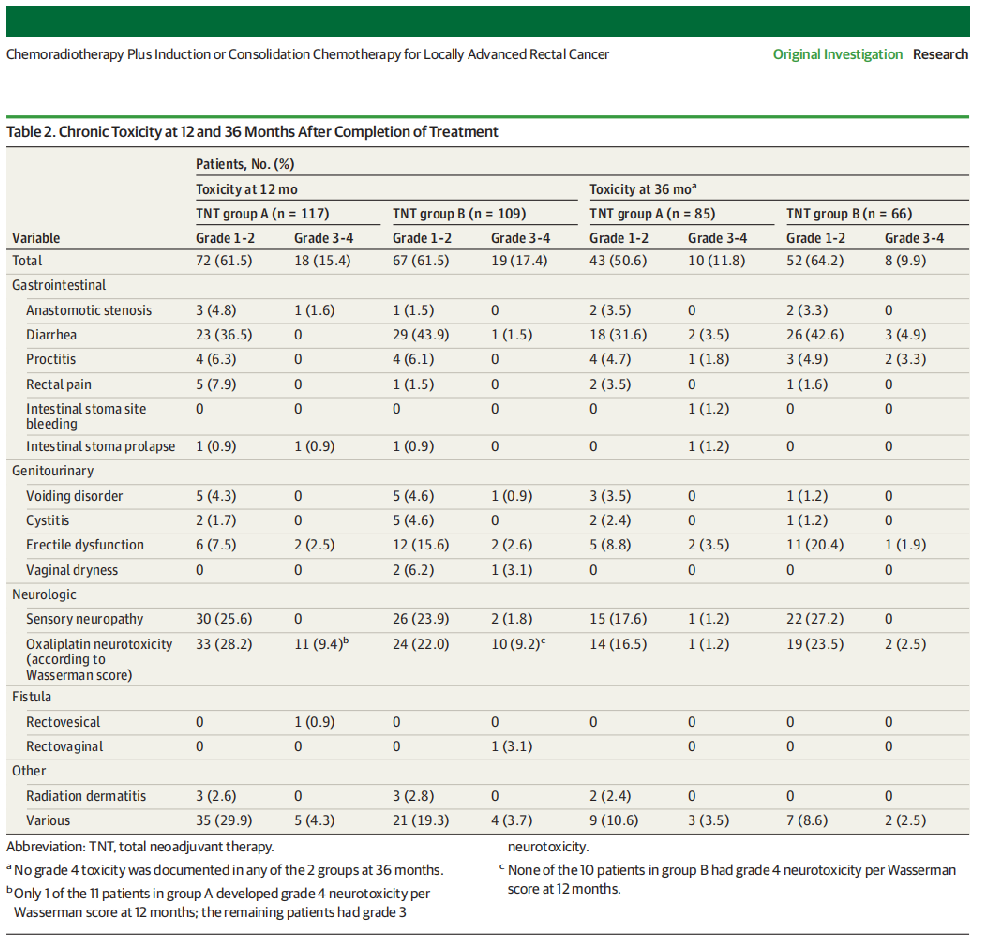
慢性毒性、GHS/QoL和Wexner失禁评分
12个月时,A组117例(15.4%)和B组109例(17.4%)的慢性毒性总分级为3至4级的比率分别为18例和19例;36个月时,A组85人中有10人(11.8%)和B组66人中有8人(9.9%)(表2)。根据Wasserman评分,奥沙利铂诱导的3至4级神经毒性从12个月时A组117例中的11例(9.4%)和B组109例中的10例(9.2%)降低到36个月时A组85例中的1例(1.2%)和B组66例中的2例(2.5%)。值得注意的是,只有1名患者(A组)在12个月时出现4级神经毒性,而两组在36个月时均未出现4级毒性(表2)。
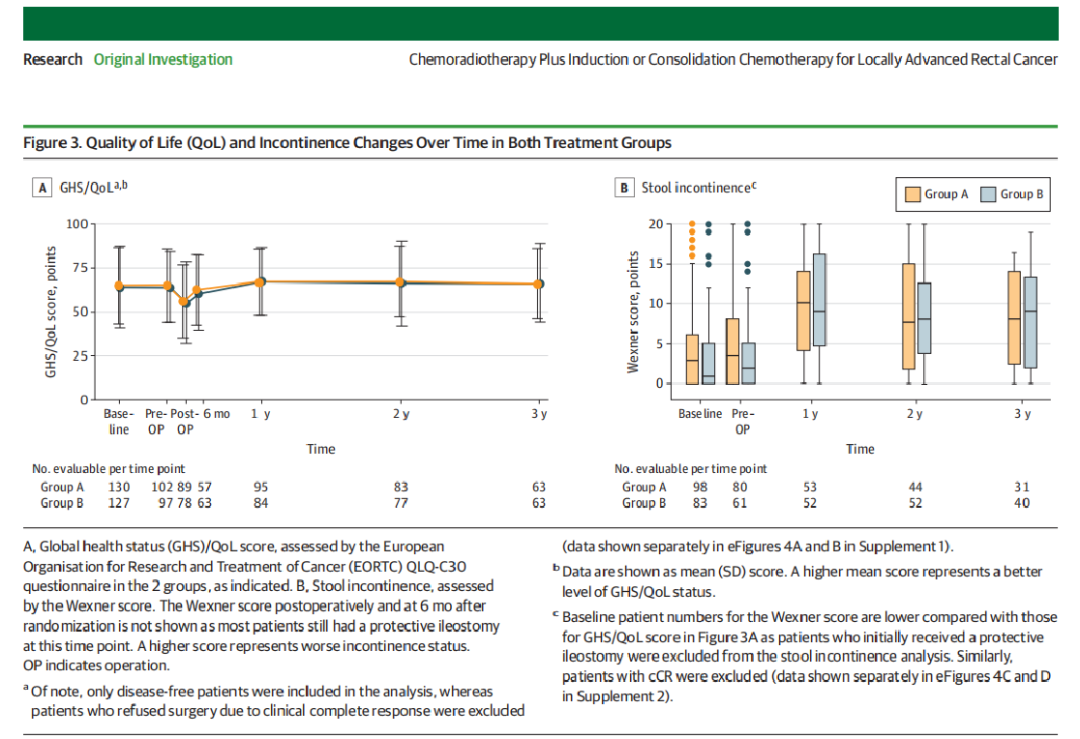
PROMs完成率在基线检查时为272/306(89%),在手术前为211/306(69%),在治疗完成时为177/306(58%),在12个月时为187/306(61%),在24个月时为165/306(54%),在36个月时为125/306(41%),两组之间的应答率或缺失项目没有差异。A组和B组的GHS/QoL得分没有差异,两组在手术后均下降,并在随机分组后12个月恢复到预处理水平(A组平均[SD]65.9[15.8]分,B组平均[SD]65.9[15.9]分)(图3A)。
根据Wexner问卷(附录1中的表2)评估的大便失禁在两组之间任何时候都没有差异。值得注意的是,两组患者的大便失禁评分在12个月时更差,在24个月和36个月时仅略有改善,但从未达到基线水平(图3B)。大便失禁的严重程度按照之前的报告进行测量(见附录1表3)。在A组,12个月时,53名患者中有6名(11.3%)出现正常大便失禁,53名患者中有18名(34%)出现轻微大便失禁,53名患者中有17名(32.1%)出现平均大便失禁,53例患者中有12例(22.6%)出现完全性大便失禁。B组在12个月时,52例中有5例(9.6%)出现正常大便失禁,52例中有19例(36.5%)出现轻微大便失禁,52例中有13例(25%)出现大便平均失禁,52例中有15例(28.8%)出现完全大便失禁。12个月时,A组大便失禁评分中位数为10分(IQR,4-14分),B组为9分(IQR,4.8-16.1分)。
附录1表4提供了8名NOM后持续cCR患者的慢性毒性。8名患者在12个月时的平均(SD)GHS/QoL得分为87(6)分(附录1中的图4A和B);6例患者中有1例(16.7%)出现正常大便失禁,6例患者中有5例(83.3%)在1年时出现轻微大便失禁,而未出现平均或完全大便失禁。12个月时,大便失禁中位数得分为2.5分(IQR,1.2-3分),组间无差异(补充1中的图4C和D)。
讨论
CAO/ARO/AIO-12的第一次报道显示,与A组相比,先进行CRT再进行化疗和TME与更高的pCR、更好的CRT依从性和更差的化疗依从性相关。在CRT期间,A组和B组分别有37%和27%发生急性3-4级毒性,在化疗期间,22%(两组)发生急性3-4级毒性。B组CRT至TME的较长时间间隔并未增加手术发病率。在此,我们介绍平均随访43个月后的两种TNT顺序的长期临床结果。二次分析的结果显示出两组之间的肿瘤学终点、慢性毒性、GHS/QoL或大便失禁无显著差异。
OPRA随机2期试验采用了与我们相似的设计,指定了局部晚期直肠癌患者,在基线时要求行腹会阴切除或结肠肛门吻合术,接受氟尿嘧啶为基础的CRT以及诱导或巩固化疗(8个周期的叶酸、氟尿嘧啶和奥沙利铂[FOLFOX]或6个周期的卡培他滨和奥沙利铂[CAPOX])的。该试验包括对接近cCR或cCR的患者选择NOM/局部切除。根据我们的经验,与化疗/CRT相比,前期CRT的依从性更好,化疗的依从性稍差。CRT/化疗组和化疗/CRT组的3-4级毒性发生率分别为45.5%和49%。中位随访25个月后,CRT/CT组和CT/CRT组的3年无病生存率分别为78%和77%。3年无转移生存率没有差异。CRT/CT顺序与更佳的3年无TME生存率相关。因此,在两个测试TNT最佳顺序的试验中,先进行CRT(以及相关的更长的再分期或手术的间隔)在不影响DFS和无转移生存率的情况下,产生了更好的pCR(CAO\/ARO\/AIO-12)或持续的cCR/器官保存(OPRA)。
关于使用SCRT的TNT,波兰II期试验比较了SCRT后3个周期的FOLFOX与基于氟尿嘧啶/奥沙利铂的CRT。在最初的报告中,TNT组的OS更好,其R0切除率(主要终点)、pCR、局部控制和DFS率与CRT组类似;然而,更新后的报告中没有显示OS的差异。RAPIDO 3期试验随机将高危直肠癌患者(cT4、直肠系膜筋膜受累、壁外血管侵犯、cN2和外侧淋巴结阳性)分配到基于卡培他滨的CRT,然后进行选择性辅助化疗组以及SCRT,再进行巩固化疗(6个周期的CAPOX或8个周期的FOLFOX)及手术对照组。与对照组相比,实验组的治疗显著改善了与疾病相关的3年治疗失败(主要终点),主要来源于3年远处转移率降低,OS相当。实验组的pCR率翻番。
使用氟尿嘧啶、亚叶酸钙、伊立替康和奥沙利铂(FOLFIRINOX)诱导化疗,然后进行CRT,已经在PRODIGE23 3期试验中对照标准CRT,随后进行手术和辅助化疗进行了试验。与对照组相比,实验组达到了主要终点—3年无转移生存率,这主要是因为3年无远处转移生存率增加。GCR-3 2期试验将19名患者随机分为诱导化疗组,在CRT或辅助化疗前使用4个周期的CAPOX。TNT组3~4级急性毒性和化疗依从性较好;然而,pCR率和5年无病生存率没有差异。在NRG-GI002 2期试验中,诱导化疗后在CRT中添加多聚(ADP核糖)聚合酶抑制剂维利帕尼未能改善主要终点,新辅助直肠评分;在随后的研究中,在TNT中添加程序性细胞死亡1免疫检查点抑制剂帕博利珠单抗是安全的,但没有改善新辅助直肠评分。
因此,随机试验中提供了两种TNT顺序对照标准CRT后TME加或不加辅助化疗后疗效都有提高的数据。首选哪种TNT顺序仍然存在争议,可能取决于不同的预处理因素或治疗目标。根据我们试验中的预处理特征对DFS进行的探索性子集分析,没有确定从一种TNT顺序中明显获益的患者的子集,但该分析可能缺乏足够的统计效力。有人假设,诱导化疗起效早、依从性好,可以更好地控制微转移疾病。然而,在我们的CAO/ARO/AIO-12试验和OPRA试验中,两组之间的DFS和无转移生存率相似。相反,诱导化疗可能有助于根据治疗反应选择性地省略CRT,如PROSPECT试验(结果待定)所述,而如果以NOM和器官保存为目标,则先进行CRT/SCRT再进行巩固化疗可能是首选的TNT方法。
不管有无器官保存,关于TNT后的慢性毒性、PROMs/QoL和功能结局的数据仍然有限,应作为进一步报告和试验设计的优先事项。在我们的研究中,两组之间的3级至4级慢性毒性没有差异。我们未能发现两组患者在大便失禁方面的差异,该功能在术后预期会恶化,在36个月时仅略有改善,但从未达到基线水平,而GHS/QoL评分在随机分组12个月后恢复到预处理水平。
在PRODIGE23试验中,两组患者的GHS均随着时间的推移而改善,而TNT患者的总体生活质量有改善的趋势;无尿失禁报告。在RAPIDO试验中,两组之间的GHS和总体生活质量相似,低位前切除综合征评分也相似;未提供慢性毒性数据。关于比较TNT后接受TME和NOM的患者的生活质量和功能结局的OPRA试验的结果尚待确定。有趣的是,在我们的试验中,8例NOM患者的GHS/QoL和大便失禁评分与接受TME的患者的评分相比是有利的;然而,由于患者人数较少,无法得出结论。
局限性
我们的研究有几个局限性。首先,由于pCR是主要终点,所以本试验的设计目的不是为了证明长期肿瘤终点、毒性、生活质量和功能结局的差异。尽管中位随访时间为43个月,但在更长的随访时间后,对肿瘤学结果的进一步评估对于观察两组之间是否存在任何差异非常重要。第二,在OPRA研究中,cCR患者的NOM和器官保存不属于研究方案的一部分。第三,患者收集PROMs和大便失禁数据的依从性随着时间的推移而降低。第四,虽然对生活质量进行了完整的案例分析,但这一衡量标准纯粹是描述性的,因为我们没有对各组进行任何正式的比较。
结论
据我们所知,这是第一个在对两种TNT顺序进行头对头比较后报告长期临床结果完整数据的随机临床试验。两组的长期肿瘤学结果没有差异。我们认为,如果器官保存是优先事项,那么预先CRT加巩固化疗可能是首选TNT顺序。该顺序在不影响DFS、毒性或生活质量的情况下,达到了较高的pCR率。根据正在进行的ACO/ARO/AIO-18.1试验中的RAPIDO方案,CAO/ARO/AIO-12的B组中测试的TNT方案在调整后被选择用于与TNT进行比较,该试验使用3年器官保存率作为主要终点。
专家简介
李志磊
中国科学院大学附属肿瘤医院-温州医科大学联合培养硕士研究生
韦青
中国科学院大学附属肿瘤医院(浙江省肿瘤医院肝胆胰胃内科) 主治医师
北京大学医学博士
CSCO青年专家委员会委员
CSCO青年专家委员会秘书
CSCO青委翻译小组成员
浙江省肿瘤精准治疗专委会青委会秘书
《肿瘤综合治疗杂志电子版》编委
JCO中文版-消化肿瘤专刊编委会青年编委













 苏公网安备 32059002004080号
苏公网安备 32059002004080号


