作者
陈倩萍1,2,谢丽3,朱骥1,2*
单位
1. 浙江省肿瘤医院,杭州310022,
2. 中国中国科学院基础医学与肿瘤研究所,杭州310022,
3. 中国上海交通大学医学院临床研究中心,上海200025,中国
*通信作者
朱骥教授,邮箱:zhuji@zjcc.org.cn
1. 浙江省肿瘤医院腹部肿瘤放射治疗科,浙江省杭州市拱墅区(310022)
2. 中国中国科学院基础医学与肿瘤研究所,杭州310022,
TAUTEM研究是一项随机、对照、前瞻性、多中心的Ⅲ期非劣效性研究,该研究旨在比较新辅助放化疗(CRT)联合经肛门内镜显微手术(chemoradiotherapy and transanal endoscopic microsurgery, CRT-TEM)与全直肠系膜切除术(total mesorectal excision, TME )在T2-T3abN0M0期直肠癌患者中的局部复发与术后并发症发生情况。该项研究的主要研究终点为两年局部复发率。次要研究终点为CRT的耐受性及其副反应发生率;CRT后的临床缓解率(clinical complete response, cCR)及病理缓解率(pathological complete response, pCR);术后并发症发生率及死亡率;生活质量;患者的3年总生存期等。在接受CRT-TEM的患者中,新辅助放化疗后副反应发生率为29.6 % ( 24 / 81 );pCR率为44.3 % ( 35 / 79 );器官保留率为82.7 % ( 67 / 81 );CRT-TEM组术后并发症发生率为20.7 % ( 17 / 82 ),而TME组术后并发症发生率为50.6 % (41 / 81)。TAUTEM的研究结果提示新辅助放化疗联合局切将为早期浅表结直肠癌患者实现器官保留奠定基础。
关键词
直肠癌;新辅助放化疗;局部切除;经肛门内镜显微手术( TEM );全直肠系膜切除术( TME );非劣效试验
Interpretation of TAUTEM Study and Short-Term Outcomes: Neoadjuvant Radiotherapy Combined with Local Excision Versus Total Mesorectal Excision in the Treatment of T2-T3abN0M0 Rectal Cancer
Authors:
Qianping Chen1,2,Li Xie3, Ji Zhu1,2*
Affiliation:
1. The Cancer Hospital of the University of Chinese Academy of Sciences (Zhejiang Cancer Hospital), Hangzhou, 310000, China.
2. Institute of Basic Medicine and Cancer (IBMC), Chinese Academy of Sciences, Hangzhou, 310000, China.
3. Clinical Research Center, Shanghai Jiao Tong University School of Medicine, Shanghai, 200025, China.
*Corresponding author:
Prof. Ji Zhu, E-mail: zhuji@zjcc.org.cn
1. Department of Abdominal Oncology Radiotherapy, The Cancer Hospital of the University of Chinese Academy of Sciences (Zhejiang Cancer Hospital), Gongshu District, Hangzhou, Zhejiang Province, China (310022).
2. Institute of Basic Medicine and Cancer (IBMC), Chinese Academy of Sciences, Hangzhou, 310022, China.
Abstract:
The TAUTEM study is a randomized controlled, prospective, multicentre phase III non-inferiority trial designed to compare neoadjuvant radiotherapy (CRT) combined with transanal endoscopic microsurgery (CRT-TEM) with total mesorectal excision (TME) in patients with rectal adenocarcinoma staged as T2-T3abN0M0 in terms of local recurrence and postoperative complications. The primary endpoint was the two-year local recurrence rate, while the secondary variables were the tolerance of CRT and its adverse effects; clinical complete response (cCR) and pathological complete response (pCR) after CRT; postoperative complication rate and mortality; quality of life and the 3-year overall survival (OS). Among patients undergoing CRT-TEM, the incidence of side effects after neoadjuvant radiotherapy was 29.6 % (24 / 81); the pCR rate was 44.3 % (35 / 79); the organ preservation rate was 82.7 % (67 / 81); the incidence of postoperative complications in the CRT-TEM group was 20.7 % (17 / 82), whereas that in the TME group was 50.6 % (41 / 81). The findings of TAUTEM indicated that neoadjuvant radiotherapy in conjunction with local excision would lay the foundation for organ preservation in patients suffering from early superficial rectal cancer.
Keywords: Rectal cancer; neoadjuvant radiotherapy; local excision; transanal endoscopic microsurgery (TEM); total mesorectal excision (TME); non-inferiority trial
TAUTEM研究作为一项随机、对照、多中心的Ⅲ期非劣效性研究,于2022年发表在肿瘤学年鉴(Annals of Oncology)上[1],该研究对比了新辅助放化疗联合局部切除(CRT-TEM)与全直肠系膜切除术(TME)在早期浅表直肠癌(T2-T3abN0M0)患者中的局部复发率与术后并发症情况,旨在探索CRT联合局切在早期直肠癌器官保留中的作用。
1
研究背景
目前,T1-T2N0M0期直肠癌患者的治疗方式差异很大。无不良预后因素的T1N0M0患者,一般采取局部切除;而对于伴有不良预后因素的T1期及T2期患者,淋巴结转移率高达12-28%[2],因此选用全直肠系膜切除术(TME)对此类患者获益更大。虽然TME的出现改变了直肠癌手术的方式,将局部复发率降低至2-11%,全身复发率降低至25-40%[3,4];但对于低位直肠癌患者而言,接受TME手术将不可避免地在腹部建立一个暂时或永久的造口,该术式不但伴有较高的术后并发症发生率及死亡率(分别为38%-54%和0.9%-1.5%)[5],还将使30%-60%的患者出现泌尿生殖系统功能损害和低位前切除综合征[6]。与之相比,采用经肛门内窥镜手术实施的局部切除(TEM)既实现了肛门保留[7],还避免了泌尿生殖系统功能损伤,同时术后并发症发病率及死亡率也仅有23%0.3%[8]。此外,对于局部晚期直肠癌患者而言,术前新辅助放化疗(CRT)的开展能促进肿瘤分期降级、降低术后局部复发并显著延长患者生存时间[9]。2010年,Lancet Oncology上一项研究总结了14项临床试验中接受术前CRT及TME的晚期直肠癌患者的病理完全缓解(pathological complete response, pCR)情况及5年无病生存期(Disease-free survival, DFS)。结果发现CRT联合TME的疗法将使8%-27%的晚期直肠癌患者达到pCR, 且该部分患者的5年DFS为83.3%[10]。
尽管目前已有多个观察或回顾性研究证实了T2N0M0期直肠癌术前CRT有利于实现器官保留[11],但关于这一结论的多中心、前瞻性研究仍较为罕见。TAUTEM研究作为前瞻性的Ⅲ期非劣效性研究,通过比较早期浅表性直肠癌患者接受CRT-TEM与接受单独TME术后病情复发情况与并发症发生情况,评估新辅助放化疗联合局切在疗效及安全性上是否非劣于全直肠系膜切除术,为T2-T3abN0M0期直肠癌患者的器官保留提供循证医学基础。
2
研究方案
TAUTEM研究是一项在西班牙17个结直肠外科单位开展的III期、多中心、前瞻性、开放标签、非劣效性、随机对照试验。
纳入标准:① 通过直肠镜检查明确距肛缘距离≤10cm的直肠腺癌;② 术前通过直肠内超声(EUS)分期为cT2N0或直肠磁共振成像(MR)分期为cT2-cT3abN0患者。两者间,取较高分期为临床诊断;③ 美国麻醉师协会(ASA)分类系统为III级或以下;④ 根据腹部-胸部CT结果明确无远处转移。
排除标准:① 根据腹部-胸部CT结果明确存在远处转移;② 同期存在其他结直肠腺癌;③ 术前活检为未分化的直肠腺癌,(G III级-分化不良,高等级-或G IV级-未分化,高等级);④ 不耐受术前化疗或放疗;⑤ 未签署知情同意书。
CRT-TEM组:新辅助放化疗联合经肛门内镜显微手术。CRT:每周放疗5天,每次1.8Gy,总剂量45Gy,外加肿瘤区域的5.4Gy增量;放疗期间同步口服卡培他滨,每天两次,每次825mg/m2。CRT完成后的第7周,通过直肠MRI评估临床反应,评估标准见2.4。符合标准的患者于CRT后第8周进行TEM手术。
TME组:TME被安排在患者首诊后一个月内进行。TME的具体操作参考Heald的描述,根据瘤灶的位置及中心,使用开腹或腹腔镜方法,伴或不伴保护性回肠造口。
所有患者按照1:1随机分配至TME或CRT-TEM组,使用计算机生成的随机号码列表。盲法和监查由牵头中心和CRO公司开展。所有参与医院只能获得自己的病人数据,只有牵头中心了解整个研究数据情况。患者的治疗分组对统计分析人员设盲,直到完成最终分析。
病理:为了评估经CRT治疗患者的肿瘤退缩等级(tumor regression grade, TRG),采用了Bouzourene分类方法。对于TEM术中及术后病理,记录病变的大小(mm)、腺癌的分化程度、T分期、是否有静脉、淋巴或神经周围浸润及切缘是否阳性。而TME术中及术后病理则记录了病变的大小、分化程度、是否存在静脉、淋巴或神经周围浸润、切缘是否阳性以及清扫的淋巴结情况(清扫的总淋巴结及阳性淋巴结)。
CRT不同临床和病理反应的划分:根据RECIST标准和MRI结果,在CRT后第7周评估临床反应。完全缓解(CR)是指肿瘤完全消失,部分缓解(PR)是指病灶最大直径缩小>30%,疾病稳定(SD)是指病灶直径缩小<30%或直径增加<20%,疾病进展(PD)是指病灶的最大直径增加>20%。
CRT不同病理反应的划分:根据Bouzourene分类标准以肿瘤消退的程度评估,TRG1指肿瘤细胞完全退缩,TRG2指存在个别肿瘤细胞,TRG3指肿瘤区域<纤维化区域,TRGR4指肿瘤区域>纤维化区域,TRG5指肿瘤区域进一步进展。其中,TRG1被认为是病理水平肿瘤完全退缩;TRG2和3被认为是病理水平肿瘤部分退缩。
CRT-TEM组转为TME组的标准:CRT后无临床缓解(SD或PD)、TEM术后病理分期高于ypT3ab、手术切缘阳性(深度或侧面低于1mm)或术后病理示预后不良的相关特征。符合这些标准的患者被安排在4-6周内进行完整的TME手术。
随访:前两年,每4个月复查直肠镜+活检+CEA+CA199;每年复查总FCS+腹部、盆腔及胸部CT。
主要研究终点:2年局部复发率,其复发定义为残余疤痕、吻合口或切除的瘤床活检中出现腺癌。
次要研究终点:人口统计学变量,病变特征,CRT的急/慢性不良反应、两种术式术后30天的并发症发生率、综合并发症指数(CCI)、吻合口漏(AL)等指标。
假设对照组(TME)的非复发率为95%,试验组(TEM)的非劣效性界值设置为10%,设定检验水准α为单侧5%,统计学检验效能设置为80%,每组需要78名患者。进一步约估计10%可能失访,拟入组样本量为173例。
调整意向性治疗(modified intent-to-treat, mITT)分析中,剔除在开始治疗前已退出或被排除标准排除的患者。符合方案(Per-protocol, PP)分析包括完成TME的患者和CRT-TEM组中完成CRT和TEM且不符合排除标准的患者。
定量变量以均值和标准差描述,或根据情况以中位数和四分位数范围描述。分类变量用绝对数和百分比来描述。对定量变量的统计分析,如果符合其应用条件,则采用参数Student ’s T检验,否则采用非参数化的Mann-Whitney U检验。在分类变量的统计分析中,使用了Pearson的Χ2检验或Fisher的精确检验。P值小于0.05时认为具有统计学意义。
3
研究结果
本次研究预纳入364例患者作为受试者,在随机化分组之前基于排除标准排除191名患者。在剩下的173名随机患者中,87人被分配到TME对照组,86人被分配到CRT-TEM组,TME组的6名患者和CRT-TEM组的5名患者在随机化分组后因符合排除标准而被排除,最后每组有81名患者被纳入mITT分析。
TME组的81/81名患者都接受了手术。CRT-TME组的一名患者由于不耐受卡培他滨而没有完成CRT,最后80/81名患者(98.8%)完成了新辅助治疗。CRT后,总计6名患者从CRT-TEM组排除:其中3名患者在CRT后的MRI报告中显示PD,2名患者在术中转为TME(一名由于癌灶位置在腹膜折返以上,另一名因穿孔无法缝合),还有一名患者采用了 "观察和等待(watch and wait, WW) "策略。在其余74名接受TEM的患者中,8人因术后病理结果而退出,并施以TME手术。最后,用于PP分析的CRT-TME样本为66/81例患者。
在mITT或PP分析中,TME组和CRT-TEM组在性别、年龄、结肠镜检查、EUS、MRI或最终的临床诊断方面没有统计学上的显著差异,两组间入组患者基线特征均衡,具有可比性。
术前研究变量分析:在mITT分析中,患者对CRT的依从性较高(80/81, 98.8%),CRT后的副反应发生率较低(24/80, 29.6%),且CRT后的影像学显示肿瘤降期显著(31/80, 40.3%)。
术中及术后30天研究变量分析:与TME组相比,CRT-TEM组行临时或永久性造口率低(4.9% vs 58%, P<0.001);且CRT-TEM组的手术时间和手术失血量都显著低于TME组(88.6 vs 252.5, P<0.001; 22.6 vs 198.3, P<0.001)。术后30天并发症发生率显示:CRT-TEM组的并发症发生率与综合并发症指数(comprehensive complication index, CCI)也显著低于TME组(20.7 % vs 50.6%, P<0.001;8.7 vs 0, P<0.001)。其中。两者术后并发症发生率的差异主要由手术因素导致(13.4 % vs 43.2%, P<0.001)。此外,CRT-TEM组患者住院时间更短,平均为3.7天(95% CI:2.4 ~ 5),而TME组为10.6天(95% CI:9 ~ 12.2)(表1)。
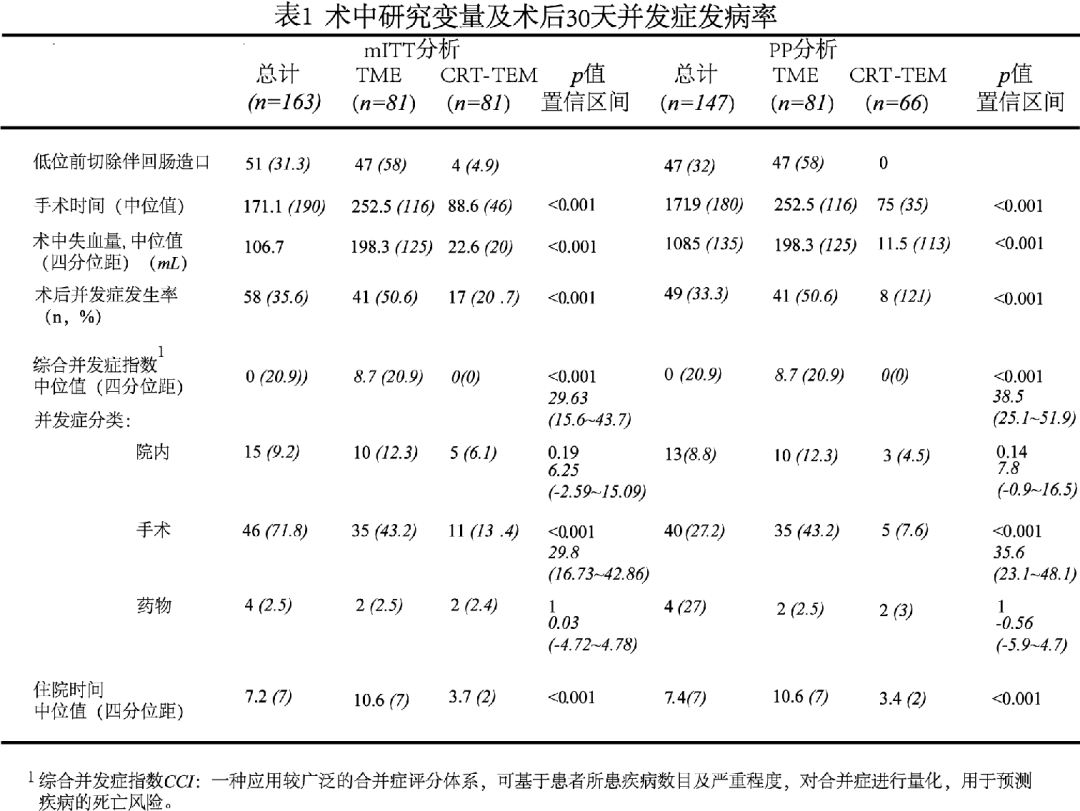
术后研究变量分析:CRT-TME组的经新辅助放化疗后的pCR率为44.3%。此外,TME组中,17名患者(21%)出现淋巴结转移。而CRT-TEM组因局部切除的疗法限制,未进行淋巴结评估(表2)。
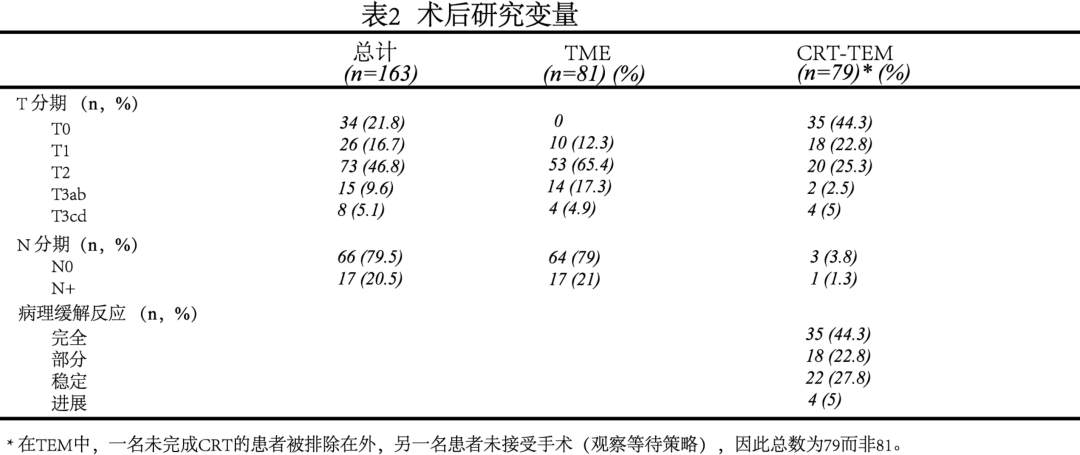
综上,CRT-TEM组术前的CRT依从性高,不良反应发生率低;术中较TME组回肠造口率低,手术时间及失血量少;术后并发症发生率低,住院时间短。
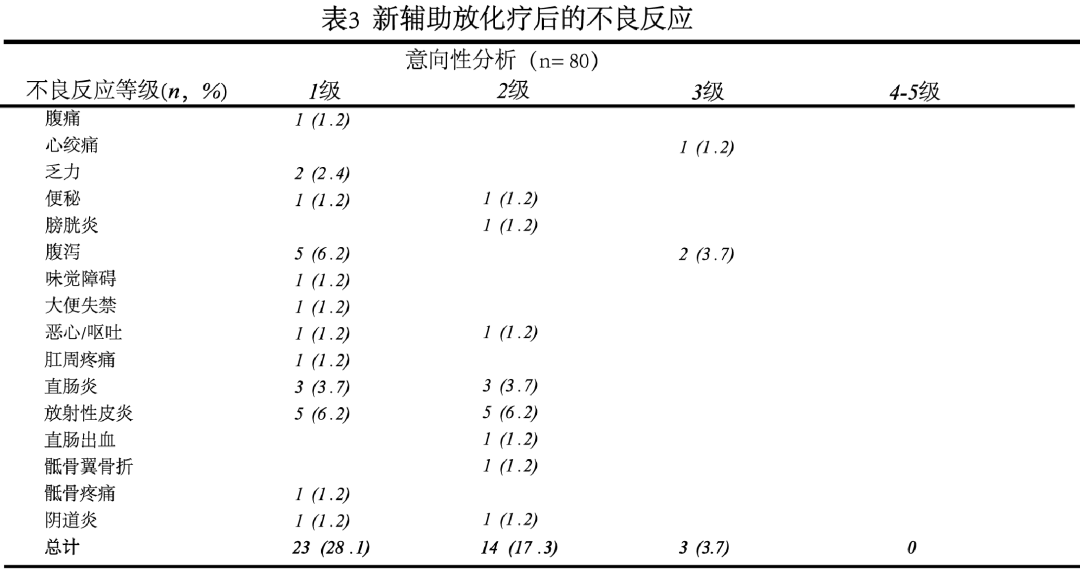
作为一项非劣效性研究,新辅助放化疗后的副反应将是本研究的关注重点。对于CRT-TEM组,研究者认真分析了CRT后各等级副反应的发生率及严重程度。患者经CRT后的副反应主要集中于1-3级, 而未见4-5级不良反应。其中,最常见的不良反应依次为腹泻、放射性皮炎和直肠炎(表3)。就CRT副反应发生程度而言,CRT-TEM组未见严重不良反应,其安全性较高。
4
讨论与思考
4.1.1选择非劣效试验设计有何优势?
通常当开展临床试验时,最常见的选择是优效试验,假设新干预措施疗效能够优于对照组。然而,某些情况优效试验可能不完全适用,例如使用安慰剂对照不符合伦理要求,同时随着治疗疗效的不断改善,开发更加优效的干预措施变得越来越难以实现。
非劣效试验以标准治疗作为阳性对照,目标是确证虽然试验组的疗效低于阳性对照的疗效,但差异在临床可接受的范围之内,同时,试验组相比对照组具有其他方面的显著优势,例如不良反应更少、使用更加方便灵活、价格更便宜等。非劣效试验有助于寻找好的替代疗法,即与既定疗法疗效相近的新疗法,此外,非劣效试验方法也可用于评估有效疗法是否足够安全。近年来,非劣效试验已成为评估药物、器械、生物制剂和其他疗法的重要工具。
4.1.2局部复发作为主要终点合理吗?
TAUTEM研究中主要研究终点为局部复发(local recurrence),其定义是在残留瘢痕、吻合口或切除的肿瘤床上的活检中存在腺癌。
一般而言,非劣效临床试验选择研究试验终点有几个特别需要考虑的地方,包括以下方面:①选择能够在阳性对照与安慰剂比较试验中找到该研究终点的历史数据,以便可以选择合理的非劣效界值;②研究终点数据能够被准确和完整地收集,较少出现缺失,因为研究终点数据缺失可能使试验倾向于得出非劣效结论;③避免选择测量方法主观性较强的研究终点,如采用量表或评分,因为对所有受试者进行相似评价即可使试验倾向于得出非劣效结论, 盲法无法控制此偏倚;④避免选择具有不可调和的利益和风险组分的复合终点作为研究终点,例如包含安全性和有效性评价指标的复合终点。
4.1.3 10%非劣效界值确定依据可靠吗?
本研究中,关键的样本量含量参数设置为:①检验水准α=单侧0.05;②检验水准=80%(β=0.2);③效应值:对照组非复发率95%(复发率5%);④非劣效界值=10%;⑤随机分配比例=1:1,估计得到每组需要78例,考虑到10%失访,进一步扩大至每组87例,两组共计173例。其中,最关键效应值对照组复发率5%来自于ACOSOG Z6041单臂研究,中位随访58个月,总体复发率10%。
非劣效临床试验样本量估计参数设置中,对样本量估计产生显著影响的参数是非劣效界值。非劣效界值是指试验组与阳性对照相比在临床上可接受的最大疗效损失,不应大于阳性对照相对于安慰剂的临床获益,以确保非劣效试验具有足够的检定灵敏度。一般而言非劣效界值越小,所需样本量越大。需要注意的是,不能因为期望开展规模较小的试验而有意识地选择较宽的非劣效界值。
近年来,常用确定非劣效界值的方法包括:点估计法(Point Estimate Method)、固定界值法(Fixed Margin Method)、综合法(Synthesis Method)、德尔菲法( Delphic Method)等。美国FDA推荐使用固定界值法和综合法,该方法主要基于阳性对照与安慰剂、试验干预与阳性对照、可接受的最大疗效损失比例之间的相互关系。也有学者认为,在治疗进展迅速以及把握度不断增加的情况下,仅根据阳性对照相对于安慰剂的疗效基础来选择非劣效界值是不够的,建议基于“最佳”和“次佳”阳性对照之间的疗效差异选择非劣效界值。
4.1.4非劣效分析究竟该用ITT集还是PP集?
意向性治疗原则(Intention-to-treat set,ITT)是指基于受试者的治疗意向(即计划的治疗方案)而不是实际给予的治疗进行评价的原则,遵循该原则需要对所有随机化受试者完成随访以获得研究结局,但在实践中很难达到这一理想状态。符合方案集(Per-protocol set,PP)是指由对方案的依从性较好的受试者子集所产生的数据集,依从性是指完成干预、可获得测量值以及无重大方案违背等。
对于非劣效试验,如果ITT人群中出现大量失访、退出、替代治疗或组间交叉等试验质量问题时,试验组不会比阳性对照组显示出更好的疗效,反而可能会缩小组间疗效差异,从而得出非劣效的假阳性结论,因此,ITT人群不是非劣效试验的最佳分析人群。但PP人群在非劣效试验中同样存在困境,由于PP人群排除了不符合入选标准、未被随机化以及违背方案等的受试者,减少了脱落和不依从对试验结果解释的潜在影响,所以该人群在某种程度上被认为是非劣效试验的优选或替代分析人群。但是,PP人群在非劣效试验中的预期保守作用尚未探索清楚,受试者数量减少、基线特征不平衡等因素也可能会引入偏倚。目前共识一般是对非劣效临床试验,ITT人群和PP人群是同等重要的,应同时进行分析,只有两个分析结果均得出非劣效结论,才认为试验的非劣效结论可靠。
4.1.5 非劣效结论解读时需要注意什么?
恒定假设(Constancy Assumption)是非劣效试验的统计推断所需的一个关键假设,要求在当前非劣效试验中阳性对照的疗效要与其历史类似试验中观察到的疗效保持一致。考虑到本研究执行周期长达十余年之久,在未来公布主要研究终点非劣效检验结果时,应谨慎考虑恒定假设是否仍然成立?此外,从复盘的角度看,本研究是否应考虑预先设计期中分析与监测?在非劣效试验中进行期中分析/监测(Interim Analysis/Monitoring)的主要优势是可减少受试者对劣效治疗的暴露。当试验组的疗效劣于阳性对照时,适当的期中分析/监测可以及早发现并停止试验;反之,当试验组的疗效显著优于阳性对照时,通过期中分析/监测发现后也应尽早停止试验。期中分析/监测应纳入试验设计中,制定正式计划,并作为数据监查委员会的审议指南。
4.2.1优化低位直肠癌人群
在GRECCAR2[12]研究中,研究者通过一项III期前瞻性、开放性、多中心、随机对照研究,比较了T2-3N0-1M0直肠癌患者采取局部切除术对比全直肠系膜切除术的疗效差异。GRECCAR2研究纳入的直肠癌患者癌灶距肛距离的中位数为4cm,即50%患者为距肛4cm以内的低位直肠癌;而本TAUTEM研究中,纳入的直肠癌患者癌灶距肛距离的中位数为6.6cm,即半数以上患者为距肛6.6cm以上的中高位直肠癌。而TME术中行回肠造口对于中高位直肠癌患者而言是非必需项。此外,研究显示距肛6cm的直肠癌患者中,超过90%能保留括约肌功能以实现直肠功能保留[13]。以上数据反应:TAUTEM研究中纳入患者癌灶的距肛距离可能过高,以低位直肠癌为主更能说明CRT-TEM疗法对于直肠癌患者的器官保留获益。
4.2.2延长CRT-TEM间隔
2016年,ESMO大会结直肠癌专场汇报了一项来自英国皇家MARSDEN医院的多中心、前瞻性、随机研究,研究者发现对于237例局部进展期直肠癌患者(CRM<1mm、肿瘤邻近括约肌平面、mrT3c及以上、mrEMVI阳性),新辅助放化疗后间隔12周对比6周再行TME将获得更高的T分期降期率(58% vs 43%,P=0.019)及pCR率(20% vs 9%,P<0.05)(2016 ESMO Abstract4520)。而在本研究中,研究者在CRT后8周行TEM手术。因此,适当延长CRT与TEM的间隔时间在一定程度上或许能进一步实现早期直肠癌患者的分期降期,提高pCR率以增加器官保留率。
4.2.3补充骨髓抑制分级
近年来,随着研究者们对全程新辅助治疗(total neoadjuvant therapy, TNT)模式或类TNT(TNT-like)模式越来越深入的探索,短程或长程放疗作为TNT的重要组成部分,很大程度上改善了经典模式的疗效,但同步放化疗也将增加骨髓抑制的发生率。CAO/ARO/AIO-12研究中,66% 的直肠癌患者在CRT后出现1-2级以白细胞降低为主的骨髓抑制[14],而Clinclare研究中,TME术前先行放疗同步卡培他滨化疗,也将诱发白细胞降低及中性粒细胞降低[15]。而在TAUTEM研究中,研究者未对CRT后的骨髓抑制程度进行评估,因此本研究对于CRT的安全性评价是不完整的。
4.2.4纳入巩固化疗疗程
本研究中,虽然术前纳入的直肠癌患者分期为T2-T3abN0M0,但21%的TME组患者术后发现淋巴结转移。基于本研究随机化分组的原则,在CRT-TEM组中也存在20%淋巴转移的潜在风险。由于TEM仅切除瘤灶而未对周围淋巴结,尤其是肠系膜淋巴结进行清扫,故而CRT-TEM组可能较TME组存在更高的淋巴结复发率,这亟待2-5年后研究者提供长期疗效数据才能进一步评估。
4.2.5观察等待践行器官保留
对于直肠癌患者而言,虽然TME带来显著获益,但术后往往引起肠道、泌尿、性功能的障碍及生活质量的下降。因此对于进展期直肠癌,当前研究重点在于TNT后根据肿瘤缓解情况选择WW或TEM,能否使部分患者实现器官保留,而且对患者的预后无显著影响。OPRA研究作为第一个以器官功能保全为目标的TNT研究,与传统CRT模式的历史数据比较,不同TNT模式均能显著提高器官保留率(CRT模式20%,INCT模式43%,CNCT模式59%)[16]。而在TAUTEM研究中,CRT-TEM组虽达到82.7%(67/81)的器官保留率,但其中只有1位患者放弃手术而直接采用WW。对TAUTEM研究局切后的病理结果分析发现:CRT后,44.3%的患者达到了pCR,对于这部分患者,CRT后能否放弃局部切除而采用巩固化疗,最后行WW以实现器官保留将是另一个值得探讨的话题。
简评
参考文献:
[1] Serra-Aracil X, Pericay C, Badia-Closa J, Golda T, Biondo S, Hernandez P, Tarragona E, Borda-Arrizabalaga N, Reina A, Delgado S, Vallribera F, Caro A, Gallego-Plazas J, Pascual M, Alvarez-Laso C, Labajo H G, Mora-Lopez L. Short-term outcomes of chemoradiotherapy and local excision vs total mesorectal excision in T2-T3ab,N0,M0 rectal cancer. A multicentre randomised, controlled, phase III trial (the TAUTEM study) [J]. Ann Oncol, 2022.
[2] Mellgren A, Sirivongs P, Rothenberger D A, Madoff R D, Garcia-Aguilar J. Is local excision adequate therapy for early rectal cancer? [J]. Dis Colon Rectum, 43(8): 1064-1071; discussion 1071-1064, 2000.
[3] van Gijn W, Marijnen C A, Nagtegaal I D, Kranenbarg E M, Putter H, Wiggers T, Rutten H J, Pahlman L, Glimelius B, van de Velde C J, Dutch Colorectal Cancer G. Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer: 12-year follow-up of the multicentre, randomised controlled TME trial [J]. Lancet Oncol, 12(6): 575-582, 2011.
[4] Fokas E, Liersch T, Fietkau R, Hohenberger W, Beissbarth T, Hess C, Becker H, Ghadimi M, Mrak K, Merkel S, Raab H R, Sauer R, Wittekind C, Rodel C. Tumor regression grading after preoperative chemoradiotherapy for locally advanced rectal carcinoma revisited: updated results of the CAO/ARO/AIO-94 trial [J]. J Clin Oncol, 32(15): 1554-1562, 2014.
[5] van der Pas M H, Haglind E, Cuesta M A, Furst A, Lacy A M, Hop W C, Bonjer H J, Group C O c L o O R I S. Laparoscopic versus open surgery for rectal cancer (COLOR II): short-term outcomes of a randomised, phase 3 trial [J]. Lancet Oncol, 14(3): 210-218, 2013.
[6] Emmertsen K J, Laurberg S. Low anterior resection syndrome score: development and validation of a symptom-based scoring system for bowel dysfunction after low anterior resection for rectal cancer [J]. Ann Surg, 255(5): 922-928, 2012.
[7] Serra-Aracil X, Mora-Lopez L, Alcantara-Moral M, Caro-Tarrago A, Gomez-Diaz C J, Navarro-Soto S. Transanal endoscopic surgery in rectal cancer [J]. World J Gastroenterol, 20(33): 11538-11545, 2014.
[8] Serra-Aracil X, Labro-Ciurans M, Rebasa P, Mora-Lopez L, Pallisera-Lloveras A, Serra-Pla S, Gracia-Roman R, Navarro-Soto S. Morbidity after transanal endoscopic microsurgery: risk factors for postoperative complications and the design of a 1-day surgery program [J]. Surg Endosc, 33(5): 1508-1517, 2019.
[9] Sauer R, Becker H, Hohenberger W, Rodel C, Wittekind C, Fietkau R, Martus P, Tschmelitsch J, Hager E, Hess C F, Karstens J H, Liersch T, Schmidberger H, Raab R, German Rectal Cancer Study G. Preoperative versus postoperative chemoradiotherapy for rectal cancer [J]. N Engl J Med, 351(17): 1731-1740, 2004.
[10] Maas M, Nelemans P J, Valentini V, Das P, Rodel C, Kuo L J, Calvo F A, Garcia-Aguilar J, Glynne-Jones R, Haustermans K, Mohiuddin M, Pucciarelli S, Small W, Jr., Suarez J, Theodoropoulos G, Biondo S, Beets-Tan R G, Beets G L. Long-term outcome in patients with a pathological complete response after chemoradiation for rectal cancer: a pooled analysis of individual patient data [J]. Lancet Oncol, 11(9): 835-844, 2010.
[11] Hallam S, Messenger D E, Thomas M G. A Systematic Review of Local Excision After Neoadjuvant Therapy for Rectal Cancer: Are ypT0 Tumors the Limit? [J]. Dis Colon Rectum, 59(10): 984-997, 2016.
[12] Garcia-Aguilar J, Renfro L A, Chow O S, Shi Q, Carrero X W, Lynn P B, Thomas C R, Jr., Chan E, Cataldo P A, Marcet J E, Medich D S, Johnson C S, Oommen S C, Wolff B G, Pigazzi A, McNevin S M, Pons R K, Bleday R. Organ preservation for clinical T2N0 distal rectal cancer using neoadjuvant chemoradiotherapy and local excision (ACOSOG Z6041): results of an open-label, single-arm, multi-institutional, phase 2 trial [J]. Lancet Oncol, 16(15): 1537-1546, 2015.
[13] Abdelsattar Z M, Wong S L, Birkmeyer N J, Cleary R K, Times M L, Figg R E, Peters N, Krell R W, Campbell D A, Jr., Russell M M, Hendren S. Multi-institutional assessment of sphincter preservation for rectal cancer [J]. Ann Surg Oncol, 21(13): 4075-4080, 2014.
[14] Fokas E, Allgauer M, Polat B, Klautke G, Grabenbauer G G, Fietkau R, Kuhnt T, Staib L, Brunner T, Grosu A L, Schmiegel W, Jacobasch L, Weitz J, Folprecht G, Schlenska-Lange A, Flentje M, Germer C T, Grutzmann R, Schwarzbach M, Paolucci V, Bechstein W O, Friede T, Ghadimi M, Hofheinz R D, Rodel C, German Rectal Cancer Study G. Randomized Phase II Trial of Chemoradiotherapy Plus Induction or Consolidation Chemotherapy as Total Neoadjuvant Therapy for Locally Advanced Rectal Cancer: CAO/ARO/AIO-12 [J]. J Clin Oncol, 37(34): 3212-3222, 2019.
[15] Zhu J, Liu A, Sun X, Liu L, Zhu Y, Zhang T, Jia J, Tan S, Wu J, Wang X, Zhou J, Yang J, Zhang C, Zhang H, Zhao Y, Cai G, Zhang W, Xia F, Wan J, Zhang H, Shen L, Cai S, Zhang Z. Multicenter, Randomized, Phase III Trial of Neoadjuvant Chemoradiation With Capecitabine and Irinotecan Guided by UGT1A1 Status in Patients With Locally Advanced Rectal Cancer [J]. J Clin Oncol, 38(36): 4231-4239, 2020.
[16] Garcia-Aguilar J, Patil S, Gollub M J, Kim J K, Yuval J B, Thompson H M, Verheij F S, Omer D M, Lee M, Dunne R F, Marcet J, Cataldo P, Polite B, Herzig D O, Liska D, Oommen S, Friel C M, Ternent C, Coveler A L, Hunt S, Gregory A, Varma M G, Bello B L, Carmichael J C, Krauss J, Gleisner A, Paty P B, Weiser M R, Nash G M, Pappou E, Guillem J G, Temple L, Wei I H, Widmar M, Lin S, Segal N H, Cercek A, Yaeger R, Smith J J, Goodman K A, Wu A J, Saltz L B. Organ Preservation in Patients With Rectal Adenocarcinoma Treated With Total Neoadjuvant Therapy [J]. J Clin Oncol, 40(23): 2546-2556, 2022.
作者简介
临床解读
陈倩萍
统计解读
谢丽
通信作者
朱骥














 苏公网安备 32059002004080号
苏公网安备 32059002004080号


