作者
王谨1,2,3 莫淼1,4 季永领1,2,3
单位
1, CSCO专家委员会Keynote工作组
2, 浙江省肿瘤医院 浙江 杭州 310022;
3, 中国科学院基础医学与肿瘤研究所 浙江 杭州 310022;
4,复旦大学附属肿瘤医院肿瘤预防部,复旦大学上海医学院肿瘤学系 上海 200433
*通信作者
季永领,主任医师;浙江省肿瘤医院胸部肿瘤放疗科,浙江省杭州市拱墅区半山东路1号(310022);Email: jiyl@zjcc.org.cn
KEYNOTE-799近期更新了2年生存结果。这是一个由10个国家52个研究中心参与的非随机双队列II期研究。其主要研究终点为客观缓解率(ORR)和超过3级肺炎的发生率,次要终点为总生存期(OS),无进展生存(PFS)和安全性。研究共纳入216例不可手术的局部晚期非小细胞肺癌(NSCLC)患者,其中112例患者进入A队列(鳞癌和非鳞癌NSCLC),104例患者进入B队列(非鳞癌NSCLC)(2022ASCO更新时变为102例)。两组在给予帕博利珠单抗+化疗诱导治疗1个周期后,行帕博利珠单抗联合同步放化疗,接着行帕博利珠单抗巩固治疗。结果显示,A队列ORR为71.4%,疾病控制率(DCR)达到88.4%。B队列ORR为75.5%,DCR达到93.1%,A队列中位PFS为 30.6 个月,2年PFS率55.3%;B队列中位PFS未达到,2年PFS率为60.6%(图1)。2个队列的中位OS和缓解持续时间(DoR)都未达到。KEYNOTE-799进行了免疫联合同步放化疗的尝试,有望使更多不可切除的局部晚期NSCLC患者接受免疫治疗。
关键词
帕博利珠单抗、同期放化疗、局部晚期非小细胞肺癌、客观缓解率,肺炎
The Summary of KEYNOTE-799 Study :Pembrolizumab Plus Concurrent Chemoradiation Therapy in Patients With Unresectable, Locally Advanced, Stage III Non-Small Cell Lung Cancer
Jin Wang1,2,3; Miao Mo1,4; Yongling Ji 1,2,3
1, The CSCO Statistical Expert Committee Keynote Group; 2, The Cancer Hospital of the University of Chinese Academy of Sciences (Zhejiang Cancer Hospital), Hangzhou, Zhejiang 310022; 3, Institute of Basic Medicine and Cancer (IBMC), Chinese Academy of Sciences, Hangzhou, Zhejiang 310022; 4,Department of Cancer Prevention, Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China
Abstract: The results of KEYNOTE-799 was recently updated. The study investigated pembrolizumab plus concurrent chemoradiation therapy in patients with unresectable stage III Non-Small Cell Lung Cancer(NSCLC). KEYNOTE-799 enrolled a significantly larger cohort with 216 patients. The primary endpoint was the objective response rate (ORR) and the incidence of grade ≥3 pneumonitis. Cohort A with 112 patients (squamous and non-squamous histology) received carboplatin AUC 6 plus paclitaxel 200 mg/m2 and pembrolizumab 200 mg, followed by radiotherapy concurrently with carboplatin AUC 2 plus paclitaxel 45 mg/m2, and pembrolizumab 200 mg . Cohort B with 102 patients (nonsquamous) received 3 cycles of cisplatin 75 mg/m2, pemetrexed 500 mg/m2, and pembrolizumab 200 mg Q3W, and radiotherapy started at the second cycle. All patients received 14 additional cycles of pembrolizumab 200 mg Q3W. ORR was 71.4% (62.1%–79.6%) in cohort A and 75.5% in cohort B. Median duration of response (DoR) and OS were not reached(NR) in both cohorts; median PFS was 30.6 months in cohort A, and NR in cohort B. A total of 16 (7.4%) patients with grade ≥III pneumonitis and 5 (2.3%) patients with pneumonitis-related death were reported. The result of KEYNOTE 799 might imply the advent of trimodal therapy by introducing pembrolizumab to CCRT in unresectable, locally advanced, stage III NSCLC.
Keyword: pembrolizumab, locally advanced stage III NSCLC, concurrent chemoradiation therapy, objective response rate, adverse events
本期分享的是2021年发表在JAMA Oncol上的帕博利珠单抗联合同步放化疗治疗不可切除的III期非小细胞肺癌(NSCLC)的疗效和安全性-KEYNOTE-799研究[1], 包含最初发表的数据以及2021、2022年ASCO会议更新[2, 3]这是一项多中心、非对照前瞻性研究,患者来自美国、澳大利亚等10个国家。
KEYNOTE-799研究是不可手术局部晚期NSCLC继PACIFIC研究后又一次大胆的探索,有望带来新的治疗思路,同时也提出了不少问题。本文将从研究背景、研究设计、研究结果和研究结论这四个方面对该研究进行解读。
1
研究背景与目的
不可手术的Ⅲa期-Ⅲc期NSCLC大约占初诊肺癌患者的25%-30%。过去,同期放化疗(CCRT)一直都是局部晚期NSCLC的标准治疗,但5年生存率徘徊在16%至32%之间。PACIFIC研究首次证实同步放化疗后续贯度伐利尤单抗免疫巩固可显著改善不可切除III期NSCLC患者的生存,5年生存率达到42.9%,成为新的标准治疗[4]。
但是,接受CCRT的不可切除的III期NSCLC患者中,约22%-30%的患者因多种原因不能接受巩固免疫治疗,如放化疗期间肿瘤进展 (PD)、或出现难以耐受的毒性,例如肺炎、骨髓抑制等,一部分患者甚至无法完成CCRT[1]。出现上述状况的患者不能按“PACIFIC模式(CCRT+度伐利尤单抗巩固免疫治疗)”进行治疗,预后往往很差。
如何在PACIFIC模式的基础上,改善不可手术的局部晚期NSCLC患者生存?能否扩大获益患者群体的比例?能否进一步延长治疗获益者的缓解时间?有研究表明放化疗同期帕博利珠免疫治疗可进一步提高肺癌患者的ORR率,从而有望进提高免疫巩固治疗获益患者的比例[5]。在KEYNOTE-799研究之前,他们进行了I期临床研究,发现帕博利珠单抗联合同步放化疗治疗不可切除的III期NSCLC毒性可耐受,疗效可期待[6]。在此基础上,他们设计了这项II期、非随机、国际多中心研究,旨在评估帕博利珠单抗联合同步放化疗治疗不可切除的III期NSCLC的疗效和安全性,其结果有望为不可手术的局部晚期NSCLC治疗提供新思路。
2
研究方案
这是一项多中心、非随机、开放的II期研究,在10个国家(美国、澳大利亚、法国、德国、韩国、新西兰、波兰、俄罗斯、西班牙和英国)的52中心进行。入组年龄要求18岁及以上;先前未经治疗、不能切除、病理或影像证实的IIIA、IIIB或IIIC期NSCLC(按UICC第8版)[7];有可测量的肿瘤病灶(RECIST 1.1);PS为0或1;第一秒用力呼气量(FEV1)大于正常预测值的50%,一氧化碳肺弥散量大于正常预测值的40%;能提供细胞学或组织学标本;经PET/CT、CT、MRI等检查均未发现远处转移。排除标准如下:先前接受过胸部放疗(包括食管癌、乳腺癌的放疗);放疗计划中全肺V20超过31%;先前进行过抗PD-(L)1抗体治疗;诊断为免疫缺陷或正在接受激素治疗,如需要治疗的活动性自身免疫性疾病、需要使用类固醇的非传染性;有肺炎间质性肺疾病的病史;或需要治疗的活动性感染的病史。
这是一个双队列研究,非鳞NSCLC可能接受任何一种联合治疗,由研究人员的决定治疗;鳞癌患者仅能进入A队列。A队列第1天接受1个周期的卡铂(AUC为6)、紫杉醇(200mg/m2)和帕博利珠单抗(20mg)静脉给药。3周后给予胸部放疗,每周同期卡铂(AUC为2)和紫杉醇(45mg/m2)化疗,每3周给予帕博利珠单抗(200mg),共2个周期。B队列均为非鳞NSCLC患者,接受1个周期的顺铂(75mg/m2)和培美曲塞(500mg/m2)联合帕博利珠单抗(200mg)诱导化疗后,开始胸部放疗,放疗同期接受2个周期的顺铂(75mg/m2)和培美曲塞(500mg/m2)化疗及帕博利珠单抗(200mg)免疫治疗。放疗采用6MV直线加速器,剂量60Gy/30Fx,每周5天,每日1次。
在CCRT结束后,所有患者需接受共14个周期帕博利珠单抗(200mg)巩固免疫治疗(约1年),或直到PD、不可接受的不良事件(AES)、并发症,或研究者决定停药或患者要求退出。
主要终点为设盲的独立评审委员会(BIRC)根据RECIST 1.1 所判定的客观反应率(ORR)和超过3级肺炎(CTCAE 4.0)患者的比例。次要终点包括总生存率(OS)、独立评审委员会评估的无进展生存率(PFS)和安全性。
该研究旨在探索在铂类两药联合化疗和标准胸部放疗基础上再联合帕博利珠单抗免疫治疗对于不可切除的III期NSCLC患者的疗效和安全性,故以二者作为共同的主要研究终点,由于探索的研究性质,α设定为单侧0.05。基于化疗方案的不同设置2个队列,每个队列单独计算样本量,可单独分析;如果两个队列的肺炎发生率相似,后续可以进行合并分析。针对某一队列,根据序贯监测程序,基于单侧0.05检验水准、真实的3级以上肺炎发生率约3%等条件,样本量设置为最大值108时研究可提供83%的把握度来证明3级以上肺炎发生率小于10%,因此研究总样本量为216例。统计分析数据集纳入实际接受至少1个疗程规定治疗的患者(入组216例,实际治疗214例)。疗效终点ORR以点估计结合90%可信区间(CI)来展示,并将80%和95% CI作为补充结果;安全性终点3级及以上肺炎发生率同样以点估计结合90% CI来展示,并将80%和95% CI作为补充结果。
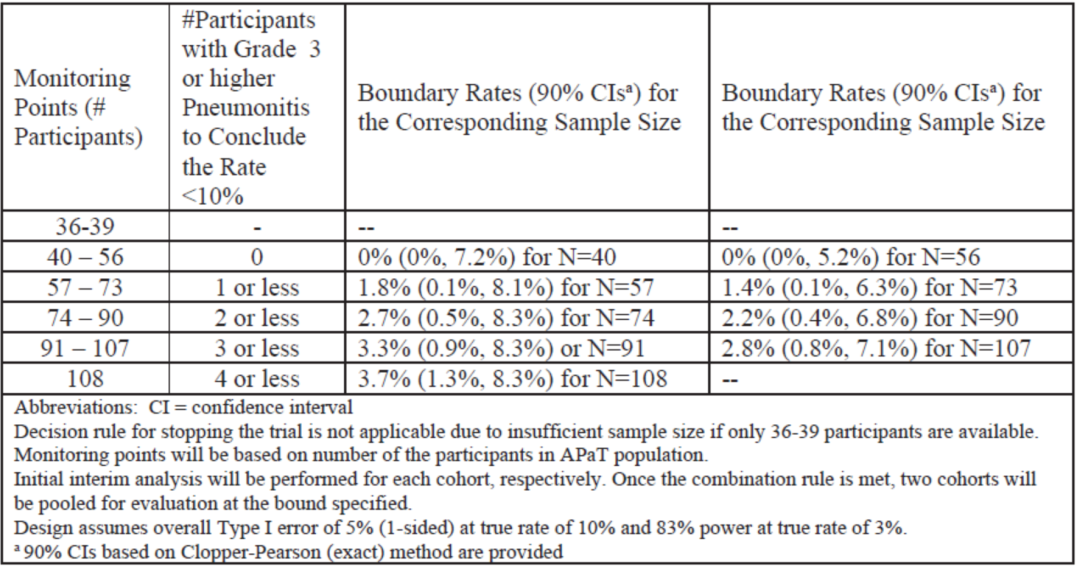
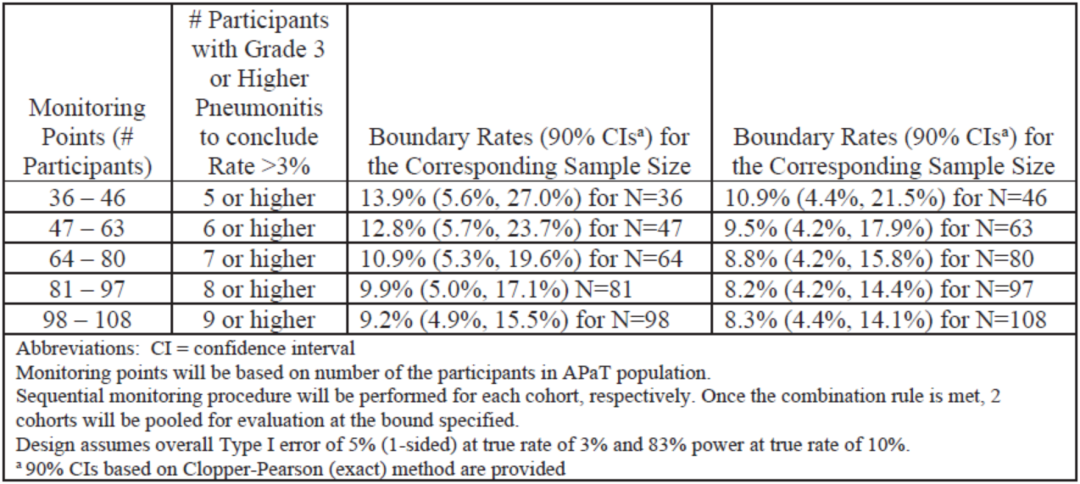
该研究基于序贯监测程序预设了多个期中分析的计划,以便在发生以下情形时都能够提前终止研究:①3级及以上肺炎发生率不可接受的高;②ORR过低预期无效;或③ 3级及以上肺炎发生率非常低且ORR较高可以快速进入III期研究。首次期中分析计划在某一队列入组至少36例患者且随访大于15周后,如果两个队列入组进度不同,则先达到分析条件的可先行分析。序贯监测程序采用二项式序贯检测法[8],详见附表1-4。所有结果均由外部的数据监查委员会(DMC)复核。
研究预设疗效分析将针对以下亚组进行探索:年龄组(<65 vs. ≥65)、性别(男性、女性)、分期(IIIA vs. IIIB vs. IIIC)、ECOG评分(0 vs.1)、主要的病理类型(鳞癌 vs. 非鳞癌)、吸烟状态(从不/当前吸烟)、PD-L1状态(TPS<1% vs. ≥1%)以及非鳞癌患者中医生选择的化疗方案。
3
研究结果
KEYNOTE799研究结论第一次见刊是在2021年的JAMA Onocl上,彼时数据分析截至2020年10月28日,入组业已完成,共入组216名患者。其中A组入组112例,B组入组104例。
A组ORR为71.4%,疾病控制率(DCR)达到88.4%。B组ORR为75.5%,DCR达到93.1%(表2)。在A组亚组分析中PD-L1 TPS<1%的ORR为66.7% ,而PD-L1 TPS>=1%者 ORR为77.3%;鳞癌患者中 ORR为72%,非鳞癌患者ORR为70.3%。而在B组中,PD-L1 TPS<1% ORR为78.6%,PD-L1 TPS>=1%者ORR为72.5%。
Table 1 Objective Response Rate*
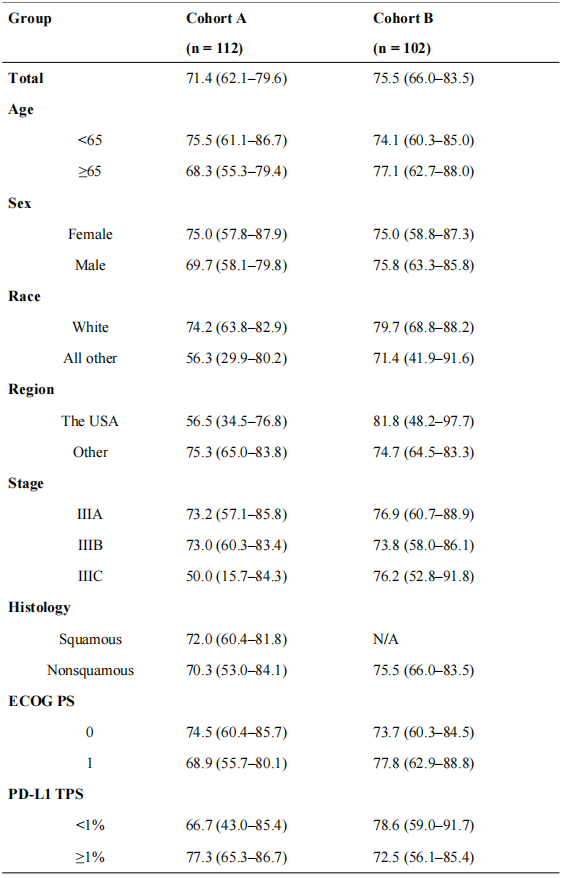
Data in the table summarize ORR % (95% CI).
在2022ASCO和ASTRO上,KEYNOTE799发布了最新的生存数据。数据分析的截止时间是2021年10月18日,A组中位随访时间为30.2月(25.3–35.5)B组中位随访时间为25.4月(14.5–35.2)。A组中位PFS为 30.6 个月,2年PFS率55.3%;B组中位PFS未达到,2年PFS率为60.6%(图1)。2组的中位OS都未达到,其中A组2年OS率为64.3%,B组2年OS率为68.7%。2组的中位DoR也均未达到,A组2年DoR率为64.0%,B组2年DoR率为68.7%(图2)。
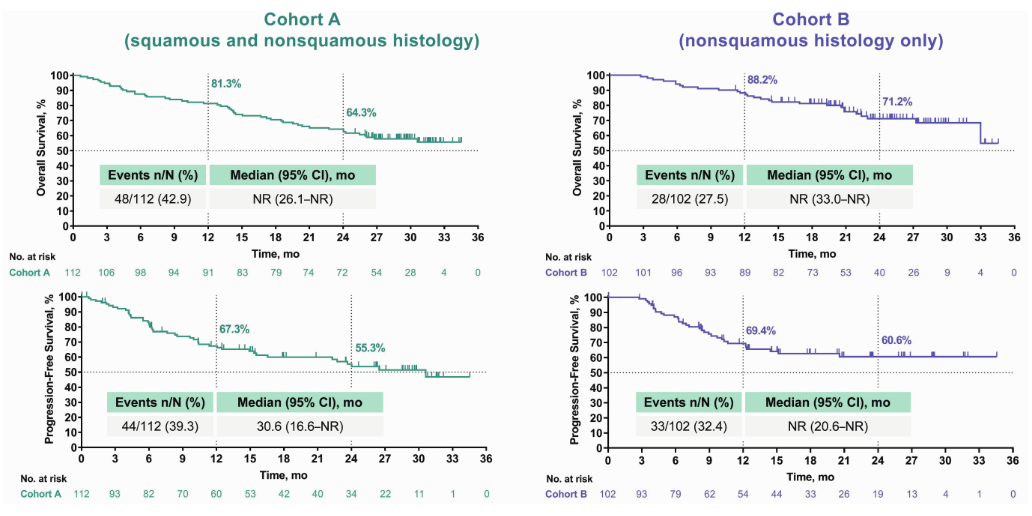
Figure 1 Progression-Free Survival and Overall Survival
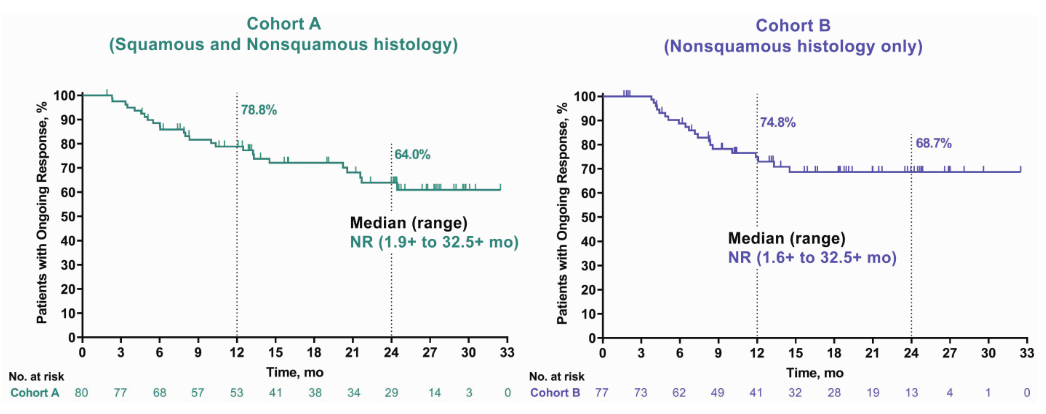
Figure 2 Duration of Response
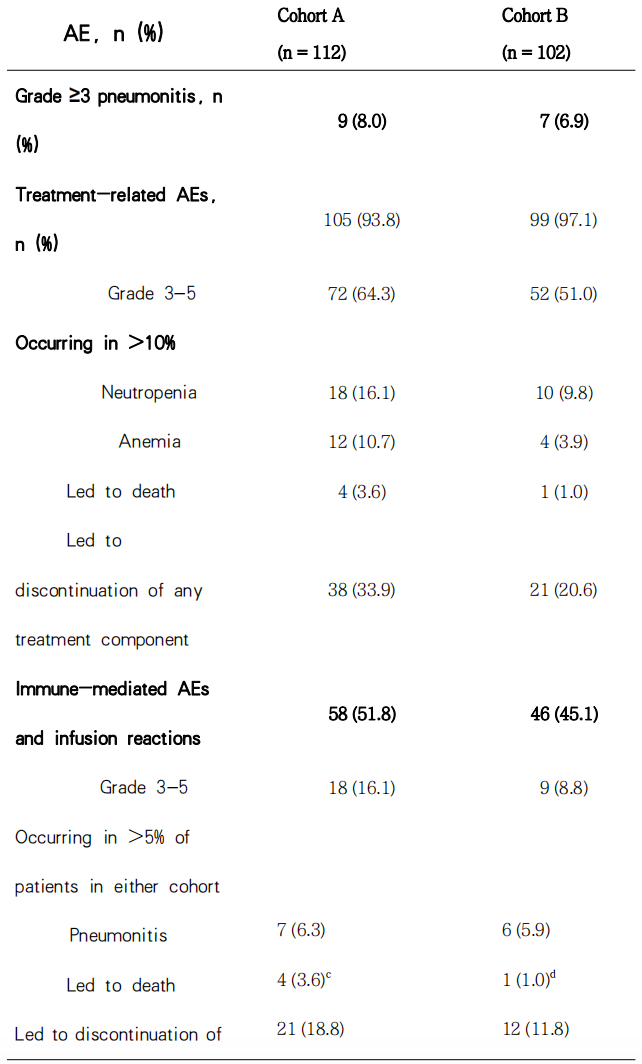
最新的数据表明A组超过3级毒性反应为64.3%,B组为51.0%。最常见的与治疗相关的超过3级毒性反应是粒细胞减少,其中A组发生率为16.1%,B组发生率为9.8%。
肺炎是导致治疗中止的最常见的毒性反应。A组112例患者中9例(8.0%;95%CI,3.7%-14.7%)发生超过3级的肺炎(包括放射性肺炎),B组102例患者中7例发生3级以上的肺炎(6.9%;95%CI;2.8%-13.6%)。在A组中,有4例(3.6%)患者死于肺炎,而B组有1例死于间质性肺炎。本研究中所有的致死性肺炎都有可能与帕博利珠单抗相关,1例还有可能与放疗相关。A组和B组肺炎发生的中位时间分别为4.3(1.4-10.4)个月和4.4(0.1-12.3)个月,中位发作持续时间分别为4.4个月和4.0个月。
Table 2. Adverse Event Summary

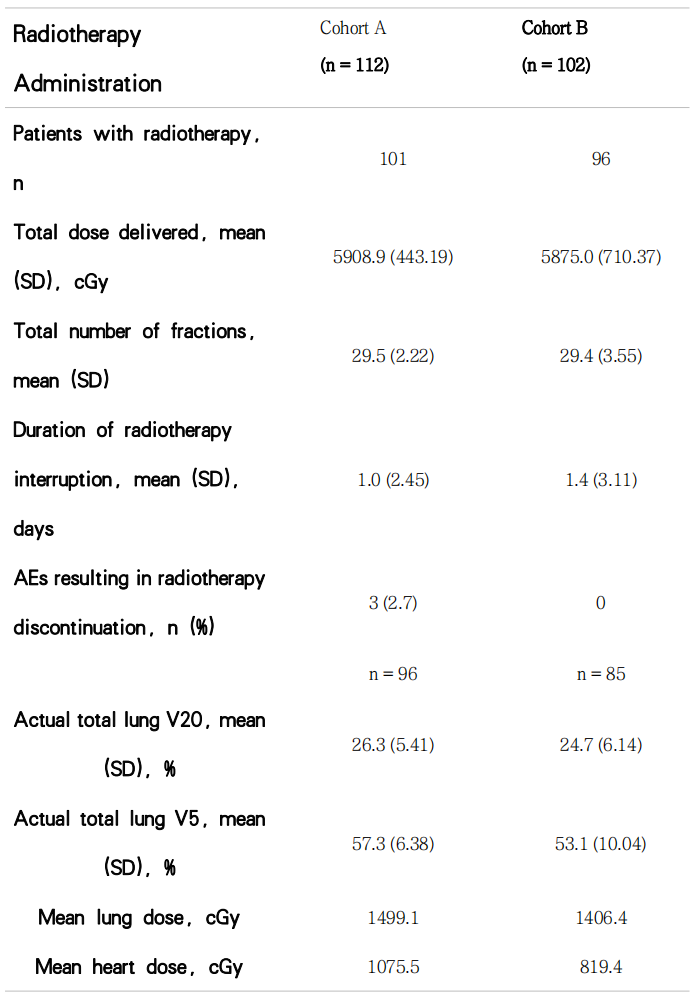
A组112例患者中,共101接受了放疗,平均总剂量5908.9±443.19cGy,分29.5±2.22次完成。平均放疗中断时间为1.0±2.45天。A组患者全肺V20平均数为26.3%,V5为57.3%。全组患者平均肺剂量的均值为1499.1cGy,平均心脏剂量的均值为1075.5cGy。B组共96人接受放疗,平均总剂量5875.0±710.37cGy,分29.4±3.55次完成。平均放疗中断时间为1.4±3.11天。B组患者全肺V20平均数为24.7%,V5平均数为53.1%,全组患者平均肺剂量的均值为1406.4cGy,平均心脏剂量的均值为819.4cGy(表3)。
Table 3 Radiotherapy Administration
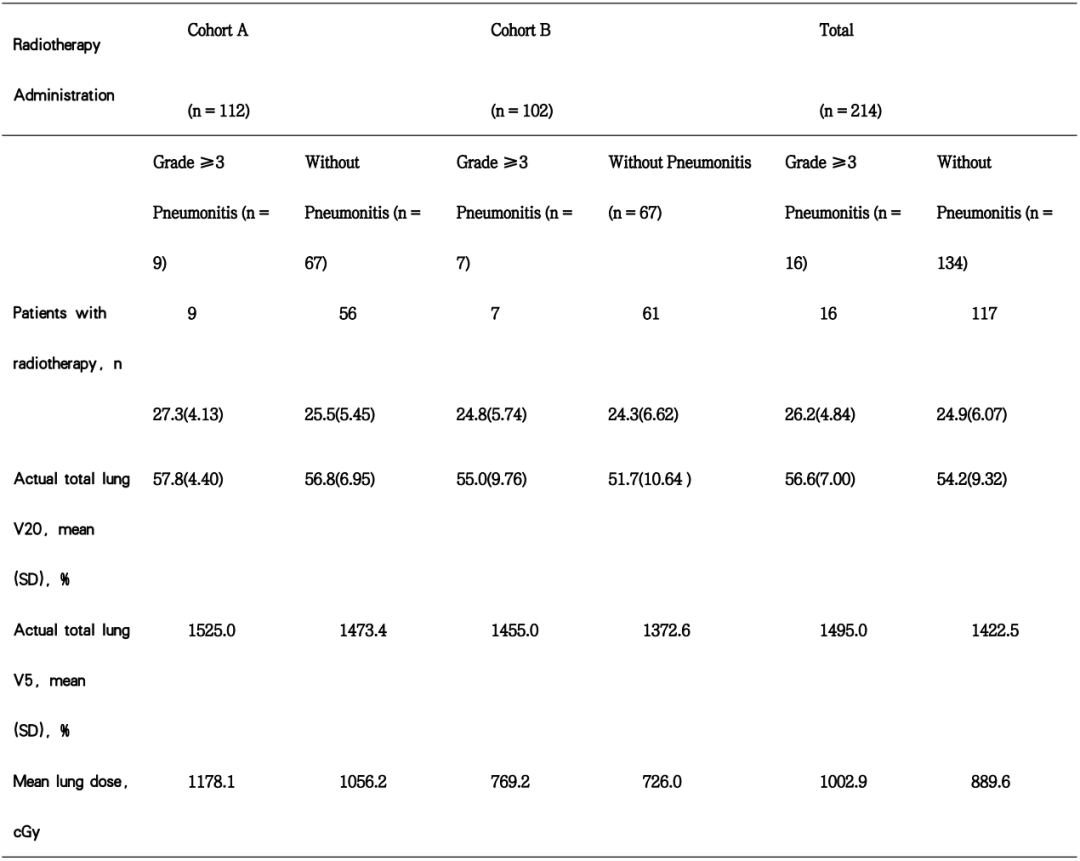
我们试图从放疗的细节方面去探寻导致肺炎发生的因素,因而比较了超过3级肺炎患者和全程未出现肺炎患者的心肺受量。初步的分析发现,无论A组或B组,出现超过3级肺炎的患者似乎有更高的肺受量(包括V20,V5,MLD)和心脏受量(MHD)(表4)。其他信息有待进一步披露。
Table 4 Radiotherapy Administration by Pneumonitis
4
讨论与思考
这是一项多中心、开放标签、非随机、非对照的双队列II期研究,充分体现了II期研究设计的灵活多样性。设置两个队列的好处是在同一研究中同时开展针对两种不同基础化疗方案的研究探索,既涵盖了临床常用的化疗方案,又保证了两个队列的独立性,且研究方案审查流程只有一次,大大提高了总体的研究效率。由于研究仅有一个检验假设,故在两个主要终点之间无需进行α分配。两个队列分别独立计算样本量,也不涉及α的分配。值得注意的是,本研究设定α为单侧0.05,相当于双侧0.1,因此主要结果的表达采用90% CI而不是常见的95% CI,这里是存在对应关系的。
本研究的期中分析计划非常复杂,涉及四种、三类情形的提前终止条件,既考虑了因安全性不够(3级及以上肺炎发生率过高)或疗效不足(ORR过低)而提前终止研究的可能性,也考虑了如果疗效非常好并且安全性也很好的情况下,提前结束II期探索,加速进入III期试验的可能性。可喜的是,在2020年ASCO大会上,KEYNOTE-799研究结果公布显示出了令人鼓舞的ORR结果:经过至少15周的随访,帕博利珠单抗联合CCRT治疗在队列A(112例)和队列B(53例)的ORR分别为67.0%(75例)和56.6%(30例)。基于如此优秀的ORR结果以及毒性并未超出预期,后续III期研究KEYLYNK-012(NCT04380636)于2020年5月开始启动,用于评估不可切除的III期NSCLC患者在经过帕博利珠单抗联合CCRT治疗后,以帕博利珠单抗(治疗组A)或帕博利珠单抗联合PARP抑制剂奥拉帕利(治疗组B)作为维持治疗的疗效和安全性,并对比同步放化疗后以度伐利尤单抗作为巩固治疗(对照组C)的疗效和安全性。研究假设治疗组A和B的OS和PFS要显著优于对照组C,即免疫联合放化疗并以免疫或免疫联合PARP抑制剂为巩固治疗的模式要优于PACIFIC研究建立的不可切除III期NSCLC的标准治疗模式。
(1)PD(L)1免疫检查点抑制剂关口前移能否进一步改进疗效?
研究结果证实了帕博利珠单抗联合同步放化疗治疗不可切除的III期NSCLC的疗效。据我们所知,KEYNOTE-799是迄今为止最大的抗-PD-(L)1联合CCRT治疗初治局部晚期III期NSCLC患者的试验。在这项研究中,博利珠单抗联合CCRT显示了强大的抗肿瘤活性,两组的ORR率分别是71.4%和75.5%。
因为化疗方案、放疗技术的不同,不同时期的数据无法拿来直接比较,但是我们依旧能看到不小的进步。过去,在接受CCRT(75%的患者使用铂类)的IIIa/IIIb期NSCLC患者中(后继可能还有巩固化疗),ORR大约在35.9%至54%之间[9, 10]。
另外两项类似研究也证实了这一点。NICOLAS研究也是一个多中心前瞻性研究。该研究的治疗模式为:CCRT同期纳武利尤单抗免疫治疗,续贯纳武利尤单抗巩固治疗12个月 (4)。 一共纳入79 例IIIA/B NSCLC(UICC第7版)。主要研究终点是6个月内超过3级肺炎的比例,同时预设1年PFS率从45%提高到60%。经中位21个月的随访,中位PFS率为12.7个月,1年PFS率为53.7%。很遗憾没有达到预设终点。2年OS率分别为81% 和 56%, 与PACIFIC对照组相似 (55.6%)。共9例患者 (11.7%) 出现了3级以上的肺炎,其中1例为致死性肺炎。 所有超过3级的肺炎都可能与药物相关,其中4例还有可能与放疗相关。1例患者死于食管溃疡出血,可能与放疗联合免疫治疗有关[11]。
另外一个研究是DETERRED 研究。该研究的第一阶段采用CCRT续贯阿替利珠单抗巩固治疗。研究的第二阶段,纳入了30例CCRT同期阿替利珠单抗,之后阿替利珠单抗巩固免疫治疗。第一阶段接受CCRT续贯免疫治疗的患者中位随访时间是22.5个月,中位PFS18.6个月;第二阶段接受同期CCRT联合免疫+巩固免疫治疗的患者中位随访时间15.1个月,中位PFS是13.2个月。 在第2阶段的研究中, 24 个患者(80%)出现超过3级的毒性,6例患者(20%) 出现3级以上治疗相关性毒性,仅有1例 (3%) 出现3级肺炎[5]。
在同类研究中,拥有最多中心参与、最多病例的KEYNOTE799研究无疑最为耀眼。从较高的ORR率可推断,同期放化疗及免疫治疗可能提高免疫治疗获益群体的比例;本研究的中位DoR还未达到,预示着获益者可能会拥有较长的持续缓解时间[12]。
(2)CCRT同期PD(L)1免疫检查点抑制剂会增加严重肺炎的发生概率吗?
肺炎和放射性肺炎是与抗PD-(L)1和CCRT联合治疗最为重要的毒性反应。两者同时进行产生的肺毒性大于单用CCTT和免疫治疗之和。拉长放疗与免疫治疗的间隔时间有可能降低肺炎的发生率[13]。KEYNOTE799各组3级以上肺炎发生率均小于10%,其中A组有4例、B组有1例死于肺炎。这个结果其实与CCRT联合抗PD-(L)1药物治疗的其他几个研究相似,包括帕博利珠单抗联合CCRT(超过3级以上:10%)、CCRT后巩固帕博利珠单抗(6%)、纳武利尤单与CCRT联合(12%)、CCRT联合阿替利珠单抗(3%)。
在PACIFIC研究中,475例患者仅20例(4%)出现超过3级肺炎。但是,该研究排除了同期放化疗期间出现2级以上肺炎的患者;而这类患者,恰恰更容易在后继的免疫巩固治疗期间出现肺炎。这也是需要考虑的。因而要在后续研究中继续探索同期放化疗联合免疫治疗的肺毒性。
(3)能否用生物标记物来筛选获益患者?
在KEYNOTE-799研究中,治疗反应与疾病分期、肿瘤组织学类型和PD-L1 表达等因素无关。这与I期临床研究的结论基本一致。在PACIFIC研究中, 对PD-L1<1%的患者,CCRT后巩固免疫治疗不能改善OS。这个问题迄今没有定论,如欧洲药品管理局批准了度伐利尤单抗用于PDL1表达≥1%的局部晚期NSCLC患者放化疗后的巩固治疗;而FDA则批准用于任何PDL1表达的不可手术的局部晚期NSCLC患者。
然而,因为联合治疗的安全性、经济因素等多方面原因,早期筛选获益患者显得格外重要。遗憾的是,现有的生物标志物,如外周和肿瘤浸润淋巴细胞亚群、循环细胞因子和ctDNA等都在研究中,而该研究也未动态的收集或分析此类标志物对疗效及毒性的影响。
(4)本研究还有哪些问题没有解决?
作为一个II期临床研究,KEYNOTE799研究没有设置对照组,使得生存和毒性数据不能与现有的标准治疗(CCRT续贯免疫巩固)作对比。另外,随访时间也不够长,B组中位PFS,全组中位OS和DoR等还未达到。其三,没有动态的收集和分析生物免疫标记物对预后及毒性的影响。因此,迫切的期待本研究结果进一步的发布及后继生物免疫标记物引导下的精准联合治疗的研究。
(5)下一个阶段的研究会是怎样的?
目前正在进行的3期KEYLYNK-012研究(NCT04380636),对不可切除的III期NSCLC,经帕博利珠单抗联合同步放化疗后,续贯帕博利珠,加或不加PARP抑制剂奥拉帕尼,结果与CCRT续贯度伐利尤单抗进行比较。
此外,还有针对PD-L1 TPS≥50%的局部晚期NSCIC设计的“去化疗研究”——SPRINT研究(风险适应性放疗后序贯帕博利珠单抗治疗III 期NSCLC或不可手术的II期NSCLC的疗效及安全性研究)也在进行中。该研究采用“基于PET/CT风险适应性剂量雕刻放疗”,即对肿瘤体积<20cc采用48Gy/20F的剂量分割方案,对肿瘤容积>20cc的,采用55Gy/20F的剂量分割。主要的终点包括1年PFS率(预设提高至65%),次要终点:安全性,同时用CT(RECIST)和PET(PERCIST)评估治疗反应,以及OS。这些研究将回答免疫治疗时代如何优化局部晚期NSCLC的综合治疗策略,以及如何对放疗技术做调整以最大限度的增效、减毒。
简评
参考文献
1. Jabbour SK, Lee KH, Frost N, et al. Pembrolizumab Plus Concurrent Chemoradiation Therapy in Patients With Unresectable, Locally Advanced, Stage III Non-Small Cell Lung Cancer: The Phase 2 KEYNOTE-799 Nonrandomized Trial[J]. JAMA Oncol, 2021;7:1351–9.
2. Reck M, Lee KH, Frost N, et al. Two-year update from KEYNOTE-799: Pembrolizumab plus concurrent chemoradiation therapy (cCRT) for unresectable, locally advanced, stage III NSCLC. Journal of Clinical Oncology[J]. J Clin Oncol, 2022;40 16_suppl:8508–8508.
3. Jabbour SK, Lee KH, Frost N, et al. KEYNOTE-799: Phase 2 trial of pembrolizumab plus platinum chemotherapy and radiotherapy for unresectable, locally advanced, stage 3 NSCLC[J]. J Clin Oncol, 2021;39 15_suppl:8512–8512.
4. Spigel DR, Faivre-Finn C, Gray JE, et al. Five-Year Survival Outcomes From the PACIFIC Trial: Durvalumab After Chemoradiotherapy in Stage III Non-Small-Cell Lung Cancer[J]. J Clin Oncol,2022;40:1301–11.
5. Lin SH, Lin Y, Yao L, et al. Phase II Trial of Concurrent Atezolizumab With Chemoradiation for Unresectable NSCLC[J]. J Thorac Oncol, 2020;15(2):248-257.
6. Jabbour SK, Berman AT, Decker RH, et al. Phase 1 Trial of Pembrolizumab Administered Concurrently with Chemoradiotherapy for Locally Advanced Non-Small Cell Lung Cancer: A Nonrandomized Controlled Trial[J]. JAMA Oncol, 2020,6:848–55.
7. Chansky K, Detterbeck FC, Nicholson AG, et al. The IASLC Lung Cancer Staging Project: External Validation of the Revision of the TNM Stage Groupings in the Eighth Edition of the TNM Classification of Lung Cancer[J]. J Thorac Oncol. 2017,12:1109–21.
8. Romeu, JL. Understanding binomial sequential testing. Statistical confidence, Reliability information analysis center (RIAC START). Department of defense united states of America, 2013.
9. Senan S, Brade A, Wang LH, et al. PROCLAIM: Randomized Phase III trial of pemetrexed-cisplatin or etoposide-cisplatin plus thoracic radiation therapy followed by consolidation chemotherapy in locally advanced nonsquamous non-small-cell lung cancer[J]. J Clin Oncol. 2016,34(9):953-62.
10. Ahn JS, Ahn YC, Kim JH, et al. Multinational randomized phase III trial with or without consolidation chemotherapy using docetaxel and cisplatin after concurrent chemoradiation in inoperable stage III non-small-cell lung cancer: KCSG-LU05-04[J]. J Clin Oncol, 2015,33(24):2660-6.
11. Peters S, Felip E, Dafni U, et al. Progression-Free and Overall Survival for Concurrent Nivolumab With Standard Concurrent Chemoradiotherapy in Locally Advanced Stage IIIA-B NSCLC: Results From the European Thoracic Oncology Platform NICOLAS Phase II Trial (European Thoracic Oncology Platform 6-14)[J]. J Thorac Oncol, 2021,16(2):278-288.
12. Manapov F, Kenndoff S, Käsmann L. NICOLAS, DETERRED and KEYNOTE 799: focus on escalation of conventionally fractionated chemoradiotherapy by immune checkpoint inhibition in unresectable stage III non-small cell lung cancer[J]. Transl Lung Cancer Res, 2022,11:702–5.
13. Anscher MS, Arora S, Weinstock C, et al. Association of Radiation Therapy with Risk of Adverse Events in Patients Receiving Immunotherapy: A Pooled Analysis of Trials in the US Food and Drug Administration Database[J]. JAMA Oncol, 2022,8(2):232-240.
附表
作者简介
临床解读
王谨医师
统计解读
莫淼
通信作者
季永领















 苏公网安备 32059002004080号
苏公网安备 32059002004080号


