医院:重庆大学附属肿瘤医院

重庆大学附属肿瘤医院肿瘤内科。长期从事肝癌与肺癌的基础研究和临床工作,主要研究方向为肿瘤的免疫与靶向治疗。近年来共发表学术论文20余篇,其中SCI文章7篇 (第一作者);参与国家自然科学基金和重庆市科技局课题3项。
肝癌发病率和病死率在我国一直居高不下。据报道,中国每年新发肝癌有41.0万例,死亡患者达到39.1万例,是我国发病率第四位、死亡率第二位的恶性肿瘤,占全球肝癌的一半以上[1]。与欧美国家不同的是,我国肝癌的发生与慢性乙型病毒性肝炎密切相关,约85%的肝癌患者具有乙肝病毒感染背景,而且多数初诊时即处于疾病晚期[2]。因此,肝癌治疗上的进展与突破,对于全世界范围特别是中国的患者来讲,意义非常重大。
在我国目前获批的晚期肝癌一线治疗主要包括索拉非尼、乐伐替尼和化疗等方案,疗效极其有限。近年来,免疫治疗在肿瘤治疗领域取得重大进展,其在肝癌中的应用也越来越得到重视,但存在疗效不确切、客观缓解率低和不良反应多,甚至是在患者获益后出现免疫耐受等一系列问题。几种大火的PD-1抑制剂在一线和二线单药治疗晚期肝癌临床试验中纷纷折戟沉沙,未取得突破性进展。
CheckMate040和KEYNOTE-224临床研究结果显示,帕博利珠单抗(Pembrolizumab)和纳武利尤单抗(Nivolumab)在肝癌二线治疗中分别取得了17%和15%-20%的客观缓解率,表现出良好的临床获益和安全性,一举奠定了“江湖地位”[3, 4]。但后续的帕博利珠单抗Ⅲ期KEYNOTE-240临床试验公示:相比于安慰剂组,帕博丽珠单抗能够延长既往接受索拉非尼治疗进展或不可耐受的二线进展期肝癌患者的总生存期(OS)(13.9个月 vs 10.6个月, P = 0.78)和无疾病进展生存期(PFS)(HR = 0.718, P = 0.0022)[5]。然而,OS和PFS均未能达到既定的显著统计学水平,试验宣告失败。纳武利尤单抗一线治疗晚期肝癌的CheckMate459研究结果显示,试验组患者的客观应答率和完全缓解率均优于对照组,但两组患者的中位OS值并无统计学差异(16.4个月 vs. 14.7个月, P = 0.0752)。2020年发表于Lancet Oncology的国产PD-1抗体——卡瑞丽珠单抗对于系统性治疗失败的217例晚期肝癌患者,有32例(14.7%)报告了客观反应,6个月的总生存率为74.4%[6]。现卡瑞丽珠单抗已被CSCO指南等推荐用于肝癌的二线治疗中。PD-L1抗体(Durvaluamb)联合Tremelimumab一线治疗晚期肝癌的临床研究也正在进行中(NCT03298451)。
精准和联合治疗已成为免疫治疗2.0时代的主旋律。在免疫治疗单药冲击肝癌一线治疗药物的尝试失败后,针对肝癌免疫治疗的重点逐渐转向多靶点联合治疗。去年5月发表于《新英格兰医学杂志》上的IMbrave150 Ⅲ期临床研究为探索肝癌治疗提供了一个新方向,在肝癌治疗史上具有里程碑式作用,堪为典范[7]。
IMbrave150是一项全球性III期、多中心、开放性临床试验,共入组501例既往未接受过系统性治疗的不可切除的肝细胞癌患者(包括194例中国患者),按2:1比例随机分配到PD-L1抑制剂阿替利珠单抗(Atezolizumab)联合抗血管生成药贝伐珠单抗的免疫联合治疗组(T+A: 阿特珠单抗1200mg +贝伐珠单抗15mg/kg, q3w)和索拉非尼单药治疗组(400mg/bid)。该研究的共同主要终点为独立审查机构(IRF)根据RECIST v1.1评估的OS和PFS。相关数据显示,与目前标准的索拉非尼单药方案相比,一线免疫联合治疗(T+A)显著延长了晚期肝癌患者的OS(19.2个月 vs. 13.4个月; HR = 0.66, 95% CI: 0.52-0.85)和PFS(6.9个月 vs. 4.3个月; HR = 0.59, 95% CI: 0.47 -0.76; P<0.001),其1年生存率提高到67.2%,突破了晚期肝癌10多年来一线治疗的瓶颈[7]。由此A+T方案也迅即被FDA批准用于晚期肝癌一线治疗中[8]。其中的亚组人群数据分析揭示,即便是存在更高的乙肝感染率、大血管侵犯/肝外转移以及甲胎蛋白 ≥400ng/ml等诸多不良预后因素,中位总生存期达到了24.0个月,优于索拉非尼单药组的11.4个月(HR = 0.53, 95% CI: 0.35-0.80),6个月生存率为86.6%,提示中国患者疗效比试验组整体人群更出色。IMbrave150试验中国亚组的数据提示,免疫联合靶向治疗模式同样甚至是更适合中国肝癌患者一线治疗。因此,针对中国肝癌患者开展相关临床研究迫在眉睫,意义重大。
不负所望,一项比较国产PD-1抑制剂达伯舒(信迪利单抗)联合达攸同(贝伐珠单抗)与索拉非尼在晚期肝癌一线治疗中的疗效和安全性的随机、对照、开放的多中心III期临床研究结果(ORIENT-32)在2020年ESMO上公布[9]。
ORIENT-32研究共纳入571例不可手术或转移且未经系统治疗的肝细胞癌患者,按照2:1比例随机分配到信迪利单抗(200mg/q3w)+贝伐珠单抗(15mg/kg)联合治疗组和索拉非尼组(400mg/bid)。主要研究终点是OS和由独立影像学评审委员会(IRRC)根据RECIST v1.1标准评估的PFS。次要研究终点包括基于RECIST v1.1标准评估的PFS、IRRC基于RECIST v1.1标准及肝癌 mRECIST标准评估的ORR。分层因素包括大血管侵犯和/或肝外转移(与否)、甲胎蛋白基线水平(< 400 vs. ≥ 400ng/ml)和ECOG PS评分(0 vs. 1)。

纳入的两组人群基线特征相当平衡,绝大多数患者(94.2%)患有乙型肝炎。截止数据公布时(2020-08-15),信迪利+贝伐珠单抗组的大多数患者仍存活,中位OS值尚未达到,显著高于索拉非尼组的10.4个月(NE vs. 10.4个月; HR = 0.57, 95%CI: 0.43-0.75, P < 0.0001)。联合治疗使患者死亡风险降低了43.0%。1年OS比例分别为62.4%(联合组)和48.5%(贝伐珠单抗组)。
 而进一步分析由IRRC评估的PFS情况可见,信迪利单抗+贝伐珠单抗组的中位PFS显著延长(4.5个月 vs. 2.8个月; HR = 0.57, 95%CI: 0.46-0.70, P < 0.0001),降低了43.5%的疾病进展或死亡风险。6个月OS率分别为43.6%(联合组)和19.5%(贝伐珠单抗组);9个月OS率分别为32.7%(联合组)和11.6%(索拉非尼组)。由此可见,信迪利联合贝伐珠单抗组可显著改善患者的OS和PFS情况。而且在所有不同相关临床亚组中,信迪利单抗+贝伐珠单抗联合组疗效均优于索拉非尼组。
而进一步分析由IRRC评估的PFS情况可见,信迪利单抗+贝伐珠单抗组的中位PFS显著延长(4.5个月 vs. 2.8个月; HR = 0.57, 95%CI: 0.46-0.70, P < 0.0001),降低了43.5%的疾病进展或死亡风险。6个月OS率分别为43.6%(联合组)和19.5%(贝伐珠单抗组);9个月OS率分别为32.7%(联合组)和11.6%(索拉非尼组)。由此可见,信迪利联合贝伐珠单抗组可显著改善患者的OS和PFS情况。而且在所有不同相关临床亚组中,信迪利单抗+贝伐珠单抗联合组疗效均优于索拉非尼组。
 在至少接受一次药物剂量治疗的患者中,与治疗相关不良事件在信迪利单抗+贝伐珠单抗联合治疗组的发生率为88.7%(n=380),在索拉非尼组为93.5%(n=185)。3级以上不良事件发生率依次为33.7%和35.7%。因此,与索拉非尼组单药治疗相比,信迪利单抗联合贝伐珠单抗一线治疗晚期肝癌在取得良好临床获益的同时,并未增加治疗相关毒性反应。
在至少接受一次药物剂量治疗的患者中,与治疗相关不良事件在信迪利单抗+贝伐珠单抗联合治疗组的发生率为88.7%(n=380),在索拉非尼组为93.5%(n=185)。3级以上不良事件发生率依次为33.7%和35.7%。因此,与索拉非尼组单药治疗相比,信迪利单抗联合贝伐珠单抗一线治疗晚期肝癌在取得良好临床获益的同时,并未增加治疗相关毒性反应。
这也是全球首个达到主要研究终点的PD-1抑制剂用于晚期肝癌一线治疗的III期研究。该研究在中国肝癌患者人群中开展,更符合中国的真实世界情况,更具说服力,且安全性和疗效均优,为肝癌患者带生机与希望,未来可期。
与经典的IMbrave150研究相比,我们发现ORIENT-32研究入组肝癌患者的PS评分更差,HBV感染、肝外转移率以及AFP≥400 ng/mL的患者比例明显更高。
 不过即便是ORIENT-32临床研究对象的基线特征预后更差,其生存获益甚至略优于IMbrave150研究人群。ORIENT-32研究中的患者死亡风险比例下降43%,而IMbrave150研究则下降42%。至于疾病进展风险比例则依次降低了43%和41%。
不过即便是ORIENT-32临床研究对象的基线特征预后更差,其生存获益甚至略优于IMbrave150研究人群。ORIENT-32研究中的患者死亡风险比例下降43%,而IMbrave150研究则下降42%。至于疾病进展风险比例则依次降低了43%和41%。
 横向分析其他肝癌相关免疫联合靶向研究中,我们发现ORIENT-32临床试验在取得显著临床获益的同时,3-4级的治疗相关不良反应发生率甚至较其他免疫联合治疗方案更低[7, 9-12]。
横向分析其他肝癌相关免疫联合靶向研究中,我们发现ORIENT-32临床试验在取得显著临床获益的同时,3-4级的治疗相关不良反应发生率甚至较其他免疫联合治疗方案更低[7, 9-12]。
 IMbrave150临床试验的成功,为肝癌的治疗史翻开了新的一页。免疫+抗血管生成药物成为全球首个获批的肝癌一线免疫疗法。而ORIENT-32研究则在此基础上提供了全球最大规模的、乙型肝炎相关的肝癌患者接受免疫联合治疗和传统靶向治疗的对比数据,对于改善中国肝癌患者预后具有重大意义,也给全世界乙肝相关性肝癌患者的治疗带来新曙光。
IMbrave150临床试验的成功,为肝癌的治疗史翻开了新的一页。免疫+抗血管生成药物成为全球首个获批的肝癌一线免疫疗法。而ORIENT-32研究则在此基础上提供了全球最大规模的、乙型肝炎相关的肝癌患者接受免疫联合治疗和传统靶向治疗的对比数据,对于改善中国肝癌患者预后具有重大意义,也给全世界乙肝相关性肝癌患者的治疗带来新曙光。
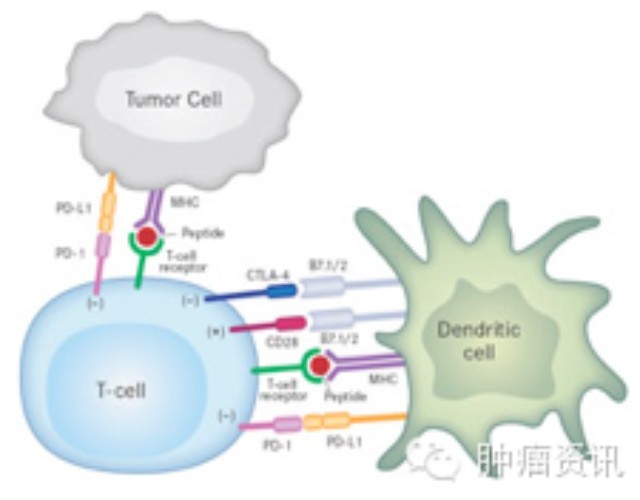
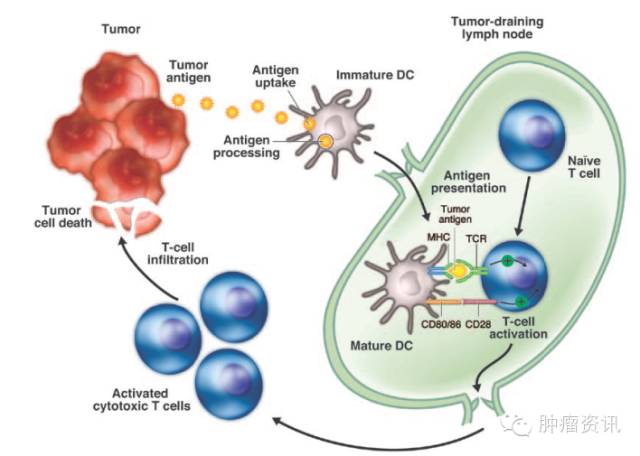
免疫检查点抑制剂一线单药治疗晚期肝癌在此前研究中未取得进展,这或与肝癌较强的免疫抑制环境有关,肿瘤微环境整体呈现出免疫细胞难以生存的缺血缺氧酸性环境[13, 14]。肝细胞癌是典型的炎性相关恶性肿瘤,其微环境中包含大量巨噬细胞(Kupffer细胞)及固有免疫和适应性免疫细胞[15]。肝癌免疫微环境表现出较其他恶性肿瘤更为显著的免疫抑制作用,几乎所有的细胞亚群和众多调控机制都有助于肝癌发生发展[16]。而且,肿瘤有大量结构特殊、易渗漏的新生血管,使抗肿瘤药物和免疫细胞很难抵达肿瘤病灶。即使免疫细胞能够浸润进肿瘤,缺氧和低pH值也会明显削弱其战斗力。且介导新生血管形成的VEGF等分子,还可通过激活免疫抑制细胞等抑制免疫应答[17]。当联合VEGF抑制剂能够将抑制性微环境重塑为免疫刺激性微环境,与免疫检查点抑制剂联合能够起到增强T细胞的抗肿瘤活性,两者相互促进,协同作用。
过去的一年是免疫治疗在肝癌领域取得突破性进展的一年。相对于免疫单药,免疫联合治疗方案疗效更确切。免疫联合方案不但在晚期肝癌患者药物治疗有效,而且在联合局部治疗和围术期治疗(包括术前新辅助治疗、转化治疗和辅助治疗)中也展现出广阔前景,为患者提供更多治疗选择。此外,多学科协作模式的运用也可为肝细胞癌患者提供个体化、规范精准的诊治方案,从而有效提升其生存率和生活质量。
免疫治疗的春天,注定如期而至,更多精彩,必将纷至沓来!正所谓:
春风杨柳万千条,十亿神州尽舜尧。
红雨随心翻作浪,青山着意化为桥。
借问癌君欲何往,免疫靶向照天烧。
1. Cao W, Chen HD, Yu YW, Li N, Chen WQ. Changing profiles of cancer burden worldwide and in China: a secondary analysis of the global cancer statistics 2020. Chin Med J (Engl) 2021, 134(7): 783-791.
2. Yang JD, Hainaut P, Gores GJ, Amadou A, Plymoth A, Roberts LR. A global view of hepatocellular carcinoma: trends, risk, prevention and management. Nature reviews Gastroenterology & hepatology 2019, 16(10): 589-604.
3. Zhu AX, Finn RS, Edeline J, Cattan S, Ogasawara S, Palmer D, et al. Pembrolizumab in patients with advanced hepatocellular carcinoma previously treated with sorafenib (KEYNOTE-224): a non-randomised, open-label phase 2 trial. The Lancet Oncology 2018, 19(7): 940-952.
4. Yau T, Kang YK, Kim TY, El-Khoueiry AB, Santoro A, Sangro B, et al. Efficacy and Safety of Nivolumab Plus Ipilimumab in Patients With Advanced Hepatocellular Carcinoma Previously Treated With Sorafenib: The CheckMate 040 Randomized Clinical Trial. JAMA oncology 2020, 6(11): e204564.
5. Finn RS, Ryoo BY, Merle P, Kudo M, Bouattour M, Lim HY, et al. Pembrolizumab As Second-Line Therapy in Patients With Advanced Hepatocellular Carcinoma in KEYNOTE-240: A Randomized, Double-Blind, Phase III Trial. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 2020, 38(3): 193-202.
6. Qin S, Ren Z, Meng Z, Chen Z, Chai X, Xiong J, et al. Camrelizumab in patients with previously treated advanced hepatocellular carcinoma: a multicentre, open-label, parallel-group, randomised, phase 2 trial. The Lancet Oncology 2020, 21(4): 571-580.
7. Finn RS, Qin S, Ikeda M, Galle PR, Ducreux M, Kim TY, et al. Atezolizumab plus Bevacizumab in Unresectable Hepatocellular Carcinoma. The New England journal of medicine 2020, 382(20): 1894-1905.
8. Casak SJ, Donoghue M, Fashoyin-Aje L, Jiang X, Rodriguez L, Shen YL, et al. FDA Approval Summary: Atezolizumab Plus Bevacizumab for the Treatment of Patients with Advanced Unresectable or Metastatic Hepatocellular Carcinoma. Clin Cancer Res 2021, 27(7): 1836-1841.
9. Ren Z, Fan J, Xu J, Bai Y, Xu A, Cang S, et al. LBA2 Sintilimab plus bevacizumab biosimilar vs sorafenib as first-line treatment for advanced hepatocellular carcinoma (ORIENT-32)2. Annals of Oncology 2020, 31.
10. Xu J, Shen J, Gu S, Zhang Y, Wu L, Wu J, et al. Camrelizumab in Combination with Apatinib in Patients with Advanced Hepatocellular Carcinoma (RESCUE): A Nonrandomized, Open-label, Phase II Trial. Clin Cancer Res 2021, 27(4): 1003-1011.
11. Li H, Qin S, Liu Y, Chen Z, Ren Z, Xiong J, et al. Camrelizumab Combined with FOLFOX4 Regimen as First-Line Therapy for Advanced Hepatocellular Carcinomas: A Sub-Cohort of a Multicenter Phase Ib/II Study. Drug design, development and therapy 2021, 15: 1873-1882.
12. Finn RS, Ikeda M, Zhu AX, Sung MW, Baron AD, Kudo M, et al. Phase Ib Study of Lenvatinib Plus Pembrolizumab in Patients With Unresectable Hepatocellular Carcinoma. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 2020, 38(26): 2960-2970.
13. Flecken T, Schmidt N, Hild S, Gostick E, Drognitz O, Zeiser R, et al. Immunodominance and functional alterations of tumor-associated antigen-specific CD8+ T-cell responses in hepatocellular carcinoma. Hepatology (Baltimore, Md) 2014, 59(4): 1415-1426.
14. Sangro B, Sarobe P, Hervás-Stubbs S, Melero I. Advances in immunotherapy for hepatocellular carcinoma. Nature reviews Gastroenterology & hepatology 2021: 1-19.
15. Kurebayashi Y, Ojima H, Tsujikawa H, Kubota N, Maehara J, Abe Y, et al. Landscape of immune microenvironment in hepatocellular carcinoma and its additional impact on histological and molecular classification. Hepatology (Baltimore, Md) 2018, 68(3): 1025-1041.
16. Nishida N, Kudo M. Immunological Microenvironment of Hepatocellular Carcinoma and Its Clinical Implication. Oncology 2017, 92 Suppl 1: 40-49.
17. Courau T, Nehar-Belaid D, Florez L, Levacher B, Vazquez T, Brimaud F, et al. TGF-β and VEGF cooperatively control the immunotolerant tumor environment and the efficacy of cancer immunotherapies. JCI insight 2016, 1(9): e85974.













 苏公网安备32059002004080号
苏公网安备32059002004080号


