2019年,欧洲血液学年会(EHA)于6月13~16日在荷兰阿姆斯特丹举办,期间围绕EBV和淋巴瘤进行了专题讨论,来自法国Necker医院的Olivier hermine教授和来自英国Wales大学医院的Stefan Dojcinov教授分别从EBV相关血液系统疾病和EBV相关疾病的病理学方面作了精彩的演讲。结合EHA期间的相关研究进展,【肿瘤资讯】特邀徐州医科大学附属医院血液科淋巴瘤中心桑威教授进行了精彩点评。

徐医附院血液科科副主任
徐医附院血液科淋巴瘤诊疗中心副主任
中华医学会血液学分会感染学组委员
中国抗癌协会淋巴瘤专委会委员
中国抗癌协会血液肿瘤专业委员会青年委员
中国抗癌协会血液肿瘤委员会慢淋工作组委员
中国老年医学会血液学分会淋巴瘤学组委员
江苏省淋巴瘤联盟副主席
江苏省医学会血液学分会淋巴瘤/骨髓瘤学组委员
江苏省医学会血液学分会抗感染学组委员
江苏省“六大人才高峰”培养对象
江苏省“科教强卫工程”青年医学人才
徐州医学会血液学分会淋巴瘤学组副组长
徐州抗癌协会血液肿瘤委员会副主任委员




EBV概述
45年前(1964年),英国病毒学家Epstein和实验助手Barr,成功从英国医生Burkitt从非洲带回来的淋巴瘤样本中分离出该病毒,并命名为Epstein-Barr Virus(EBV),研究成果发表在《柳叶刀》。EBV呈全球性分布(地方性和散发性),灵长类动物是其唯一的天然宿主,EBV是通过呼吸道传播的“亲吻病毒”,约90%~95%的健康人在3岁之前感染病毒并以潜伏感染的形式终生携带。EBV基因组172kb,编码180余种蛋白和40余种miRNA。EBV编码蛋白的表达具有精准的时相性,其中BZLF1/BRLF1蛋白表达裂解感染相关,LMP1/2主要在潜伏期表达。根据潜伏期EBV编码抗原表达的不同,EBV相关肿瘤可以分为EBV潜伏Ⅰ-Ⅲ型。


EBV(Epstein-Barr Virus, EBV)是一种潜在的致瘤病毒,约90%~95%的健康人感染并终生携带该病毒。EBV可以诱导宿主细胞克隆转化,约2%的肿瘤和EBV感染相关。常见的EBV相关疾病包括:传染性单核细胞增多症(IM)、慢性活动性EBV感染(CAEBV)、噬血细胞综合症(HLH)等感染性疾病;鼻咽癌、胃癌等实体瘤;以及伯基特淋巴瘤(BL)、NK/T细胞淋巴瘤(NKTCL)等淋巴瘤。
EBV感染机制
EBV是双链DNA病毒,主要通过上皮细胞的EphA2受体分子感染上皮细胞(Zhang H, Nat Microbiol, 2018),通过B细胞的CD21受体分子感染B细胞, T/NK细胞的感染机制尚不明。EBV的感染可以触发机体的细胞毒性T细胞(CTL),NK细胞,γδT以及TDTH细胞对受染细胞进行免疫清除,EBV可以在记忆性B细胞中以潜伏感染形式存在。EBV感染可诱导体液免疫系统产生针对EBV的相关抗体,其中VCA-IgG往往伴随宿主终生。EBV在潜伏状态下,通过EBNA调控EBV-DNA复制,不再依赖DNA聚合酶,所以对常规的抗病毒药物如更昔洛韦,膦甲酸钠等抗病毒药物的治疗无效。
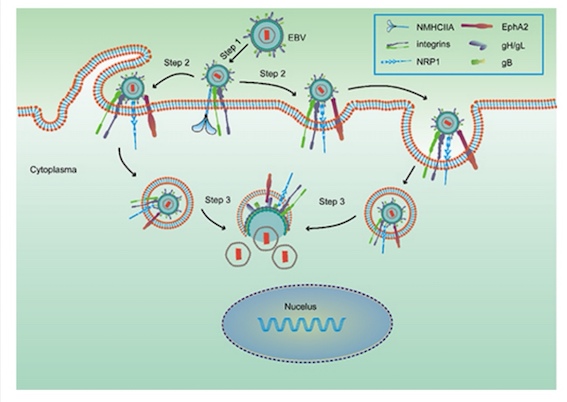
Palser等研究(Plaser, J Virol,2015)发现,EBV尚存在地理和疾病相关的多态性,其中疾病相关的多态性主要通过减少EBV编码抗原表位的免疫原性躲避机体的免疫清除。Halabi等研究(Halabi, Int J Cancer, 2016)则表明,相比较其他淋巴瘤(4.8%),46.1%NK/T细胞淋巴瘤中的EBV-LMP1基因存在30bp片段的缺失。
EBV相关疾病
EBV的感染可以触发机体的免疫应答,包括激活γδT,NK,以及诱导产生EBV特异性的CTL,帮助清除受感染细胞。在宿主免疫功能缺陷的情况下,发生EBV潜伏感染相关疾病的风险明显增高,EBV可以通过其编码的相关病毒抗原诱导宿主细胞的克隆转化。1968年,证实EBV在体外可以诱导B淋巴细胞向潜伏Ⅲ型的克隆转化(LCL);1969年证实EBV是传染性单核细胞增多症(IM)的致病因素;1970年证实EBV是非洲地方性伯基特淋巴瘤(BL)的致病因素,其后陆续证实EBV和霍奇金淋巴瘤(HL),T-NHL(NK/T,AITL),B-NHL(PTLD,DLBCL,PBL,PEL), HLH以及鼻咽癌和上皮/间质肿瘤等实体瘤发病相关。
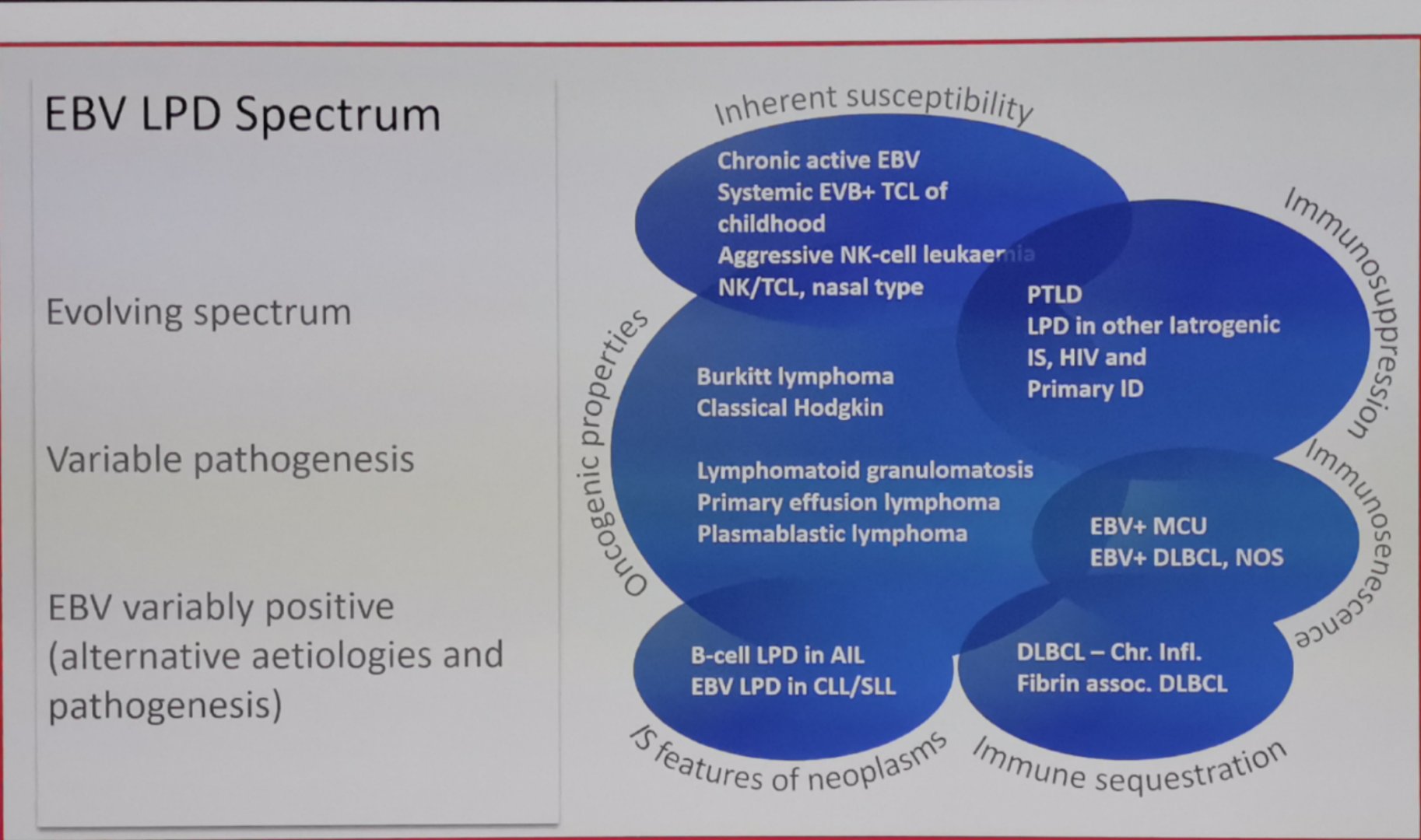 尤其当患者存在遗传性免疫功能缺陷的情况下,如原发免疫性疾病(PID) 患者,T细胞往往存在增殖和效应功能的缺失,对EBV感染具有更高的易感性,EBV可以作为直接的触发因素,诱导EBV相关感染性以及克隆性疾病的发生,如家族性HLH和相关淋巴瘤的发生。ATM基因是与DNA损伤检验有关的一个重要基因,最早发现于毛细血管扩张性共济失调症(AT)患者。ATM基因不仅和DNA的修复有关,对于抑制EBV所编码的LMP1的功能也具有重要的作用,因此,在AT患者由于ATM基因的异常导致的淋巴瘤中,50%的NHL和100%的HL的EBV阳性。
尤其当患者存在遗传性免疫功能缺陷的情况下,如原发免疫性疾病(PID) 患者,T细胞往往存在增殖和效应功能的缺失,对EBV感染具有更高的易感性,EBV可以作为直接的触发因素,诱导EBV相关感染性以及克隆性疾病的发生,如家族性HLH和相关淋巴瘤的发生。ATM基因是与DNA损伤检验有关的一个重要基因,最早发现于毛细血管扩张性共济失调症(AT)患者。ATM基因不仅和DNA的修复有关,对于抑制EBV所编码的LMP1的功能也具有重要的作用,因此,在AT患者由于ATM基因的异常导致的淋巴瘤中,50%的NHL和100%的HL的EBV阳性。
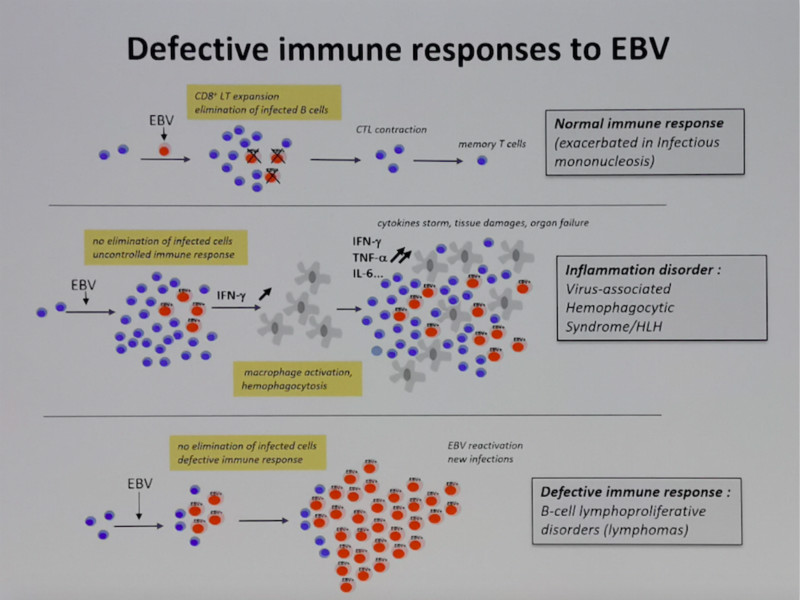
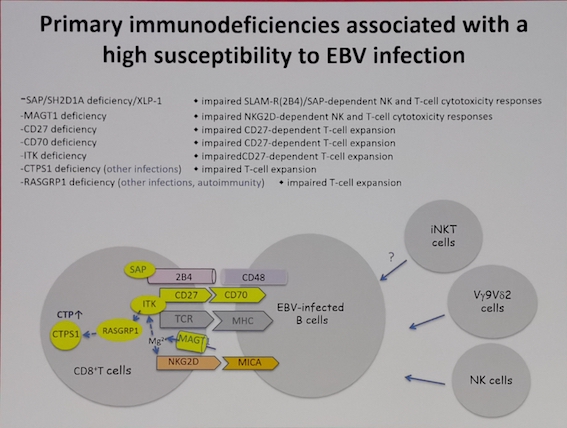

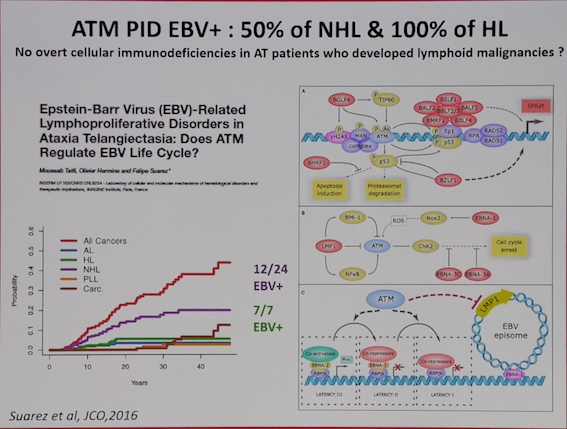
而且,一旦EBV-LPD发生,往往可以逃避宿主的免疫监视,可能和病毒潜伏的相关机制,肿瘤细胞的免疫逃逸,以及EBV特异性CTL以及体液免疫系统的缺陷等相关。而未知的依然较多:如何引发淋巴细胞的转化?如何感染T/NK细胞?EBV受染细胞如何逃避宿主的免疫清除?如何利用EBV感染机制作为EBV相关淋巴瘤的治疗参考?
EBV相关淋巴瘤的病理
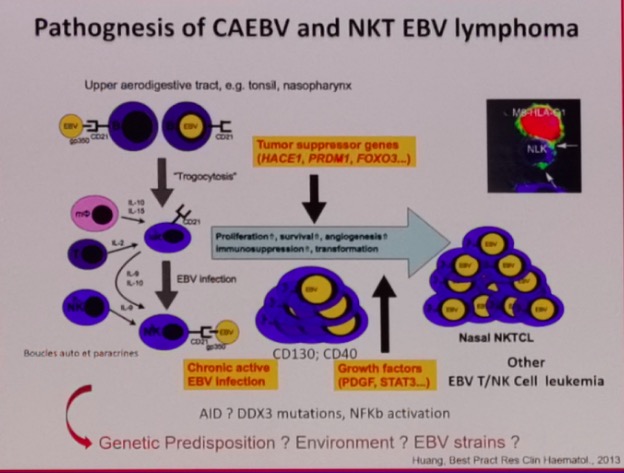
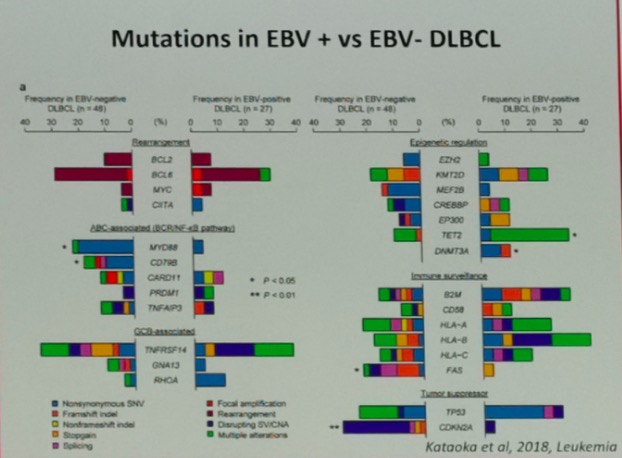
在2017WHO更新的淋巴瘤分类中,明确为EBV受累的T和NK细胞淋巴组织增生性疾病中,包括儿童系统性EBV阳性T细胞淋巴组织增殖性疾病(CSEBV+TLPD),慢性活动性EBV感染(CAEBV-T/NK),侵袭性NK细胞白血病,结外鼻型NK/T细胞淋巴瘤,种痘样水疱病(hydroa vacciniforme-like disease HVD),蚊叮超敏反应(hypersensitivity to mosquito bites,HMB)均和EBV感染直接相关。多伴有抑癌基因HACE1,PRDM1,FOXP3的表达下调,而PDGF,STAT3等生长因子的上调。EBV阳性是NK/T细胞淋巴瘤和DLBCL独立的不良预后因素,EBV的病毒载量对于评估患者预后,疗效评估具有重要的临床价值。相比较于EBV- DLBCL,EBV+ DLBCL具有不同的基因突变状态,中位生存也仅仅24-27周。
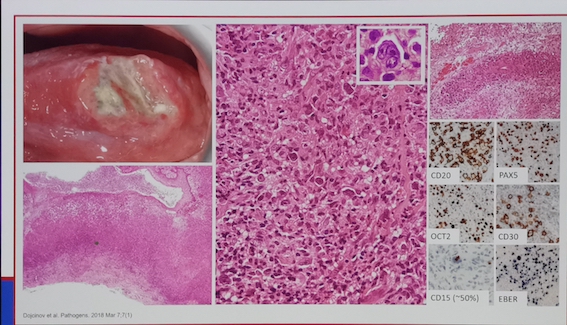
EBV通过侵染宿主细胞,可以通过一系列途径改变肿瘤的微环境,包括上调患者T细胞的PD1, CTLA-4,以及肿瘤细胞的PDL1/2,CD38,CD30等分子。诱导肿瘤细胞的免疫逃逸。此外,EBV还可以通过LMP1以及LMP2分别模拟CD40和BCR受体,启动下游的信号通路,如NF-KB, PI3K, STATA等影响淋巴瘤细胞的迁移,细胞周期,凋亡等功能。
EBV相关淋巴瘤的治疗
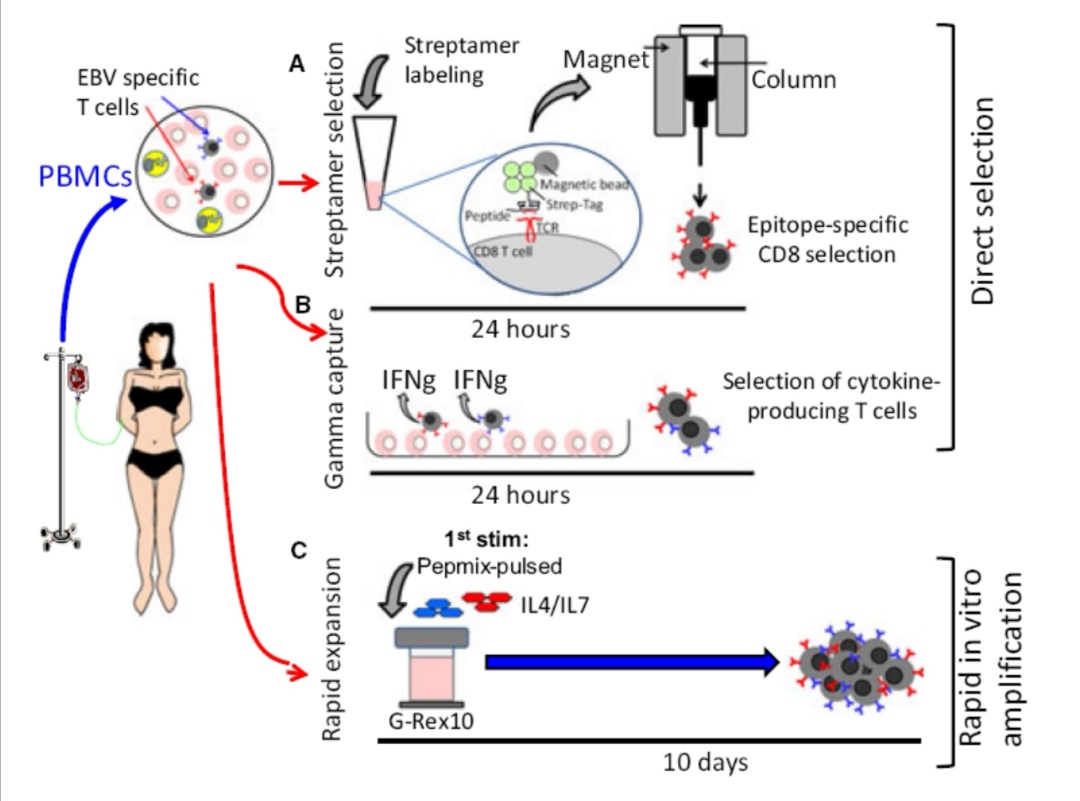
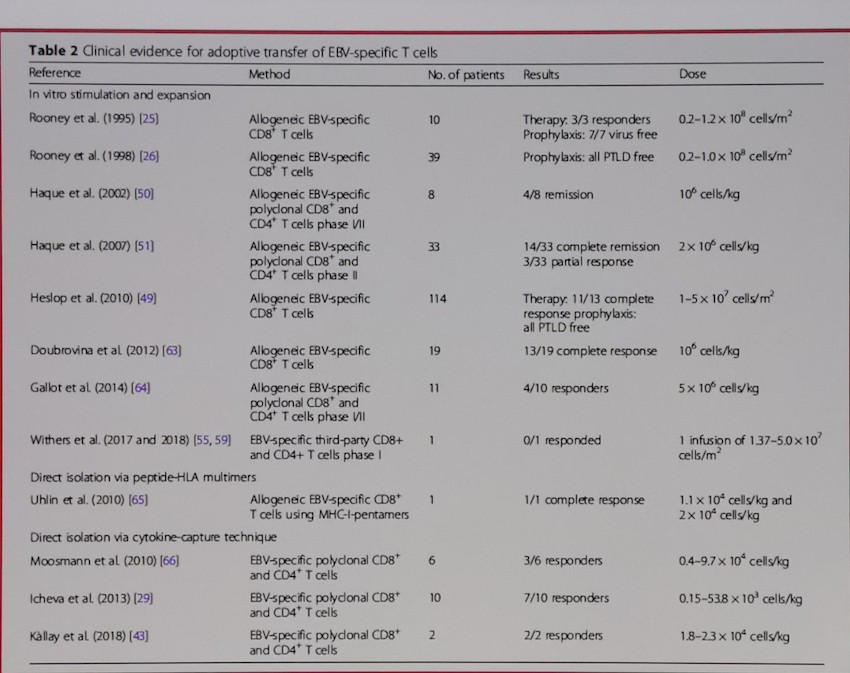
目前临床上针对EBV相关淋巴瘤的治疗,主要还是针对原发病的免疫化疗+/-放疗的综合治疗,其中针对NK/T细胞淋巴瘤,以培门冬酶/门冬酰胺酶为基础的联合治疗取得了突破性进展,尚无针对EBV编码抗原的靶向治疗选择,此外,由于EBV在相关淋巴瘤中呈潜伏感染状态,病毒DNA复制不依赖DNA聚合酶,也没有有效的抗病毒药物可选。EBV特异性CTL为EBV相关LPD的细胞免疫治疗率先打开了局面,尤其在针对移植后的EBV相关LPD(PTLD)取得了巨大的成功(Heslop, Blood, 2016),可以获得50%以上的CR和80%的ORR,且并没有明显的重度炎症反应等毒副作用发生。EBV特异性CTL可以来自EBV+的患者的体外分选扩增,可以来自EBV-患者的体外诱导扩增(Immunol Rev. 2014),也可以来自EBV+的造血干细胞移植供者,也可以来自第三方的EBV-CTL库(Tanzina, Blood. 2007)。Catherine M等通过LMP1-CTL治疗21位R/R EBV相关淋巴瘤,获得了52%的CR和62%的ORR(J Clin Oncol. 2014)。随着EBV-CTL的研究深入以及临床EBV-CTL制备工艺的简化,未来可以为EBV相关淋巴瘤患者带来更多的治疗选择。
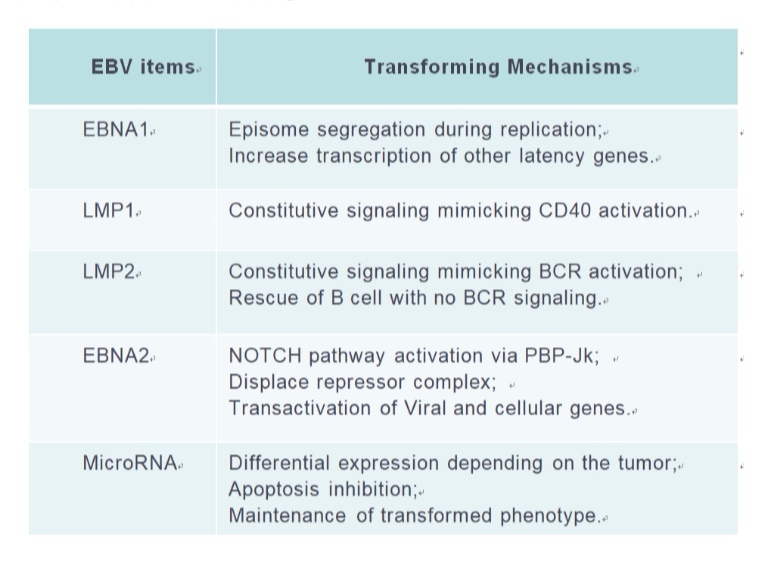
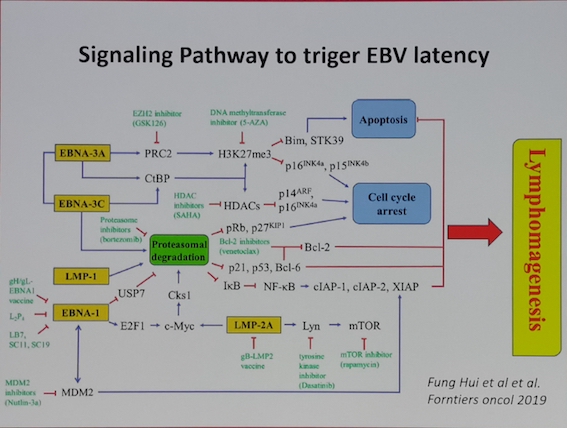
EBV编码蛋白以及microRNA均参与了淋巴细胞的克隆转化以及参与调控胞内的信号通路,影响淋巴瘤细胞的生物学功能。其中LMP1/2,EBNA1,microRNA等均可以尝试作为未来针对EBV相关疾病的治疗选择(Joanna B, Cancers,2018; Lifang Y,Molecules, 2010)。而EBV通过模拟CD40和BCR信号通路激活所涉及的胞内信号通路,如PI3K, NF-κB,mTOR(S Furukawa, Am J Transplant. 2013; Junichi K,Clin Cancer Res. 2014)的小分子抑制剂也在进行针对EBV相关淋巴瘤治疗的探索中。此外,针对EBV所改变的淋巴瘤患者的免疫微环境,比如上调T细胞PD1,上调肿瘤细胞的PDL1/2,CD38,CD30等膜蛋白水平,免疫检查点抑制剂如PD-1抗体治疗NK/T获得了成功(Yok-lam Kwong,Blood,2017),针对CD38,CD30等靶点的免疫治疗也是针对EBV相关淋巴瘤的治疗靶点。而通过诱导EBV进入裂解感染,则为联合使用抗病毒药物的治疗提供了新的选择。
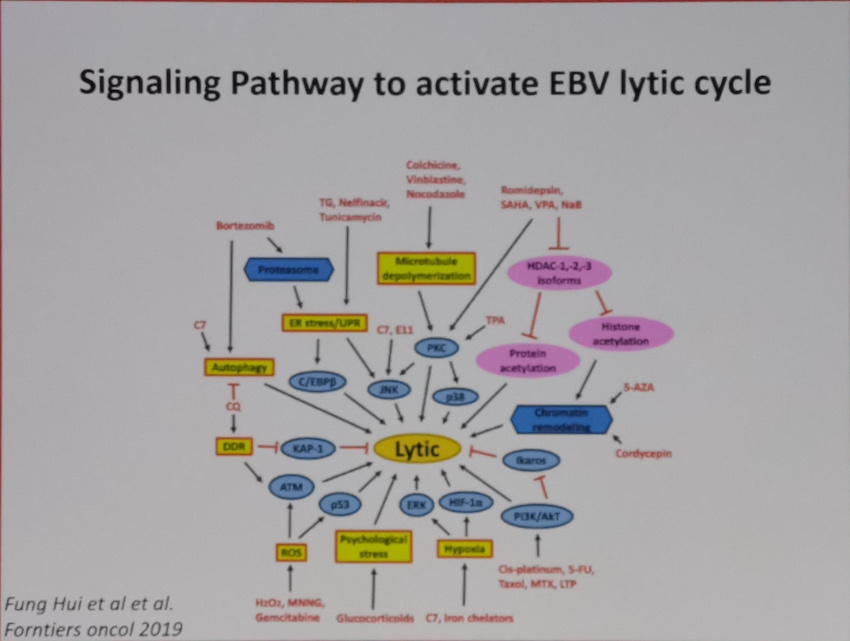
小结
EBV是重要的双链DNA致瘤病毒,可以和宿主基因组进行整合,通过调控EBV编码抗原表达以及microRNA等诱导了淋巴细胞的克隆转化。此外,EBV通过改变宿主的免疫微环境,诱导淋巴瘤的免疫逃逸。潜伏状态的EBV将关闭依赖DNA聚合酶的相关基因,通过EBNA等调控潜伏状态下的EBV-DNA的复制,从而抵抗抗病毒药物的清除。EBV编码的相关抗原如LMP1/2等还可以模拟CD40,BCR等受体信号通路,直接参与调控淋巴瘤细胞的胞内信号通路,调控淋巴瘤细胞的凋亡,增殖,细胞周期等生物学功能。EBV病毒载量和淋巴瘤的预后高度相关,可以用于对淋巴瘤的危险度分层和疗效评估。未来针对EBV相关的治疗,可以尝试通过诱导EBV进入裂解感染,增加EBV对抗病毒药物的敏感性,联合免疫化疗,提高疗效;可以通过阻断EBV编码抗原所激活的细胞内信号通路,进行靶向治疗;可以尝试通过以EBV编码抗原为治疗靶点,进行有效的EBV特异性的免疫治疗。而未来,期待针对EBV特异性疫苗的研制成功,可以从根本上阻止EBV相关肿瘤的发生。













 苏公网安备 32059002004080号
苏公网安备 32059002004080号


