晚期恶性肿瘤的治疗已经由传统单一化疗转变为化疗、靶向、免疫等多元化多学科协同治疗模式。探寻患者疾病的起因、特征,以及潜在治疗靶点,评估其是否为免疫治疗优势人群成为目前晚期恶性肿瘤研究的重要课题。由Roche-Foundation Medicine(以下简称FMI)开发的FoundationOne®全面基因组测序(Comprehensive Genomic Profiling-简称CGP)分析服务,经实践验证可以为肿瘤患者提供较准确的相关基因信息,为患者的诊断和治疗等方面提供有价值的支持。在今年的ASCO(2018年)大会上,多项研究采用FoundationOne®产品检测晚期恶性肿瘤基因状态,指导患者诊疗获得成功。
由FMI开发的FundationOne®全面基因组测序(CGP)分析服务目前已经进入中国市场。FundationOne®针对所有实体肿瘤(除肉瘤以外)使用组织样本,应用“基于杂交捕获”的NGS技术,在一次检测中平行提供了315个基因的4种基因变异及TMB和MSI两种基因标签的全面分子信息,更加精准地指导个体化靶向及免疫治疗方案。FoundationOne®的检测结果是经过严谨分析验证的,同平台下的FoundationOne CDxTM是FDA批准的首个经过临床验证的NGS伴随诊断(CDx),并被美国医疗保险和医疗补助服务中心(CMS)覆盖。
以下列举2018 ASCO中采用FoundationOne®的部分研究成果:
Abs 12000 在多个瘤种中探寻TMB和atezolizumab疗效的相关性
背景
目前,在多个瘤种中的研究显示,TMB可能可以预测免疫检查点抑制剂的疗效。可通过全外显子测序或CGP检测TMB。预测的新抗原负荷(NAL)是TMB的一个表现,也可能与免疫治疗疗效相关。采用TMB检测有助于寻找独立于PD-L1之外的免疫治疗获益人群。
方法
本研究采用FoundationOne®计算TMB,以TMB≥16 mut/Mb作为高TMB的cut-off值,评估TMB高的患者能否从Atezolizumab单药治疗中获益。本研究纳入了7个Atezolizumab单药临床试验,各个研究的入组情况总结见下图1。高TMB在不同瘤种中的分布:非小细胞肺癌47%,尿路上皮癌40%,其它15个瘤种的患者13%。

图1. 回顾性分析纳入7个Atezolizumab单药的临床试验
在IMvigor210研究中,TMB(采用FoundationOne®检测)和预测的NAL(采用WES检测)显著相关(r=0.85)。TMB与Atezolizumab单药治疗的ORR显著相关;预测的NAL也与Atezolizumab单药治疗的ORR显著相关,见图2。
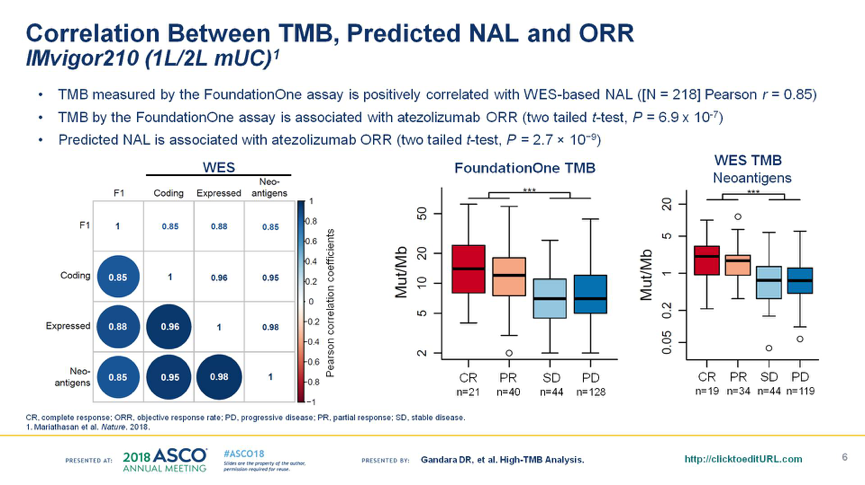
图2. IMvigor210研究中,TMB与预测的NAL和ORR的关系
在多个瘤种中的分析显示,以TMB≥16 mut/Mb作为高TMB的cut-off值,可以很好的预测Atezolizumab单药治疗的ORR,且患者分布比例合理,见下图3。此外,汇总分析在NSCLC和mUC中进行的3项研究POPLAR,OAK和IMvigor211,随着TMB的增高,Atezolizumab对比化疗的PFS获益更显著,见下图4。
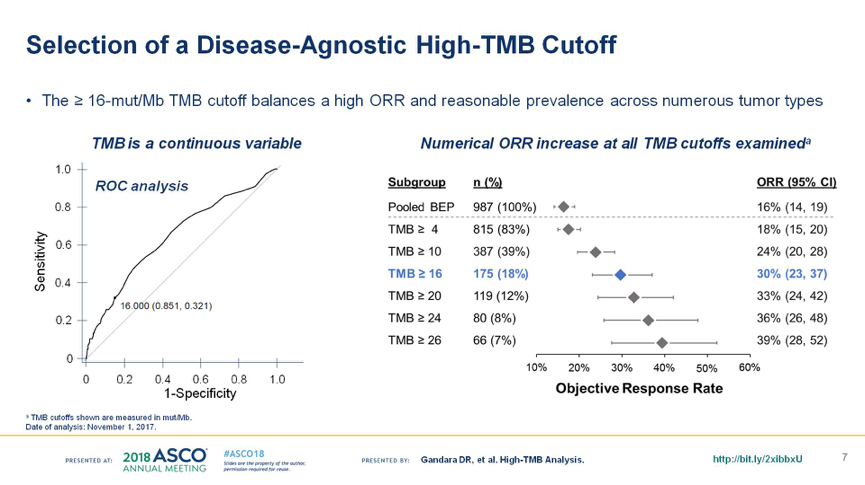
图3. TMB≥16 mut/Mb是理想的cut-off值
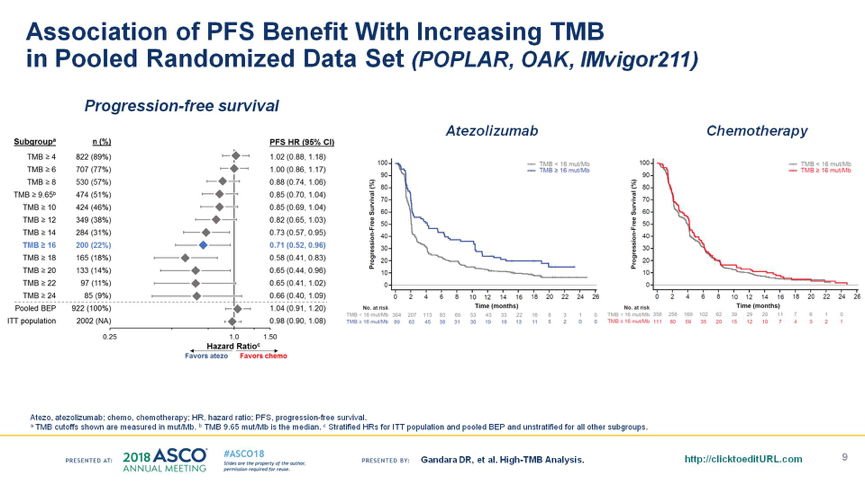
图4. POPLAR,OAK和IMvigor211研究中,TMB与Atezolizumab治疗的PFS的关系
以TMB≥16 mut/Mb作为cut-off值筛选的免疫优势人群与PD-L1高表达患者存在不一致性,TMB≥16 mut/Mb且PD-L1高表达(IC2/3或IC/TC2/3)的患者,接受Atezolizumab治疗的ORR最高,见下图5。
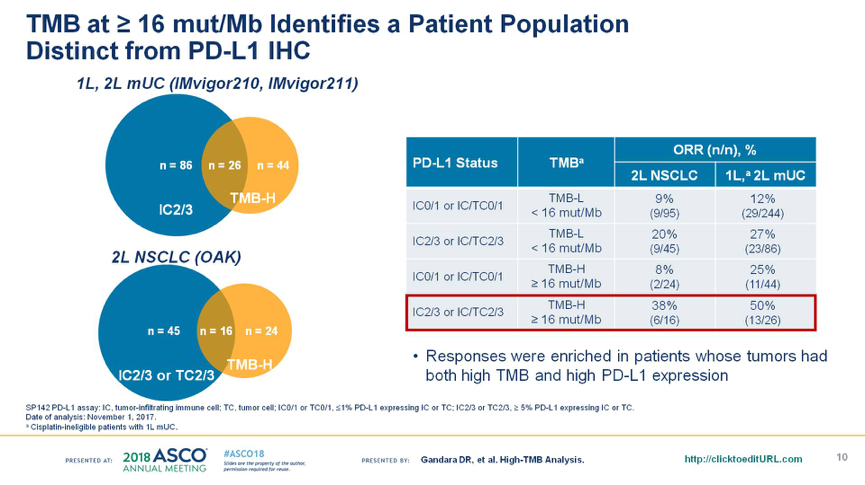
图5. 高TMB和PD-L1高表达的关系
小结
这一回顾性分析显示,在不同瘤种中高TMB(≥16 mut/Mb)与Atezolizumab单药治疗的ORR,DOR和PFS存在相关性,但在不同瘤种中,高TMB的最佳cut-off值可能存在差异,尚需进一步研究。采用FoundationOne®检测定义的高TMB可以作为NAL的替代指标。TMB和PD-L1是两个相对独立的预测因子,前瞻性的临床研究正在评估基于tTMB和bTMB入组的人群与肿瘤免疫治疗的疗效的相关性。
Abs 12092 实体瘤和血液肿瘤中PD-L1的基因变异分析
PD-L1基因(CD274/B7H1)的扩增或重排可以导致PD-L1的过表达,与免疫治疗更好的疗效相关。本研究通过在多种实体瘤中使用FoundationOne®,以及在血液系统肿瘤患者中使用FoundationOne®Heme来评估患者PD-L1基因的变异情况及判断其与疗效的关系。
研究从覆盖>450种不同肿瘤亚型(disease ontology)的患者中收集了140,411个肿瘤组织标本。 CD274基因扩增定义为染色体倍数>=4个,PD-L1重排定义为至少保留CD274外显子1-5。此外,一部分患者的肿瘤样本还采用DAKO22c3(肺)或Ventana SP142(肺和其他)抗体进行PD-L1的IHC检测。
140,411个肿瘤组织标本的肿瘤类型分布见下图6,共检测到1410个CD274基因变异,其中扩增、错义突变、重排和截短突变和剪接点突变的发生率分别为62.2%,29.3%,4.2%,3.3%和0.6%。
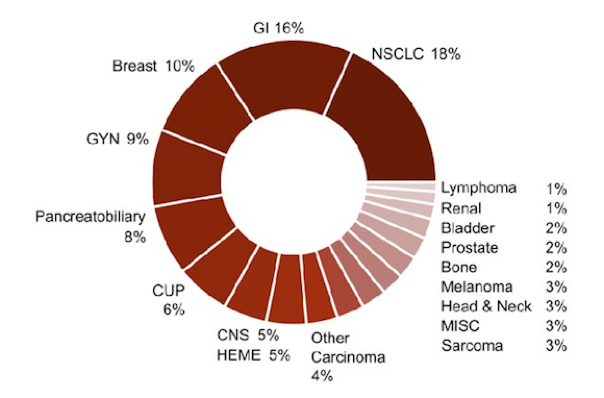
图6. 肿瘤分布类型
下表1和2分别总结了不同瘤种中CD274基因扩增或重排的发生率。在最常见的10种肿瘤中,乳腺癌(213例)和肺癌(210例,其中185例为NSCLC)贡献的PD-L1扩增患者数最多。PD-L1扩增发生率较高的瘤种包括:HNSCC(2.5%),一部分头颈肿瘤和乳腺癌(1.5%),淋巴瘤(1.5%),肉瘤(1.2%),NSCLC(0.7%)和膀胱癌(0.8%),其他常见的瘤种包括结直肠癌,胰腺癌,卵巢或前列腺癌,黑色素瘤和胶质瘤(PD-L1扩增率均低于0.3%)。
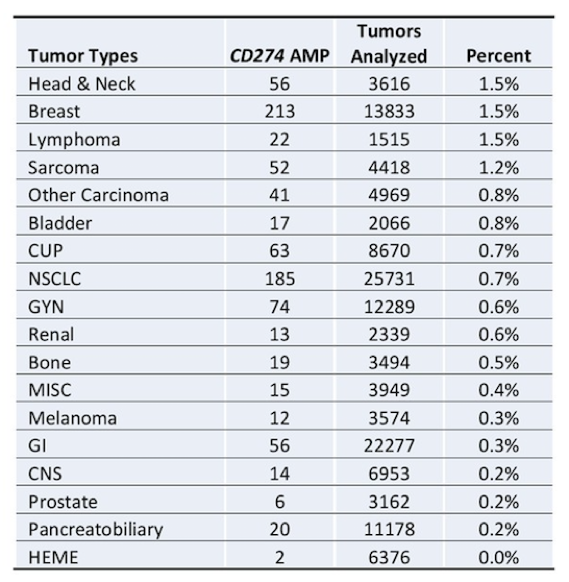
表1. 不同瘤种中CD274基因扩增的发生率
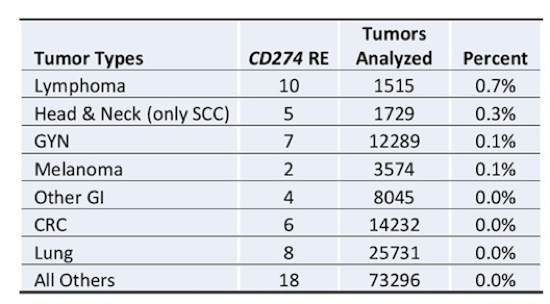
表2. 不同瘤种中CD274基因重排的发生率
采用22c3抗体检测肺癌患者中PD-L1的表达(高表达定义为PD-L1>=50%且膜染色>=1+;低表达定义为PD-L1 1-49%;表达阴性或不表达定义为PD-L1<1%),其中CD274基因扩增的患者,PD-L1表达状态总结见下表3。
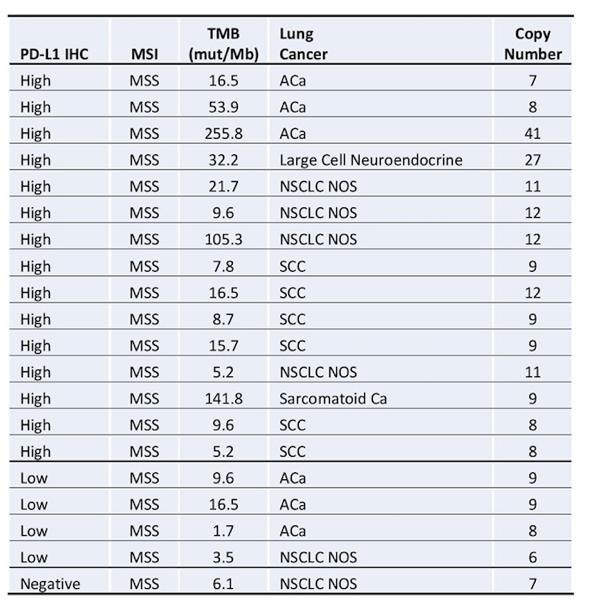
表3. 在CD274基因扩增的肺癌患者中PD-L1的表达水平
采用SP142抗体检测CD274基因重排(n=8)患者的PD-L1表达水平,总结见下表4。结果显示8例患者,6例PD-L1高表达,2例PD-L1低表达,仅1例PD-L1表达阴性。
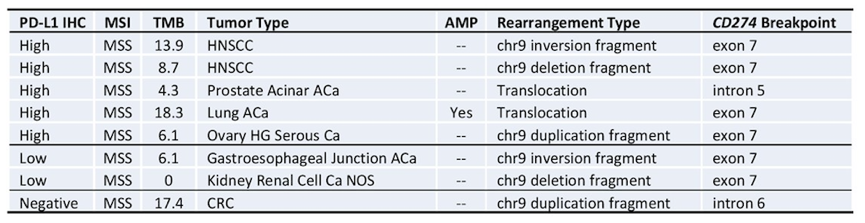
表4. CD274重排患者中,PD-L1的表达情况
采用SP142抗体检测CD274基因截短突变(n=7)患者的PD-L1表达水平,总结见下表5。结果显示7例患者,仅2例PD-L1高表达,1例PD-L1低表达,其余4例PD-L1表达阴性。
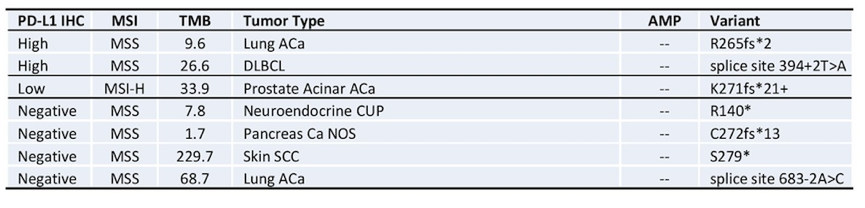
表5. CD274截短突变的患者中,PD-L1的表达情况
在CD274基因错义突变的患者中,分布采用SP142和22c3抗体检测PD-L1的表达情况总结见下表6。结果显示采用SP142检测的39例患者,29例PD-L1表达阴性,仅1例PD-L1高表达。采用22c3检测的5例患者,1例PD-L1高表达,PD-L1低表达和阴性的患者分别2例。

表6. CD274错义突变患者中,PD-L1的表达情况
进一步分析CD274扩增患者(无基因重排或单核苷酸变异)中,不同组织学类型与PD-L1表达的关系,结果显示鳞癌患者相比于其他类型的恶性肿瘤患者,更可能出现PD-L1高表达,总结见下表7。
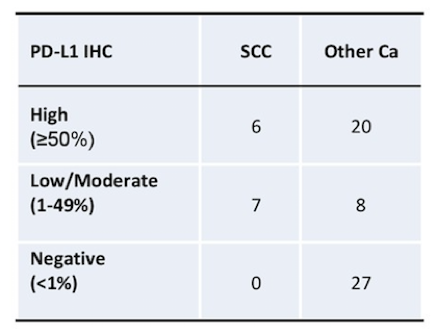
表7. 在CD274扩增的患者中,鳞癌相比其他恶性肿瘤更有可能出现PD-L1高表达
研究中同时展示了2例接受免疫治疗的病例。病例1为一例转移性皮肤基底细胞癌患者,转移至肝脏。采用CGP检测患者的CD274扩增,患者接受nivolumab治疗4个月后病灶几乎完全缓解,见下图7。病例2为一例卵巢癌患者,复发进展后对手术、化疗和放疗均耐药,检测到患者PD-L1高表达且合并CD274基因重排(测序显示为CD274-PLGRKT基因重排,断裂位点为CD274的exon7,基因重排经RT-PCR和Sanger测序验证)。患者接受pembrolizumab治疗后几乎完全缓解,见下图8。
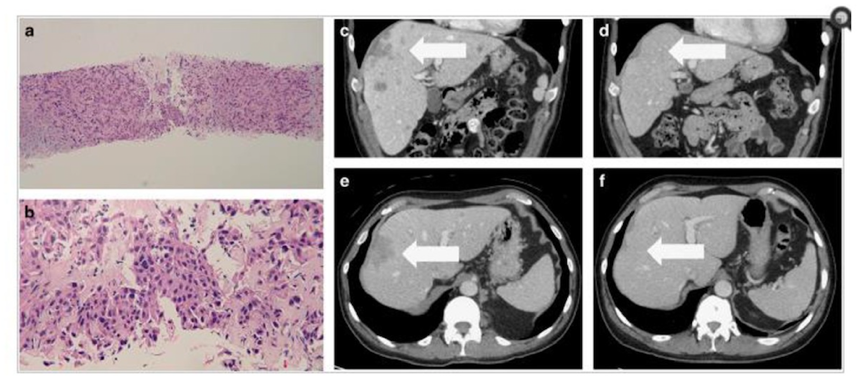
图7. 病例1的活检标本和影像学变化
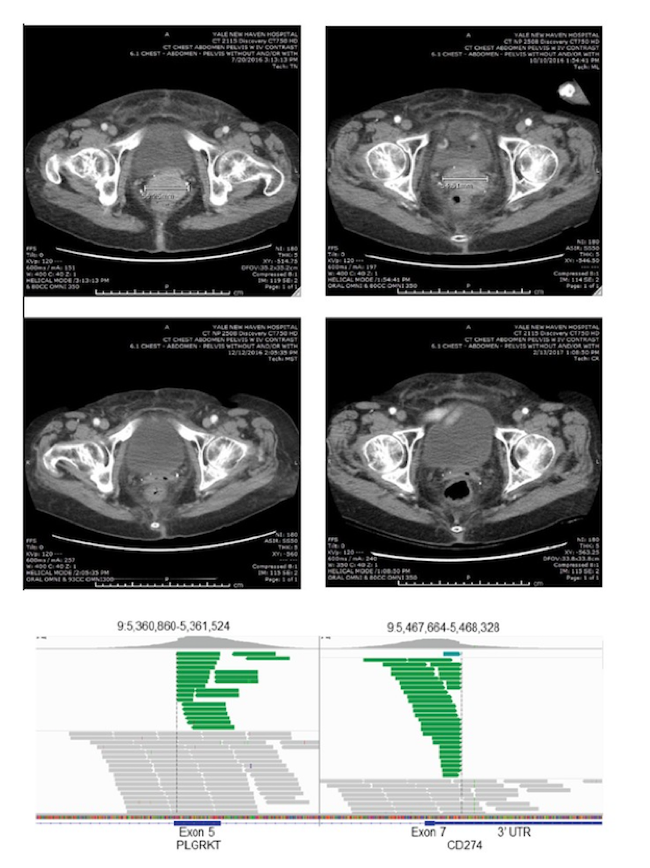
图8. 病例2 的影像学变化和CD274基因测序图
小结
目前的研究表明PD-L1基因(CD274)扩增或重排导致的PD-L1过表达可能与患者对免疫检查点抑制剂的疗效呈正相关。这一研究发现,在不同的瘤种中包括实体瘤和淋巴瘤中均检测到CD274基因重排,体细胞错义突变,无义突变或框移变异,但发生率均非常低,大多数的基因变异意义不明。在肺癌和鳞癌中,CD274基因的扩增或重排与PD-L1蛋白高表达高度相关,短片段变异与PD-L1高表达的相关性尚未明确。
Abs 2531 在经过多线治疗后的晚期恶性肿瘤患者中,基于患者分子突变谱选择相应的个体化治疗:评估精准联合治疗的价值
背景
精准医学临床研究已经在多个瘤种中开展,目前主要是基于患者的分子变异匹配相应的靶向、免疫治疗,然而研究并非一帆风顺,部分研究成果喜人的同时,部分研究结果带来更多困扰,患者的阳性意义的基因变化发现率低,基因变化与治疗匹配率低(约为5-10%),接受治疗后的应答率也较低,都是临床实际遇到的难题。究其原因,是多种因素造成,如基因检测的panel设置太小,能匹配的相应靶向免疫治疗有限或相关性较弱,或入组的晚期患者治疗的执行性较差。本研究出发点在于,期望通过个体化精准治疗来改善这一类难治性肿瘤患者的预后。
方法
I-PREDICT是一项前瞻性的研究,采用FoundationOne®检测315个癌症基因,评估患者的TMB,并对部分患者进行PD-L1 IHC检测。分子肿瘤专家组讨论患者的基因测序结果,并推荐相应的靶向/免疫治疗联合方案,最终治疗方案由临床医生根据病人实际情况决定实施。
结果
研究共入组了149例晚期恶性肿瘤患者,在83例(55.7%)接受治疗患者中,73例(总体49.0%)患者接受匹配治疗;10例(16.7%)患者未匹配,见图9。入组患者包括胃肠道肿瘤,肝胆系统,妇科肿瘤和脑肿瘤。患者既往的中位治疗线数为2线,每个患者的中位基因变异数为4个(1-20),每例肿瘤患者都有独特的基因谱。患者的临床特征总结见下表8。
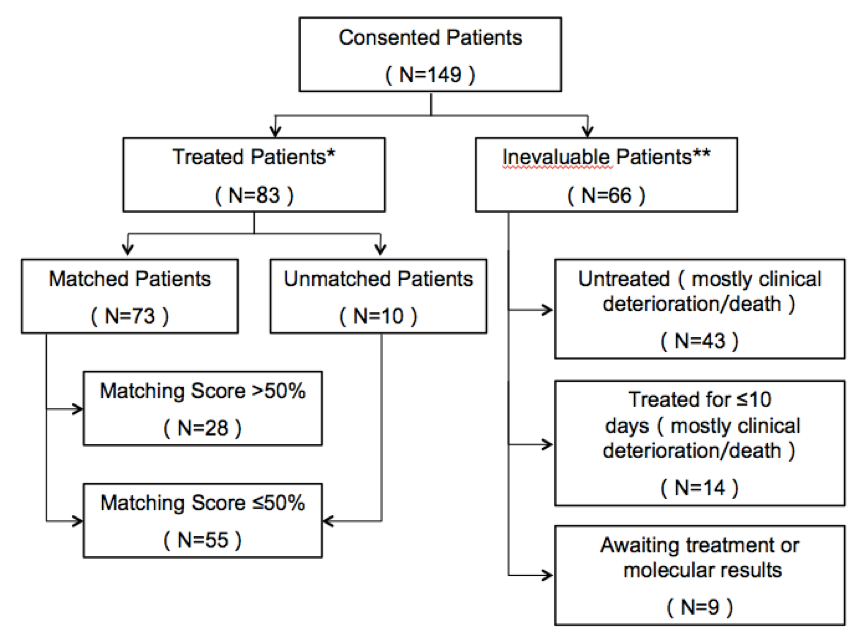
图9. 患者入组流程图
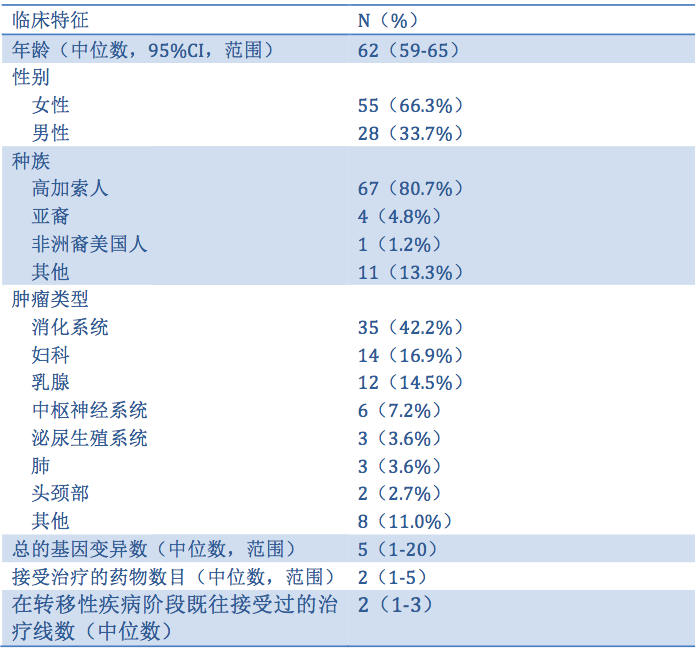
表8. 患者的临床特征
不同基因变异接受相应匹配治疗的患者比例总结见下图10。计算每位患者的分子匹配评分(定义为匹配的基因变异数/总的DNA变异数,>50%为高[n=28];<=50%为低[n=55],包括未匹配的患者,n=0)。匹配评分与患者的治疗结局显著相关:匹配评分高和低的患者CBR率分别为50%和22% (P =0.03);中位PFS 分别为6.5 vs 3.1个月,P = 0.0004;中位OS分别为未达到vs 10.2个月;P = 0.04。在73例(49.0%)接受分子匹配治疗患者中,16例(19.3%,16/73)患者经历了严重的不良事件(SAE,包括与治疗相关或不相关的)。匹配评分>50%的患者发生SAE的发生频率相比于≤50%的患者低,分别为7.1% vs 25.5%,P=0.075。
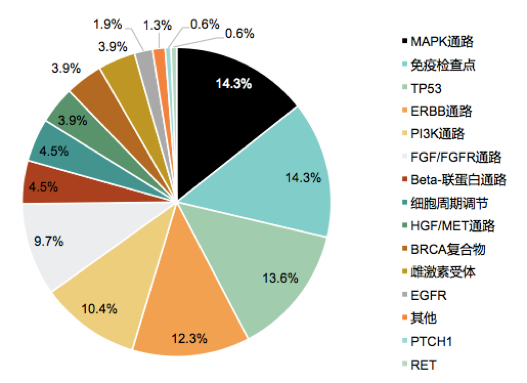
图10. 不同基因变异类型患者接受相应匹配治疗的比例
小结
本研究是第一项使用个体化,分子匹配的联合方案治疗不同肿瘤患者的研究,研究显示这一治疗模式是可行的。此外,研究还提示,分子匹配的单药通常仍不足以根本性改变这类难治性疾病最终结果,精准治疗还有很长的路要走。目前正在进行这一研究的扩展队列。
总结
晚期恶性肿瘤治疗已经由过去单纯化疗转化为精准医学指导下的化疗、靶向、免疫等多学科治疗,虽然其中一些晚期恶性肿瘤患者疗效得到了显著改善,但多数此类患者仍然缺乏有效的治疗,预后较差。上述研究采用CGP检测探寻患者潜在的治疗靶点,评估免疫治疗相关的疗效预测标志物,为患者接受潜在的靶向和免疫治疗提供重要数据。

中山大学肿瘤中心淋巴瘤首席专家
中华医学会肿瘤分会候任主任委员、肿瘤学分会淋巴瘤学组组长
中国抗癌协会化疗专业委员会常委
CSCO中国淋巴瘤联盟副主席
CSCO执行委员会常委
中国老年肿瘤专业委员会副主任委员
中国南方肿瘤临床协作组织(CSWOG)主委
广东省抗癌协会肿瘤化疗专业委员会主任委员
广东省医学会肿瘤分会主任委员
为国家自然基金评审专家、国家新药评审专家、国家医疗事故鉴定委员会委员,也是美国临床肿瘤协会(ASCO)、美国癌症研究协会(AACR)、美国血液肿瘤协会(ASH)和欧洲肿瘤学会(ESMO)会员,任多家中外期刊的副主编和编委。主要从事恶性肿瘤化学治疗、内分泌治疗和靶向治疗的临床研究和应用性研究。主持包括“863”计划、国家自然科学基金、广东省自然科学基金重点项目等多项科研基金和多项Ⅰ、Ⅱ和Ⅲ期多中心临床研究,已在专业杂志发表论文100多篇。
专家点评
在晚期恶性肿瘤的治疗中,靶向和免疫已经成为非常重要的治疗手段之一,有望改善患者的治疗结局,如何为更多的患者寻找到合适的靶向治疗,寻找免疫治疗的优势人群是当下的重要研究课题。通过CGP检测患者独特基因谱,为患者的治疗选择提供重要参考。研究一和二聚焦目前免疫检查点抑制剂公认的两个疗效预测标志物:TMB和PD-L1,研究一的结果显示,多个瘤种高TMB可能较好预测免疫治疗获益,目前正在进行相应的前瞻性研究进一步验证TMB的实际价值,为免疫治疗优化提供重要数据;研究二基于PD-L1高表达利于免疫治疗获益这一理论,探索了PD-L1的不同基因变异形式与PD-L1高表达的关系,基于这一研究数据,后续研究将从PD-L1基因检测的角度寻找免疫治疗的优势人群。研究三和四为两项前瞻性的基于患者基因突变谱匹配相应靶向治疗的研究,这两项研究的开展证实了在临床中这一管理模式是可行的,目前主要的困境在于基因变化所匹配的治疗仍然有限,以及患者靶向、免疫治疗药物的可及性较低。但可以肯定的是,基因检测匹配治疗这一模式将有利于加速靶向/免疫治疗的研究进展,最终使更多的患者从中获益。











 苏公网安备32059002004080号
苏公网安备32059002004080号


