陈功教授:各位肿瘤资讯的网友大家好,我是陈功医生,现在在2017年ESMO年会马德里会议中心给大家现场播报。
5分钟前,刚刚结束的是2017年ESMO年会上结直肠癌相关壁报讨论(Poster discussion)专场,共涉及六篇壁报,下面就此内容同各位同仁进行分享。
摘要481PD:部位只影响III期结肠癌患者而对II期患者没有影响:3项随机研究的分析
背景 虽然右半结肠与不良预后相关,但这种负性影响并没有在辅助治疗患者中得到确认。本研究分析了3项大型随机研究(SITAC-1;SMAC和TOSCA)评价II、III期结肠癌患者辅助治疗的数据结果。与此同时,由于既往研究没有有效评估横结肠癌的预后,本研究将独立分析这一部位的肿瘤。
方法 为了确认部位对预后的影响,我们分析了1987-2013年间意大利进行的3项关于辅助治疗的随机临床研究(SITAC, 5FU/FA vs 对照组, 821例; SMAC, 门静脉 5FU vs 5FU/FA, 990例; TOSCA, FOLFOX或 XELOX 3个月 vs 6个月,3513例)。根据右半、横结肠、左半结肠分析每项试验及总体人群的生存及无疾病生存。右半定义为盲肠至结肠肝曲,左半为结肠脾曲至直肠,横结肠为肝曲脾曲之间的部位。统计分析所有随机化患者可获得的预后因素。
结果 5324例患者纳入分析;2490例为男性,2834例为女性,平均年龄64岁。II期结肠癌患者2240例,III期患者3084例。肿瘤位于右半者1573例(30%),左半者2929例(55%),横结肠者822例(15%)。3项研究患者特征平衡。总体人群中,肿瘤部位对DFS没有影响(右半vs左半,HR = 1.01; 95% CI = 0.89-1.15),右半肿瘤患者OS较左半要差(HR = 1.21;95% CI = 1.05-1.40)。II期患者肿瘤部位对DFS、OS没有影响,III期患者右半结肠癌DFS、OS均较左半差(HR: 1.37 95% CI = 1.16-1.64, p < 0.001)。
结论 这是目前为止关于接受辅助化疗结肠癌患者,肿瘤部位对预后影响的最大型的研究。结果显示对于III期患者,肿瘤部位是预后影响因素,但是对II期患者则不然。
陈功教授:该研究将收入若干子研究,共计纳入5234例病人,旨在分析早期结直肠癌中原发瘤的部位是否是影响患者预后的主要因素。5234例患者,其中二期患者2240例,三期患者3084例,按其原发瘤部位不同进行分类;右半是指从回盲部到肝区,左半是从脾区到直肠,那中间的横结肠是单独列出来的一个部位。右半、横结肠、左半的比例分别是30%、15%跟55%,这一比例同之前报道是一致的。
DFS的分析结果显示,左右半风险比是1.01,组间无差异。OS的分析结果显示,左半明显较右半好,风险比1.21。那么如果DFS是一样,患者一旦转移复发,治疗以后就呈现出右半疗效不如左半。
进一步分层分析,二期当中不存在这个关系,二期当中DFS分析结果反而是左半没有右半好。作者及讨论嘉宾给出解释,有可能是在二期右半里面有更多的 dMMR或者MSI-H的病人,其预后比较好。三期和四期一样,左半比右半要好,在三期患者当中风险比1.37,P值小于0.001,说明在三期肠癌当中左半的患者比右半患者死亡风险要降低37%。
原发瘤部位肯定是一个预后因素。预后的价值在不同的分期当中不尽相同,一期二期这种预后因素被根治性手术所掩盖,而到了三期四期,原发瘤部位作为预后因素的价值变大,到晚期就更明显了。
晚期肠癌的亚组分析发现,四期肠癌当中整体来说右半不如左半,差异比较明显。但是如果能够做到R0切除,则左半跟右半的差异就没有那么明显了,说明手术完整切除这一预后因素的价值远远超过了原发瘤部位这一预后因素,当行根治性手术时,便不应再考虑原发瘤部位问题。
摘要482PD:低位直肠癌手术,机器人辅助vs腹腔镜vs经腹会阴联合切除术:单中心前瞻性随机对照试验短期疗效数据
背景 目前使用da Vinci系统机器人手术治疗直肠癌已经非常普遍。但尚缺乏临床研究数据。这项随机对照试验的目的是比较机器人辅助、腹腔镜、开放性腹会阴联合切除术(APR)治疗低位直肠癌的安全性及疗效。
方法 2013年9月至2017年3月,年龄18-75岁,肿瘤距肛缘5cm以内的低位结肠癌,临床分期T1-T3,无远处转移的患者按1:1:1随机分组,接受机器人辅助手术(RAP)、腹腔镜(LAP)或开放手术(OS)治疗。主要研究终点为术后并发症的发生率。
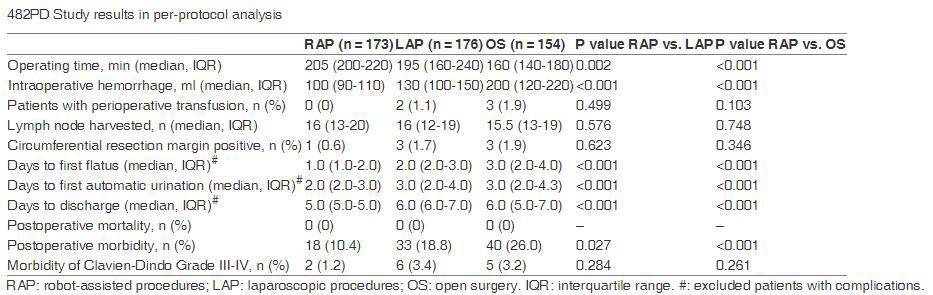
结果 共506例患者进入研究,RAP (n = 169), LAP (n = 169), OS (n = 168)。有3例患者拒绝手术治疗,最终173例完成RAP,176例完成LAP,154例完成OS(包括4例LAP中转的OS)。RAP及LAP中转开腹的发生率分别为0及2.4%,两组无统计学差异(P = 0.123)。三个研究组在肿瘤部位、大小、分型及病理TNM分期方面均无差异。术后并发症发生率,RAP(10.4%)较LAP(18.8%,P = 0.027)和OS(26.0%,P < 0.001)更低,并达到统计学差异。同时,RAP术中出血(平均100ml)也较LAP(130 ml,P < 0.001)和OS(200 ml,P < 0.001)少,并达到统计学差异。术后首次肛门排气时间RAP(1.0天)较LAP(2.0 day,P < 0.001)和OS(3.0 day,P < 0.001)更短,首次自主排尿时间RAP(2.0 day)较LAP(3.0 day,P < 0.001)和OS(3.0 day,P < 0.001)更短,住院时间RAP(5.0天)较LAP(6.0 days,P < 0.001)和OS(6.0 day,P < 0.001)更短。切缘受累情况及淋巴结采集数目各组间没有统计学差异。详情见表格。
结论 机器人辅助ARP是安全的,手术质量与传统腹腔镜及开放性手术没有差别。手术损伤更小功能恢复更快。临床研究信息:NCT1985698。
附表
陈功教授:今天的内容分为两个部分:第一部分由T. Gruenberger (Vienna, Austria)教授解读,共解读了三篇壁报。
第一篇壁报为上海中山医院许剑民教授团队的482PD - Robot-assisted vs laparoscopic vs open abdominoperineal resections for low rectal cancer: Short-term outcomes of a single-center prospective randomized controlled trial,该研究旨在探讨肿瘤距离肛门小于5公分的低位直肠癌的三种手术模式。所有手术都是腹部会阴切开术Abdomino Perineal Resection,三种模式为:
1、开腹模式;
2、常规腹腔镜模式;
3、新的机器人模式。
该大型Ⅲ期临床共计入组506例患者,每组分别是169例、169例和168例。
本次公布的是同手术相关的安全性及病理肿瘤指标等近期结果,目的是探讨新机器人模式的腹会阴联合切除术对比开腹和腹腔镜模式的安全性和近期结果。
研究者认为三种模式手术均安全可行,三组均未发生围手术期死亡,手术死亡率为0。而在手术并发症方面,机器人模式相对占优,机器人模式组术后并发症发生率是10.4%,而腹腔镜手术是18.8%,传统的开腹手术26.0%。两两比较,组间均具有显著差异,提示机器人模式在整体并发症方面更安全。进一步分层分析,严重的并发症方面组间并无统计学差异,发生率分别是1.2%、3.4%跟3.2%。
手术时间方面结果显示,开腹手术是时间最短的,中位手术时间160分钟,腹腔镜模式是195分钟,机器人模式是205分钟,还不清楚研究者在统计时是否将机器人设置的时间减去。
而手术完成到出院的时间方面,机器人模式组中位出院时间是5天,腹腔镜组跟开腹手术组都是6天,组间具有统计学差异,说明机器人模式可缩短患者出院时间。
当然除了机器人模式是否安全之外,大家还关心这一术式在病理指标方面的表现。研究结果显示环周切缘、淋巴结送检数目以及标本的完整性三个指标,三组之间没有统计学差异的。所以作者认为从近期的疗效来看,机器人模式APR手术是安全可行的,可缩短术后恢复时间,且未破坏病理指标。
现场嘉宾的点评有几点可以供大家参考的:
第一点,上海中山医院一家医院三年时间里面完成有500多例的APR,平均每年有接近170例的APR,许剑民教授介绍该中心每年大概1700例左右的手术量,10%是APR手术,这一数量让国外研究者感到震惊,也只有在中国才有可能一个单中心,能够在三年时间收集500多例有效的APR手术病例。
第二点,国内几位参会的外科医生也在探讨该研究随机后的脱落率情况,从研究结果看脱落较少。但距离肛门5公分并不是一定要做APR手术的,一般来说3公分以下基本上要做APR手术,但3到5公分之间,有一部分患者是可以做Low Anterior Resection(LAR)保肛手术。尤其在3到5公分,或者5公分左右的女性患者,不到手术的最后二三十分钟都是决定不了是要做APR手术还是LAR手术的。因为研究团队必须术前就随机入组,因此我想了解一下原来预定做APR手术的患者,事实上有多少没有做APR。
本研究是今天该专场唯一来自中国的声音,我们非常期待未来的更多的实践来验证这一术式。
摘要483PD:可切除结直肠癌肝转移(CRLM)患者围手术期化疗是否需要联合西妥昔单抗:New EPOC随机对照研究总生存(OS)数据分析
背景 2013年New EPOC研究初步数据显示,对于CRLM围手术期化疗中联合西妥昔单抗治疗会缩短无进展生存(PFS)时间。本次主要报告OS数据及新的探索性分析结果。
方法 KRAS 2号外显子野生型可切除或部分可切除CRLM患者在肝切除术前及术后随机接受化疗(CT)或化疗联合西妥昔单抗(CTX)治疗。2012年根据数据监测委员会的建议停止了西妥昔单抗组患者的招募。
结果 2007年2月-2012年11月,CT组128例,CTX组129例。中位随访时间69个月(IQR 59-81),观察到130例事件(任何原因导致的死亡)。与CT组相比,CTX组中位OS更短(p = 0.035)。与初步分析结果不一致的是,目前的成熟数据表明两组PFS没有显著差异(p = 0.291)。CTX(n = 17/83,20.5%)组较CT(n = 8/78,10.3%)组多部位进展的病例数更多,并且进展后生存(PPS)更差(p = 0.014)。预定义的亚组分析显示CTX组患者不良反应是预后良好的特征表现。CT组应答患者及无应答患者OS相同,CTX组应答患者较无应答患者OS改善。
结论 对于可切除CRLM患者围手术期治疗与CT组相比,CTX组OS更短、进展后生存更差。这种对具有良好预后特征人群的伤害性表现意味着西妥昔单抗会诱导一些患者的不良生物学行为,对他们的生物标志物检测正在进行中。与无应答患者相比,单独对CT应答没有提高OS,这意味着可以带来获益的是辅助化疗而不是新辅助化疗。临床研究信息:ISRCTN22944367。
附表
陈功教授:这项研究是曾经引起很大争议的New EPOC研究。New EPOC研究事实上在2014年底已经在《柳叶刀肿瘤学》发表过一次,今年是总生存的更新。
简单介绍一下研究背景,EPOC研究是初始可切除肠癌肝转移术前新辅助治疗标准的一个里程碑式的研究。EPOC研究证实初始可切除肠癌肝转移术前行三个月FOLFOX化疗,可使三年DFS提高了8.3%,总生存延长了8.5个月,虽然没有统计学差异,但PFS显著性延长,正是基于此研究初始可切除肝转移患者行新辅助化疗才作为标准模式来推荐。
2006年、2007年爱必妥、艾维汀等靶向药物出现后,英国专家希望在EPOC的基础上更进一步研究,FOLFOX三个月作为标准治疗,在FOLFOX三个月基础上加用三个月爱必妥就构成该研究的治疗方案,术后再来三个月的FOLFOX或FOLFOX+爱必妥。在2008年由于KRAS的发现,KRAS突变的病人就不再入组了。20%左右的病人转移瘤超过四个,77%的病人转移瘤不超过三个。
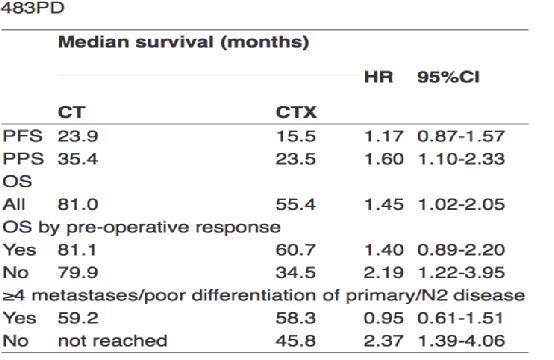
最终结果出人意料,令人大跌眼镜。主要终点PFS阴性,即FOLFOX加用爱必妥以后,PFS不但没有延长,反而P还显著的缩短,具体数据是FOLFOX+爱必妥组14.1个月对FOLFOX组22.9个月,风险比1.47,也就是说加了爱必妥以后进展的风险增加47%,有显著统计学差异。作者认为不应该联用爱必妥,这便是2014年公布的结果。当时没有报道OS的结果,今天New EPOC研究报道了更新的PFS和OS的结果,入组患者随访超过五年,但结果还是比较悲观,提示加用爱必妥并未带来收益。最后更新的PFS是15.5个月对23.9个月,风险比1.17,95%可信区间是0.87到1.57,组间无统计学差异。
更有意思的是在疾病发生进展以后,这些肝转移切除后的患者第二次进展以后的生存时间两组有显著差异。在FOLFOX组进展后的生存时间是35.4个月,而FOLFOX加爱必妥组只有23.5个月,风险比是1.60,说明加用爱必妥进展后的生存时间是缩短的,进展的风险有60%,有统计学差异。
更新的OS结果更让我们吃惊,FOLFOX组OS是81个月,FOLFOX+爱必妥组是55.4个月,风险比1.45,95%可信区间是1.02到2.05,说明加用爱必妥以后,患者的死亡风险反而增加了45%,提示爱必妥对整组病人不能带来收益。
而后续的亚组分析结果显示,预后更好的患者加用爱必妥更无法获益,而使用了爱必妥做术前化疗那组病人,一旦发生转移以后,更多的患者会出现多个部位的转移,单纯化疗组可能出现的进展往往都是仅局限在肝或者比较少部位的,作者认为有可能是加用爱必妥诱发了肿瘤生物学行为的变化。
另外还做了一个亚组分析,该研究用了三个参数评价患者的预后。1、转移瘤超过4个的;2、分化不好,3-4级分化;3、原发瘤的淋巴结N2。符合其中任何一个参数都被认为是预后不好。如果预后不好,化疗组和化疗+爱必妥组OS分别是59个月和58.3个月,风险比0.95,95%可信区间0.61到1.51,组间无统计学差异。如果没有预后不良因素的话,单纯化疗组,目前还没有达到它的中位的生存期,而化疗加爱必妥这组已经达到了,中位是45.8个月,风险比2.37,说明加用爱必妥疾病进展的风险比单纯化疗增加了2.37倍,这是我们医生所不能接受的。
对于New EPOC研究的结论有一点我们应该承认,就是该研究所纳入的77%的转移瘤不超过4个的患者不应该去用靶向药物。但是对转移瘤在五个以上的患者,我们都归为不可切除。所以New EPOC研究的结论不能完全推广到临床上所有的初始可切除的肝转移病人。从该研究的趋势来看也可以发现,随着愈后不良的因素越多,加用西妥昔单抗再配合手术应该来讲它的获益会更多。对于转移瘤数目比较少的病人可能不能获益。
2015年2月份JCO发表的一篇评论,认为两组之间手术R0切除率还有单纯手术跟射频消融使用的比例都是不均衡的,可能是单纯手术的治疗问题导致了主要的生存受损而与爱必妥无关。当然加用爱必妥会增加手术的并发症这点是肯定的。今年New EPOC的结果还是给我们很深的思考。
摘要484PD:CheckMate 142研究:接受nivolumab(Nivo)+ ipilimumab(IPI)治疗的DNA错配修复缺陷(dMMR)/高微卫星不稳定性(MSI-H)转移性结直肠癌(mCRC)患者PD-L1表达及生物标志物与临床治疗效果的相关性分析
背景 CheckMate 142研究 (NCT02060188)中,对于dMMR/MSI-H mCRC 患者NIVO + IPI显示出可控的安全性及较好的临床效果,研究组评估客观缓解率(ORR)55%,疾病控制率(DCR:CR + PR + SD ≥ 12 周)79%,提高生存(6个月时PFS 77%,OS 89%)(Andre T, et al. ASCO 2017)。本次报告CheckMate 142研究中NIVO + IPI组患者生物标志物分析结果。
方法 一线治疗进展或不耐受的dMMR/MSI-H mCRC患者给予NIVO 3 mg/kg + IPI 1 mg/kg Q3W × 4序贯NIVO 3 mg/kg Q2W治疗。Dako 28-8 pharmDx检测肿瘤PD-L1表达。细胞膜染色≥ 1%定义为阳性。根据当地指南研究者进行BRAF 及KRAS突变状况检测。是否存在林奇综合症根据临床病历记录既往病史判断。根据RECIST v1.1评价标准,研究者评估ORR。
结果 84例患者进行PD-L1表达及BRAF/KRAS状态检测。根据PD-L1表达、BRAF/KRAS突变状态及林奇综合症病史情况,患者ORR 及 DCR结果见附表。
结论 PD-L1表达和非表达的dMMR/MSI-H mCRC患者对NIVO + IPI均表现出治疗反应,对于BRAF 及 KRAS突变状态及是否存在林奇综合症病史结果也一样。以上结果与NIVO单药队列研究中生物标志物分析结果一致。临床研究信息:CA209142。
附表

陈功教授:CheckMate 142研究是关于PD-1肿瘤标志物分析的研究,该研究是尼鲁单抗的系列研究之一,旨在探索尼鲁单抗联合伊匹单抗治疗dMMR/MSI-H mCRC患者的疗效及安全性。共纳入84例患者,主要终点是客观缓解率达到55%,疾病控制率达到79%,这是非常令人振奋的。
在肺癌及黑色素瘤中PD-L1的表达是非常关键的,该研究试图分析PD-L1的表达同MSI-H患者群的关系,并判断其同BRAF/KRAS突变状态及林奇综合症的关系,结果显示:
第一、只要有MSI-H其他因素都不重要,我们来看一下具体结果。PD1如果用1%作为cut-off值,超过1%的有16个患者,那么不到1%的有50个患者。大家可以发现PD-L1的表达超过1%的,ORR达到56%,跟总体ORR是一样的。小于1%的ORR也有54%,所以一样的,疾病控制率达到75%、78%,也没有什么差别,因此PD-L1表达情况不要紧,只要有MSI-H就可以。
第二、我们再来看看BRAF突变的患者,这部分患者如果应用单纯化疗预后是非常差的,但应用免疫治疗大家可以看到,BRAF突变的21例病例,它的客观缓解率高达48%,疾病控制率76%,说明跟传统的化疗不同,BRAF突变的病人依然能够从免疫治疗当中获益。
第三、同样的KRAS突变的病人,30例病例的客观缓解率63%,疾病控制率87%,依然很高。
第四、BRAF和KRAS双野生的病人客观缓解率也达到59%,疾病控制率77%。
研究结果提示,只要有MSI-H,都能从免疫治疗当中获益。说明免疫治疗作用机制同传统化疗、靶向药物完全不同,我们应该用一种全新的思路来看待免疫治疗。如果患者有林奇综合症家族史,客观缓解率高达74%,没有则客观缓解率只有48%。如果继续深入,应该去探讨是否与MMR胚系突变相关。
摘要485PD:S-1 vs 卡培他滨对III期结直肠癌患者辅助化疗的III期、随机研究:日本临床肿瘤研究组(JCOG0910)数据更新
背景 在ASCO2015 (abstract # 3512)中,我们报告了JCOG0910二次中期分析数据(中位随访时间23.7个月),结果显示在无疾病生存DFS方面,S-1 vs 卡培他滨没有达到非劣效预期,结果已经向JCOG数据安全监测委员会公开。本次我们更新了随访数据以确认中期分析数据结果。
方法 主要入组标准为除去低位直肠癌的III期结直肠腺癌,R0且D2/3淋巴结清扫患者。患者随机接受8个周期卡培他滨(1,250 mg/m2 Bid, days 1-14,Q3w)或4个周期S-1(40 mg/m2 Bid, days 1-28,Q6w)治疗,主要研究终点DFS。计划样本量1550以达到80%效能的非劣效界值风险比(HR)1.24,单侧检验α = 0.05。
结果 共1564例患者随机化,卡培他滨组(N = 782 ),S-1组(N = 782)。3年随访期结束时,观察到所需事件发生率69%(368/535),中位随访时间4.13年,3年DFS,卡培他滨组81.7% (95% CI, 78.8-84.2%),S-1组78.3% (75.2-81.0%),HR 1.22(95% CI,1.00-1.50),非劣效检验没有达到统计学差异(P = 0.448)。3年无复发生存(RFS:复发、死亡事件),卡培他滨组84.6%,S-1组81.5%,HR 1.21 (95% CI,0.96-1.53)。3年总生存(OS),卡培他滨组96.3%,S-1组95.4%,HR 1.18 (95% CI,0.83-1.68)。亚组分析中,主要基线特征之间没有显著交互作用。
结论 本次更新的数据再次确认了S-1没有达到与卡培他滨对比的非劣效性结果。因此,在辅助治疗中,卡培他滨仍是标准治疗而不推荐S-1。临床研究信息:UMIN000003272。
陈功教授:这是来自日本的JCOG0910研究,该研究两年前在ASCO公布过主要终点。今天的内容是三年的OS主要终点的更新,三年的OS是96.3对95.4,五年OS是92.4对90.9,风险比1.19,没有统计学差异。基于这个研究,研究者自己认为目前在日本人群内,S-1在三期肠癌的辅助化疗不能被认为同卡培他滨是非劣效,即认为卡培他滨依然是三期肠癌标准的辅助化疗方案。
S-1跟卡培他滨在作用机制上是完全不同的,卡培他滨更多是走5-FU合成和代谢的途径,而S1更多是抑制其分解代谢,所以二者的优势人群有所不同,卡培他滨的优势人群是TP酶比较丰富的肿瘤,例如:乳腺癌、肠癌、胃癌等,而S-1的优势人群是DPD酶表达比较高的肿瘤患者,例如:胰腺癌,肺癌,肝癌等,这是二者的根本区别。
中国的患者也属于东亚人群,日本同道的研究是值得借鉴的,从医学的角度来讲没有证据表明S-1应该被用在三期结直肠癌的辅助化疗。
这就是今天Poster discussion的内容,虽然没有特别惊艳的研究,但每一个摘要,每一个讨论点都给我们的临床实践带来不少的思考和获益,希望国内同道能从这些研究当中得到一些启迪,更好的指导我们的临床实践,也更好的帮助中国的临床研究。
摘要LBA26:结直肠癌肝转移选择性内照射(SIRT)患者一线FOXFIRE-SIRFLOX-FOXFIRE 全球前瞻性研究:KRAS突变状态与肿瘤部位分析
背景 转移性结直肠癌(mCRC)肝脏转移不可切除患者行选择性内照射(SIRT)联合标准化疗与化疗比较,总的人群结果显示联合组无预期的生存获益,但亚组分析观察到原发肿瘤位于右半结肠的患者可从SIRT治疗获益。
SIRT治疗是将钇90标记的微球注入肝脏肿瘤供养血管,进行安全但较大剂量的放疗,从而达到控制肝转移改善mCRC总生存(OS)的目的,2002年FDA批准SIRT用于治疗化疗耐药的mCRC。
英国的Wasan教授等对3项设计相似的前瞻性随机研究(FOXFIRE、SIRFLOX和FOXFIRE-Global)进行了汇总分析,这3项研究均是评估一线SIRT联合FOLFOX±贝伐单抗治疗,共纳入1103例未经化疗且不能进行肝转移切除的mCRC患者,单纯全身治疗组共549例(对照组),全身治疗+SIRT组554例(SIRT组),排除腹水、肝硬化或门脉高压患者。主要研究终点是OS,评估KRAS突变和肿瘤部位对治疗结局的影响。
结果1:KRAS突变患者OS缩短,但二组无差别
平均随访43.3个月,对照组和SIRT组的OS和PFS无差别,不过SIRT组的客观反应率高于对照组,分别为72.2%和63.0%。
KRAS分析显示182例具有KRAS突变,279例为KRAS野生型,642例的KRAS状态未知。KRAS突变不影响二组患者的OS,KRAS状态未知患者二组的OS也无差别,不过对于所有患者而言,KRAS突变患者的OS较野生型和KRAS状态未知患者的OS降低,对照组和SIRT组KRAS突变者的中位OS分别为19.1和18.7个月,野生型分别为28.3和24.2个月,KRAS状态未知者分别为23.1和22.6个月。
结果2:右半结肠肿瘤的OS获益于SIRT治疗
亚组分析显示原发肿瘤位于右半结肠时,SIRT治疗患者的OS明显长于对照组,分别为22.0和17.1个月,而左半结肠患者的OS二组无显著差别,分别为24.6和26.6个月。以上结果与其它许多mCRC研究的结论一致,即右半肿瘤的生物学行为不同于左半,预后更差,从现有的细胞毒和靶向治疗获益较少。这项研究提出了一个新问题:SIRT是否真的能为右半肿瘤患者的生存提供获益。
结论 Wasan教授对研究作出如下总结:KRAS突变并不是预测SIRT生存获益的指标,不过原发肿瘤为右半结肠时加入SIRT治疗OS明显获益,这说明原发肿瘤部位可能能够预测SIRT治疗是否获益, KRAS突变状态则不具有预测SIRT治疗获益的作用。
这项分析为原发肿瘤部位影响mCRC治疗结果又添新证据,可能对将来按照原发肿瘤部位选择SIRT治疗提供依据,不过目前仍不推荐SIRT用于一线治疗。
陈功教授:这项研究是在英联邦,澳大利亚、英国、印度等国开展的关于SIRT( selective internal radiotherapy )选择性内放疗的前瞻性研究,简单来说就是采用了肝动脉灌注或者TACE治疗原发性肝癌的原理,经过肝动脉把很小的微球打进去,这些小微球颗粒非常小,到了肿瘤部位的毛细血管网时高度特异性地沉积起来,所有的小微球都被标记上放射性元素钇90,以形成高强度的而且高选择性的内放疗。SIRT治疗原发性肝癌早就被FDA批准了,在英联邦国家一共做了三个相似设计的前瞻性随机研究(FOXFIRE ISRCTN83867919,SIRFLOX NCT00724503 和 FOXFIRE-Global NCT01721954),共计纳入1103例患者,该系列研究旨在探讨FOLFOX+贝伐单抗标准治疗的基础上应不应该加用SIRT。
事实上这个研究的设计是有一点问题的,就是SIRT这种治疗方式只能针对肝脏,入组人群最好选用仅有肝转移的患者。但是很遗憾这三项研究里有肝外转移的患者约占40%。患者一旦有肝外转移,则说明疾病超出肝脏以外,使用SIRT治疗,很可能顾此失彼。而且因为加用SIRT之后,由于担心其毒性,全身化疗方案中奥沙利铂跟贝伐单抗的剂量都是减低的,肝脏以外的这些器官一旦存在转移,则全身化疗的剂量可能不足,这可能是研究失败的重要原因。
谢谢大家,今天播报到此结束。











 苏公网安备32059002004080号
苏公网安备32059002004080号


