晚期乳腺癌
217PD-化疗免疫的基因标记物预测新辅助蒽环类方案后的三阴性乳腺癌患者预后
背景:
对于三阴性乳腺癌(TNBC)患者,新辅助蒽环类化疗(NACT)后残余病灶中肿瘤浸润淋巴结细胞(TILs)程度与预后相关。本研究旨在从治疗前标本中检测一个基因组标记物预测NACT后TILs情况以及评估其对生存预后的预测价值。
方法:
利用LASSO技术对99个治疗前标本进行测定,我们发现一个4基因标记物可预测NACT后TILs并对其生存预后的预测价值进行评估。随后通过185名NACT后的TNBC患者进行独立验证。
结果:
该4基因标记物包括HLF、CXCL13、SULT1E1、GBP1。多因素分析发现该基因标记物表达水平升高与无远处复发生存率(DRFS)相关(HR: 0.28, 95%CI: 0.13-0.63, p = 0.0018)。独立验证组中,该4基因标记物与全组病人(HR: 0.26, 95%CI: 0.11-0.59, p = 0.0012)及残余病灶病人(HR: 0.23, 95%CI: 0.10-0.55, p = 0.0008)的DRFS显著相关。
结论:
该具有免疫活性的4基因标记物可预测NACT治疗后TNBC患者的预后。
237PD-全HER2阻断剂Poziotinib治疗≥2种HER2靶向治疗经治的HER2+转移性乳腺癌的II期试验:NOV12010-203研究结果
背景:
尽管HER2靶向治疗药物(曲妥珠单抗、帕妥株单抗、拉帕替尼、TDM-1)的引入已显著改善HER2+转移性乳腺癌(MBC)患者的预后,但大部分HER2+MBC患者最终会出现病情进展。Poziotinib是一个新型的口服全HER激酶抑制剂,通过不可逆抑制HER家族酪氨酸激酶发挥强力的抗肿瘤效果。
方法:
该研究为II期开放多中心试验,旨在评估Poziotinib于经历>2种HER2靶向治疗后出现进展的HER2+MBC患者的疗效和安全性。用药方案为poziotinib12mg一天一次,每隔7天持续用药14天。必要时可加量至16mg或根据毒性反应减量至8-10mg。主要终点是PFS,其余终点包括客观反应率(ORR)、OS及安全性。
结果:
2015.4-2016.2期间来自韩国7个医疗机构共106名患者入组。中位年龄50岁,中位4种经治抗肿瘤治疗包括中位2种HER2靶向治疗。中位随访时间为12个月。中位PFS为4.04个月。中位OS未达。疾病控制率为75.49%(77/102)包括20例PR患者。最常见的治疗相关不良事件(总/≥3级)腹泻(96.23%/14.15%)、口腔炎(92.45%/12/26%)、皮疹(63.21%/3.77%)。
结论:
Poziotinib对于难治HER2+MBC具有临床疗效。腹泻和口腔炎是导致剂量调整的主要毒副事件。我们需要分析治疗前及治疗期间肿瘤标本,探索相关生物标记物,为 poziotinib治疗HER2+mBC的临床疗效评估提供进一步依据。
238PD-紫杉醇联合曲妥珠单抗生物仿制剂PF-05280014或曲妥珠单抗一线方案治疗HER2+转移性乳腺癌的随机双盲研究。
背景:
生物仿制剂是一类与某种已获批药物高度相仿的生物产品。既往分析性的、非临床的、临床药动力学(PK)及安全性研究均表明人源单克隆抗体PF-05280014(一个具有前景的曲妥珠单抗生物仿制剂)与曲妥珠单抗相似。本次随机双盲试验旨在对比来自欧盟的曲妥珠单抗(曲妥珠单抗-EU)和PF-05280014作为HER2+转移性乳腺癌(MBC)一线治疗方案的疗效及安全性。
方法:
2014.4.4-2016.1.22期间707名HER2+MBC患者按1:1随机分配到PF-05280014组和曲妥珠单抗-EU组,两组均联合紫杉醇(起始剂量80mg/m2,D1、D8、D15,每28天为1周期)。曲妥珠单抗周疗(首次4mg/kg,随后2mg/kg),至少直至第33周,后续治疗直至疾病进展。主要终点是第25周时的影像学客观反应率(ORR)。次要终点包括安全性、肿瘤控制措施、免疫源性及PK。
结果:
PF-05280014/曲妥珠单抗-EU的ORR风险比为0.940(95%C I0.842-1.049),在预设范围内。PF-05280014组和曲妥珠单抗-EU组的1年无进展生存率和生存率分别是56%vs52%以及88.84%vs87.96%,均无统计学差异。组间不良事件发生情况无统计学差异。治疗开始后,除1名接受曲妥珠单抗-EU的病人外,其余病人的抗药抗体均为阴性。两组在第5周期第8天时药物的平均血浆峰谷浓度相似。直至2016.8.24,仍有558名患者继续本次研究。
结论:
对于HER2+MBC患者,一线PF-05280014或曲妥珠单抗-EU在疗效、安全性、免疫源性及PK均无差异。
239PD一线Dasatinib(D)联合曲妥珠单抗(T)、紫杉醇(P)治疗HER2+转移性乳腺癌(MBC)的II期试验:GEICAM/2010-04
背景:
约40%接受以T为基础治疗的HER2过表达MBC患者对治疗无应答,半数患者在一年内出现疾病进展。临床前模型显示SRC抑制剂D和T具有协同作用。本试验旨在探讨标准一线T/P方案联合D的疗效。
方法:
纳入对象为HER2+MBC患者。一线治疗方案包括每28天的T(2mg/kg/周)+P 80mg/m2(持续3周中断1周)+D 100mg/次/d直至出现影像学或临床进展(PD)或不可耐受的毒性反应。主要终点是客观反应率(ORR),次要终点包括安全性及其他疗效指标(临床获益率CBR、进展时间TTP、无进展生存率PFS)以及外周单核细胞系中(PBMCs)的药代动力生物标记物(磷酸化p-AKT和p-SRC)。
结果:
共纳入29名患者;中位年龄49岁(31-81),绝经前患者12名(41%)、ER+乳腺癌22例(76%),内脏转移23例(79.3%)。中位治疗周期数为12(1-35),有9、6、6、8名患者分别因PD、不良事件、不符合研究者/赞助商标准及其他原因终止治疗。ORR为79.3%(95% CI 60.3-92),CBR 82.8%(95% CI 64.2-94.2)。中位TTP为23.9个月(95% CI 14.9-not reached (NR)) ,中位PFS 23.9个月 (95% CI 10.3-NR)。D、T和P的中位相对剂量密度分别是98.3%、99.8%和89.7%。分别有10.3%(n=3)和24.1% (n=7)患者出现2、3级左室射血分数下降。无4级毒副事件。3级毒副事件仅限于:疲乏、高血压、中性粒细胞减少、低钠血症(均为6.9%)。在16个可评估的患者中,在第1周期的第1天使用D 8小时后PBMCs中出现磷酸化SRC和AKT水平下降(分别下降4.4和1.9倍)。
结论:
DTP方案安全有效,如临床前研究所示,使用D后可观察到PBMCs中p-SRC和p-AKT水平下降。
240PD-通过综合基因组测序探索具有CDH1突变的原发及转移性典型及多型性浸润性小叶癌内分泌治疗耐药相关的标记物
背景:
临床试验及其他科研通常没有把浸润性小叶癌(ILC)和浸润性导管癌分开研究。我们假设经典的ILC(CILC)及多型性ILC(PILC)是否具有特异的基因突变(GA)导致复发及病情反复。
方法:
从454份石蜡包埋的CDH1突变ILC标本(94%CILC和6%PILC)中连续提取出10784个浸润性乳腺癌DNA。综合基因组测序(CGP)检测315个癌症相关基因,在1.2Mbp测序DNA上测定总突变负荷(TMB)。
结果:
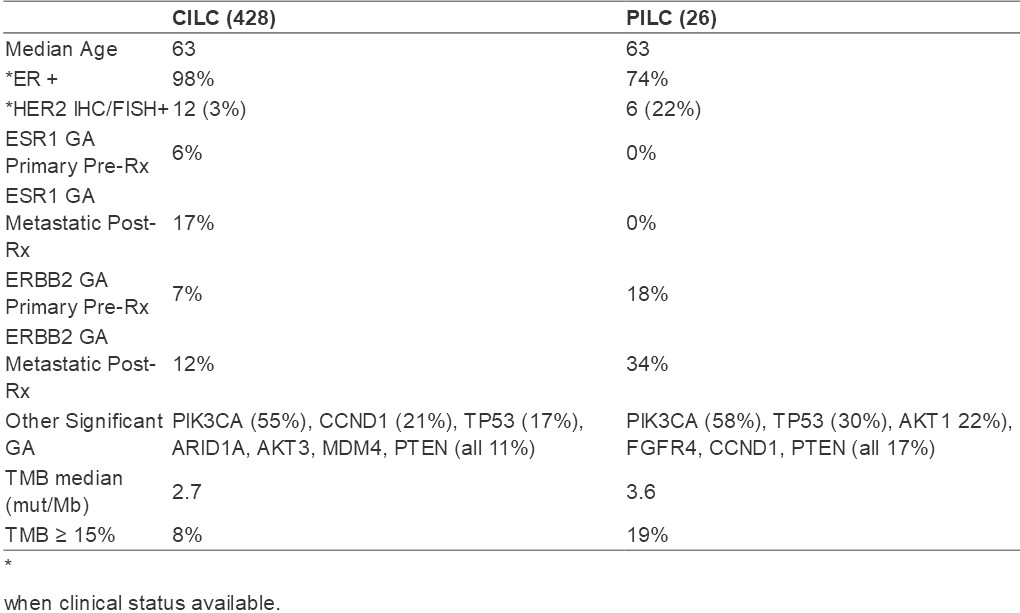
两组中位年龄差不多,为63岁。(见表)CILC组临床ER+比例较高而PILC组HER2+比例较高(P<0.0001)。CILC组ESR1 GA比例显著较高,其中与治疗前原发肿瘤相比,内分泌治疗后的转移灶中ESR1 GA 频率更高(P<0.0001)。在治疗前和治疗后的标本(均为P<0.0001)中,PILC组ERBB2 GA(扩增+无扩增)均高于CILC组。内分泌治疗后的CILC和PILC中ERBB2 GA升高约1倍。虽然两组中PIK3CA GA均为最常见,但TP53 GA更常见于PILC组。PILC组的中位TMB高于CILC组,前者的TMB≥15mut/MB发生率是后者的两倍多(P=0.046)。精准疗法对于既往治疗后出现ESR1和ERBB2 GA 的患者将会有效。
结论:
对于CILC和PILC,均可发现治疗前的原发灶和转移灶之间存在重要基因如ESR1和ERBB2突变,这可能是受原发治疗的影响。ESR1 GA常见于复发CILC而ERBB2 GA则常见于复发PILC。两组内均存在高TMB亚组,以PILC更常见,免疫治疗可能对这些病人有效。
241PD-II期随机BEECH试验评估AKT抑制剂AZD5363联合紫杉醇于ER+ve晚期或转移性乳腺癌及PIK3CA突变亚组病人中的疗效
背景:
AZD有效选择性阻断AKT1-3。体内外试验均表明PIK3CA突变增强了肿瘤对AZD的治疗敏感性。本次2期随机安慰剂对照试验(NCT01625286)旨在评估AZD联合紫杉醇周疗方案于晚期或转移性ER+ve/HER2-ve乳腺癌及PIK3CA+亚组病人中的疗效。
方法:
110名≥18岁ER+ve/HER2-ve晚期或转移性乳腺癌女性患者,出现转移后未接受过化疗,按1:1随机接受紫杉醇90mg/m2周疗+口服AZD400mg或安慰剂+紫杉醇组,AZD及安慰剂均在每次紫杉醇用药后第一天服用,每天两次,每隔3天连续4天。此外还根据PIK3CA突变情况分层(肿瘤标本中或循环肿瘤DNA中检测)。招募人数封顶确保50名PIK3CA+患者入组。每12周评估一次病情进展及肿瘤缓解情况(RECIST1.1)。主要终点是无进展生存率(PFS)。
结果:
AZD+紫杉醇组及安慰剂组的中位PFS分别为10.9个月及8.4个月(p=0.31),客观反应率为59%和57%。在PIK3CA+亚组中,研究组和安慰剂组的中位PFS分别为10.9个月和10.8个月(p=0.76)。最常见的不良事件包括腹泻(AZD76%vs.安慰剂27%)、脱发(52%vs.49%)、恶心(39%vs.24%)和贫血(33%vs.27%)。≥3级不良事件包括腹泻(24%vs.2%)、高糖血症(13%vs.0)及中性粒细胞减少(11%vs.9%)。因不良事件终止治疗发生率分别为AZD13%和安慰剂7%。
结论:
紫杉醇周疗方案加入AZD并未改善伴或不伴PIK3CA突变的ER+ve/HER2-ve晚期或转移性乳腺癌患者的PFS。
242PD-ATR抑制剂VX-970一期试验剂量联合顺铂治疗转移性三阴性乳腺癌的扩大队列研究初步结果
背景:
ATR是细胞对复制应激反应的调控因子并通过同源重组提示DNA损伤修复。许多癌症通过ATR逃逸DNA损伤。VX-970是一种有效的ATR选择性抑制剂,临床前研究发现在TNBC模型中VX-970联合DNA损伤化疗具有抗肿瘤活性。鉴于TNBC中DNA损伤修复机制缺失普遍存在,本次研究目的在扩大样本量的BRCA1/2野生型mTNBC患者队列中,评估VX-970联合顺铂的安全性和疗效。
方法:
纳入标准为既往接受过0-2次铂类方案治疗的晚期三阴性乳腺癌患者以及化疗后≥3个月后出现复发的患者。计划最多纳入50名患者,≥30名患者必须是BRCA1/2胚系野生型及基底样分子分型。治疗方案为顺铂75mg/m2,D1+VX-970 140mg/m2,D2和D9,21天为1周期。若患者对顺铂不耐受或研究者酌情更改方案为卡铂AUC=5 +VX-970 90mg/m2。
结果:
截至目前分析,共纳入35名mTNBC女性患者(中位年龄48岁)并完成≥1周期的上述研究方案。16名患者出现≥3级治疗相关不良事件:中性粒细胞减少(n=8)、贫血(n=5)、呕吐(n=4)、恶心(n=3)、血小板减少(n=1)、中性粒细胞计数下降(n=1)、血小板计数降低(n=1)、低钾血症(n=1)、全身虚弱(n=1)、僵直(n=1)、急性肾功能受损(n=1)。18名患者为BRCA1/2野生型及基底样TNBC(至少1次治疗前评估及1次治疗期间评估)。初步客观反应率为38.9%(n=7,全是部分缓解),疾病控制率(CR+PR+SD)为72.2%(n=13)。
结论:
VX-970联合顺铂治疗mTNBC疗效佳、耐受性好。本次仍在进行,后续结果将持续更新。
243PD-奥拉帕维单药对比医生选择的标准单药化疗方案治疗胚系BRCA突变的HER2阴性转移性乳腺癌疗效:OlympiAD研究进一步分析结果
背景:
III期临床试验OlympiAD研究结果显示奥拉帕维单药相比医生选择的化疗(TPC)能给BRCA胚系突变(gBRCAm)转移性乳腺癌(mBC)患者带来显著的PFS获益(7.0vs.4.2个月,P<0.001)。本研究旨在报道客观反应率、靶病灶的退缩情况及肿瘤负荷。
方法:
在肿瘤转移阶段经治化疗方案≤2种的具有gBRCAm的HER2-mBC患者(n=302)按2:1分配到奥拉帕维组(n=205;300mg,bid,po)及单药TPC组(n=97;卡培他滨、eribulin或长春瑞滨)。患者需具有≥1个可评估病灶。主要研究终点为PFS。
结果:
奥拉帕维组(CR9.0%,PR50.9%,SD≥5周25.1%,PD15.0%)及TPC组(CR1.5%,PR27.3%,SD37.9%,PD33.3%)的客观反应率(ORR)分别为59.9%和28.8%。两组靶病灶的中位最佳变化百分比分别是-45.1%和-14.8%。
结论:
奥拉帕维单药组ORR是TPC组的两倍,靶病灶体积缩小更明显,PFS更长且与肿瘤负荷及位置无关。这表明奥拉帕维对于HER2- gBRCAm mBC患者效果更显著。
244PD-来自BOLERO-4试验:依维莫司(EVE)+来曲唑(LET)治疗ER+HER2-晚期乳腺癌(ABC)的PFS亚组分析结果
背景:
BOLERO-4研究结果显示一线EVE+LET对于绝经后ER+HER2-ABC患者安全有效。预期亚组分析旨在评估<65岁vs.≥65岁、是否内脏转移、起初是否只有骨转移三个亚组的PFS。
方法:
患者口服EVE10mg/d+LET 2.5mg/d直至出现疾病进展或不可耐受的毒性反应或退出。主要研究终点是对比亚组与整体研究人群(FAS)的PFS。本次报道主要关于上述亚组的PFS数据。
结果:
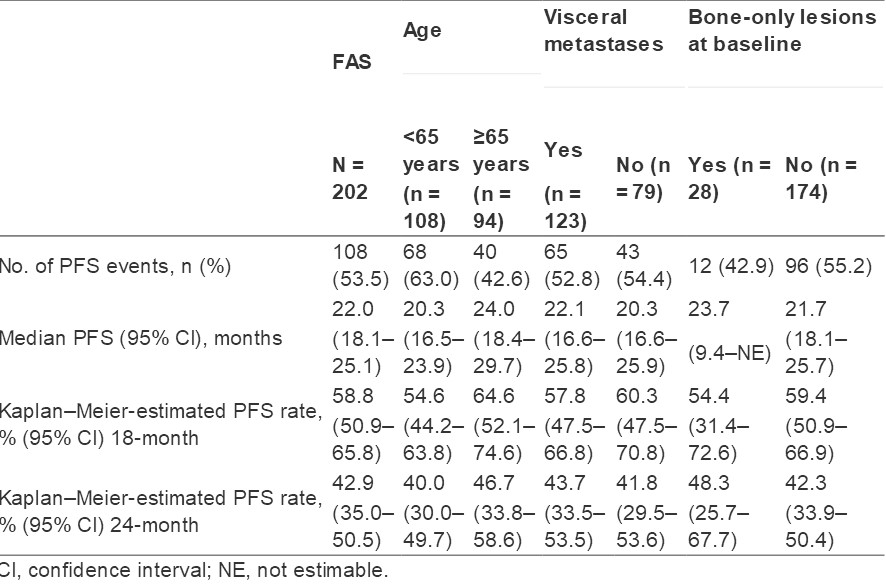
时至2016.12.17,共纳入202名患者。上述各亚组的中位PFS及18个月和24个月的PFS均与FAS的无统计学差异。(表)<65岁和≥65岁患者各级不良事件(不论病因)的发生情况及发生率均与整体人群相当。
结论:
各亚组均能通过一线EVE+LET获益,这与BOLERO-4试验整体人群分析数据相吻合。因此,对于ER+HER2-ABC患者,不论年龄、内脏转移情况或仅有骨转移,一线EVE+LET均显效。以上数据提示EVE在未来ABC治疗中可能占有重要地位。
245-PD 一线ribociclib+来曲唑于HR+HER2-绝经后患者中缩瘤及显效时长
背景:
3期临床试验MONALEESA-2研究显示ribociclib(RIB)+来曲唑(LET)可显著改善HR+HER2-晚期乳腺癌(ABC)患者的PFS。RIB获益可见于治疗后前8周。本研究报道了RIB缩瘤及显效(DoR)时长。
方法:
668名HR+HER2ABC绝经后女性患者,ABC阶段未接受过系统治疗,随机分配到RIB(600mg/d,每隔1周持续3周)+LET(持续服用2.5mg/d)组和安慰剂(PBO)+LET组。患者均具有可评估病灶或≥1个明显的溶骨性病灶。主要终点是PFS;DOR是探索性终点。在治疗后头18个月每8周评估肿瘤缓解情况。通过靶病灶最佳体积变化百分比(%)四分位数(Q)分组。若无法得知最佳体积变化百分比或肿瘤整体缓解情况为未知/PD则不被纳入分析。
结果:
501名具有可评估病灶的患者中,RIB+LET组和PBO+LET组的完全缓解率或部分缓解率分别为53%和37%。在中位随访时间为15.3个月时,两组均未达到中位DOR。443名患者的瘤缩情况可评估。除了在Q2-Q3出现的新发ABC(RIB组和PBO组分别为46%和30%)以及≤Q1出现的内脏转移(64%和84%)外,两组的基线资料基本平衡。RIB组更多患者出现靶病灶最佳体积变化百分比≥53%(表)。在头18个月的每次肿瘤缓解情况评估中,RIB组的肿瘤体积平均变化更大。
对于绝经后HR+HER2-ABC患者,一线RIB+LET不仅延长PFS,而且相对于PBO+LET更能显著缩小肿瘤。

246PD-两次4周期vs.持续8周期紫杉醇+贝伐单抗的一线化疗方案治疗转移性乳腺癌:来自丹麦乳腺癌研究组(BOOG)的Stop&Go研究
背景:
本研究为非劣效性研究,主要目的是明确对于HER2-、不可治愈的、转移性或不可切除的局部晚期乳腺癌患者,间歇性治疗方案是否不亚于持续性方案。
方法:
患者随机接受8周期或2X4周期紫杉醇+贝伐单抗(D1\8\15,每4周),贝伐单抗每21天1次直至疾病进展或出现不可耐受的毒性反应。如果间歇治疗组在起初4周期后≥3个月出现疾病进展,则增加4周期化疗。若持续治疗组在出现疾病进展或在间歇组起初4周期后3个月内出现疾病进展,则更换为二线方案。主要终点是PFS,次要终点包括OS。利用比例风险回归模型进行意向治疗分析及方案分析。双边95%CI的上限值与非劣效边界值1.34作比较。
结果:
意向治疗分析人群包括420名患者。间歇组和持续组的总中位PFS分别是10.7个月和9.7个月。两组的OS无统计学差异。方案分析结果显示组间无差异。
结论:
主次要研究终点PFS和OS并未显示一线间歇方案不亚于持续方案。因此,对于HER-不可治愈的局部晚期或转移性乳腺癌患者,一线治疗仍推荐首选持续给药方案。
早期乳腺癌
LBA9-新辅助来曲唑+palbociclib和第三代化疗方案治疗luminial型乳腺癌的对比分析:来自UNICANCER-NeoPAL研究结果
LBA10-来自II期双盲随机对照试验LORELEI的主要研究成果:新辅助来曲唑+taselisib对比来曲唑+安慰剂治疗绝经后ER+HER2早期乳腺癌患者
LBA11-WSG PlanB研究结果:复发风险评分(RS)、肿瘤分级/Ki67中央病理评估、有无蒽环类化疗方案对于临床高风险HER2-早期乳腺癌患者的预后影响
晚期乳腺癌
LBA12-基因组分析揭示局部晚期三阴性乳腺癌患者接受新辅助EGFR靶向治疗联合化疗后复发相关的生物标记物
LBA13-肿瘤周围浸润淋巴细胞水平与pembrolizumab治疗转移性三阴性乳腺癌疗效的相关性分析:来自KEYNOTE-086研究结果
LBA14-三阴性乳腺癌诱导治疗后nivolumab的非对比随机II期适应性试验:TONIC试验
LBA15-“风暴”临床队列研究探索与转移灶表型相关的遗传差异性












 苏公网安备32059002004080号
苏公网安备32059002004080号


