肿瘤促进免疫和肿瘤抑制免疫之间的平衡最终决定了肿瘤是否能够逃脱免疫识别机制。明确肿瘤本身、肿瘤微环境和在免疫系统之间的复杂关系对免疫治疗的成功实施至关重要。本综述旨在探讨肿瘤相关炎症中原癌基因的作用、局部和全身免疫抑制因子以及克服免疫赦免的免疫治疗方式。
简介
包括结直肠癌、胃癌、胰腺癌、肝胆肿瘤等的消化道肿瘤一直占据美国恶性肿瘤的前十位。针对早期肿瘤,外科手术切除仍是主流的治疗方式。但目前的治疗策略和治疗方案仍缺乏肿瘤特异性,并且因抗肿瘤药物的毒性作用限制抗癌药物的应用。
消化道微生物群与消化道肿瘤的关系
越来越多的证据显示世界范围内1/3的肿瘤与微生物感染有关。以消化道肿瘤为例,胃癌与幽门螺杆菌感染相关,胆道肿瘤与华支睾吸虫和肝吸虫相关,结肠癌与产肠毒素脆弱拟杆菌相关。
肿瘤相关炎症中原癌基因的作用
原癌基因K-ras突变在肿瘤相关炎症中发挥重要作用,突变的K-ras是启动胰腺癌相关炎症的重要驱动基因。肿瘤相关炎症是该疾病的另一特点,其效果是削弱效应细胞识别和消灭恶性肿瘤的能力。这种促癌与抑癌的平衡最终决定了肿瘤细胞逃避免疫识别的机制。
导致免疫抑制的局部与全身因素
明确肿瘤细胞、肿瘤微环境、免疫系统间的关系,对免疫治疗成功实施十分重要。尤其是基因工程动物模型的发展促进了我们对肿瘤、间质和免疫反应间关系的认识。
肿瘤细胞
肿瘤细胞通过多种途径调控免疫系统躲避效应细胞的识别。如表达免疫监测点配体PD-L1,分泌可溶性免疫免疫抑制因子TGF-β、VEGF、IL-10等;下调MHC-I的表达,上调多种生长因子受体,促进肿瘤细胞生长、转移、耐药等。
间质
胰腺癌是消化系统肿瘤中研究间质与肿瘤相互作用最具代表性的模型。这种炎症微环境间质中富含大量具有免疫调节功能的群体,包括激活的星形细胞、细胞外基质蛋白、肿瘤相关成纤维细胞等,并分泌多种肿瘤促进因子,增强肿瘤细胞的侵袭、转移、血管生成等;相应的肿瘤细胞液分泌多种蛋白酶促进间质重塑。最终导致肿瘤间质高压和关注异常,形成促进肿瘤生长、转移、生长和逃避免疫的微环境。
局部与全身免疫系统
肿瘤细胞可以分泌多种免疫调节因子直接或间接阻断CD4+或CD8+ T细胞的功能,抑制局部抗肿瘤免疫反应。
在乏氧的肿瘤微环境中,半乳凝素1的表达会升高,并诱导IL-10的产生,间接削弱IFN-γ的抗肿瘤作用。肿瘤细胞产生的吲哚2,3脱氢还原酶通过降解肿瘤微环境中的色氨酸减弱T细胞的功能。在乏氧的微环境中,多种炎性免疫细胞如树突细胞、巨噬细胞以及T细胞也通过无氧酵解途径供能,导致乳酸堆积刺激局部促炎风暴形成。其中IL-10、TGF-β等能促进TAMs(肿瘤相关巨噬细胞)由促炎性向抗炎性转变,发挥免疫抑制作用。
肿瘤细胞通还可过调变免疫检测点控制局部免疫反应,肿瘤细胞通过上调共抑制因子PD-L1(程序性死亡蛋白1配体)阻断局部T细胞增殖并减少细胞因子的产生。其中胰腺癌、结直肠癌和胃癌均有PD-L1的表达升高。
肿瘤细胞也可招募多种免疫调节细胞如Treg细胞(CD4+CD8+FOXP3+ T细胞)抑制肿瘤特异性CD4+T细胞、CD8+效应T细胞以及NK细胞。胰腺癌患者肿瘤局部和全身Treg细胞数量均增高,并且与患者预后相关。
而且肿瘤间质中的MDSCs(髓系免疫抑制细胞)也具有抑制T细胞增殖,增加T细胞凋亡的作用。这种幼稚髓系细胞对特异性免疫和非特异性免疫均有抑制作用,循环中的MDSCs细胞数量是胰腺癌患者预后的独立危险因素。
免疫治疗的模式
肿瘤疫苗在消化道肿瘤的应用
许多肿瘤疫苗或抗体的临床试验,均以在消化系统肿瘤高表达的蛋白如CEA、K-ras、BRAF、PI3K等为靶点。
表一部分已完成的免疫治疗临床试验
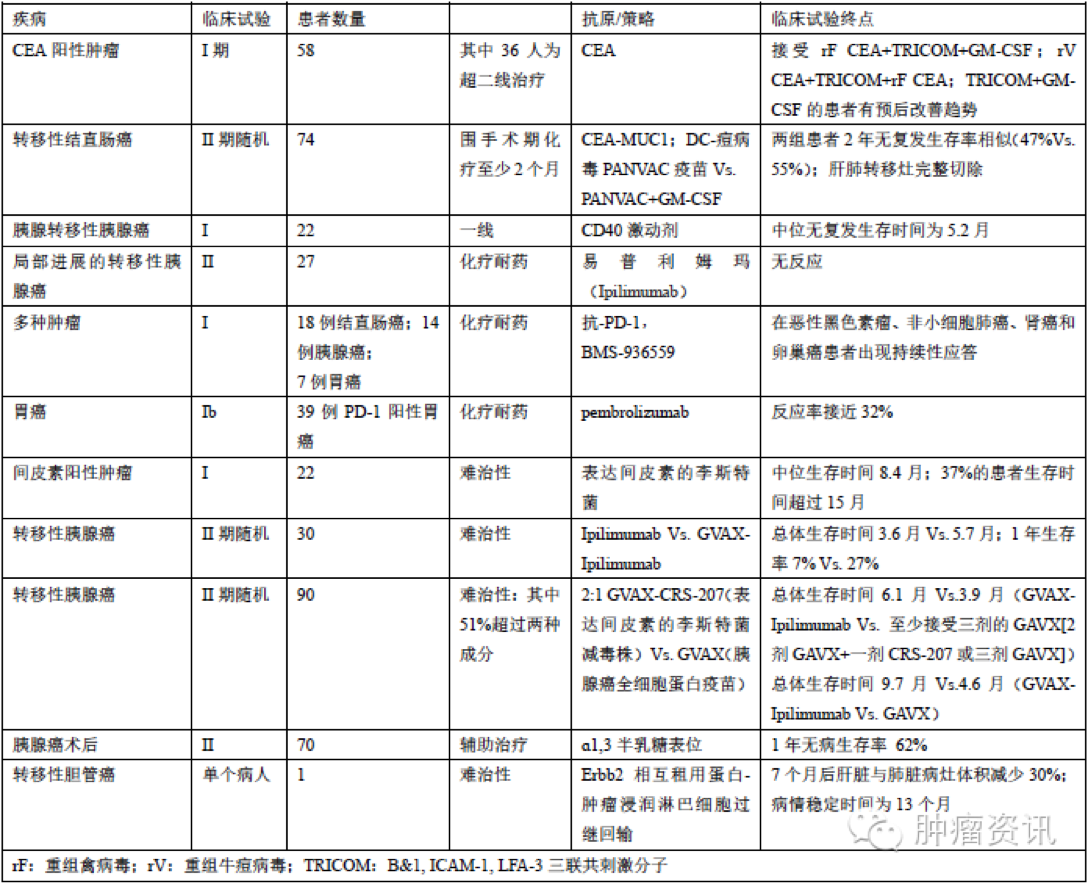
肿瘤细胞的全细胞蛋白为免疫系统提供了最全面的信息,决定哪种肿瘤抗原蛋白可以激活免疫系统发挥抗肿瘤效应。同种异体GM-CSF-GVAX最初用于胰腺癌术后放化疗的辅助治疗,许多I、II期临床研究也将其作用化疗耐药性转移胰腺癌的辅助治疗(见表一)。CRS-207(表达间皮素的李斯特菌减毒株)联合GVAX在I期临床试验中延长患者生存时间达15个月。胰腺癌术前给予患者GVAX+低剂量环磷酰胺,术后标本显示肿瘤标本中有大量淋巴细胞浸润,本试验第一次通过免疫技术将低免疫原性肿瘤转变为免疫原性肿瘤,并诱导T细胞浸润改变肿瘤微环境。其他关于GVAX、CRS-207、抗PD-1抗体搭配的临床试验也在进行中。
另一个全细胞疫苗为algenpantucel-L,来源于两株经基因工程修饰低分化胰腺癌细胞系,一项包含70名胰腺癌术后化疗联合免疫治疗的II期临床试验结果显示,高剂量肿瘤疫苗将患者的无病生存时间和总体生存时间均延长12个月。关于algenpantucel-L的另一项大的临床试验结果也即将揭晓。
免疫抗体
靶向肿瘤抗原抗体
单克隆抗体通过抗体介导的细胞毒作用、吞噬作用和补体依赖细胞毒作用等发挥抗肿瘤活性,但不经过T细胞无法产生免疫记忆是其缺点。目前FDA已批准曲妥珠单抗、雷莫芦单抗应用于胃癌;贝伐单抗、西妥昔单抗、帕尼单抗应用于结直肠癌。技术的发展,双亲和性抗体可以同时识别两个以上抗原,目前至少有同时针对结肠癌抗原gpA33和CD3T细胞受体的抗体进行的早期临床试验。
靶向共刺激分子抗体
目前的临床试验结果显示GVAX在联合增强共刺激信号或下调抑制信号的抗体时能够发挥最大抗肿瘤效果。CD40具有招募抗原递呈细胞、上调MHC、协同刺激T细胞激活的作用,应用CD40激动剂辅助治疗实体肿瘤的多项临床实验正在开展,期待有令人满意的结果出现。
靶向免疫监测点抗体
尽管抗CTLA-4(ipilimumab)和PD-1(pembrolizumab、 nivolumab)信号通路的抗体在恶性和色素瘤、肺癌、肾癌等肿瘤中得到了喜人的结果,也已通过FDA批准。但在消化系统肿瘤中却表现平平。
27名应用ipilimumab治疗晚期胰腺癌患者的II期临床实验结果显示,RECIST评估肿瘤对治疗并无反应。另一项应用PD-L1抗体BMS-936559治疗的207例实体瘤患者(18例结直肠癌、14例胰腺癌、7例胃癌)中,尽管其他肿瘤均有影像学缓解,但消化道肿瘤却无治疗反应。导致这种现象有许多原因,1)大多数消化道肿瘤并不诱导T细胞免疫,2)消化系统肿瘤中存在大量间质成分阻挡效应T细胞浸润。
因此通过诱导T细胞反应并联合免疫检测点抗体(拮抗因IFN-γ而上调的肿瘤PD-L1),来治疗消化系统肿瘤成为目前治疗的新思路。
淋巴细胞过继治疗
分离肿瘤浸润T细胞进行体外扩增培养,体外识别肿瘤抗原或转染重组DNA使T细胞靶向肿瘤抗原后重新会输到患者体内进行免疫治疗。这种治疗方式已在一例胆管细胞癌患者中成功实施,针对胰腺癌间皮素抗原的临床实验也正在进行。
前景与挑战
消化系统肿瘤免疫治疗的难点在于肿瘤、肿瘤微环境、局部与全身免疫系统复杂的相互作用关系。通过对相应肿瘤模型的研究,首先清除或抑制肿瘤间质中的免疫抑制因子;并应用相应肿瘤疫苗诱导T细胞对低免疫原性肿瘤进行反应;之后在辅助免疫检测点抗体治疗,这样可能会达免疫治疗的最大抗肿瘤效果。
但仍有许多难点需要克服,消化系统肿瘤中PD-L1阳性是否真的是应用PD-1抗体的准确指标仍待确定;免疫治疗的抗肿瘤效果的评估方法也待进一步完善;联合免疫治疗的安全性也需深入研究,对于治疗过程中肝功能或内分泌异常应参考其基线水平。克服肿瘤细胞的免疫逃逸,发展个体化免疫治疗必将在今后的研究中得以实现。
Reference:http://jco.ascopubs.org/content/early/2015/04/27/JCO.2015.60.7879.abstract
















 苏公网安备 32059002004080号
苏公网安备 32059002004080号


