新诺卡菌(Nocardia nova)是一种革兰阳性需氧放线菌,作为一种机会性致病菌,常导致免疫功能低下患者发生严重感染。虽然肺部是其主要感染部位,但在常规血培养中分离出该菌(即诺卡菌菌血症)的情况极为罕见。
本文报告一例54岁女性患者,在接受左乳癌改良根治术及化疗后,并发新诺卡菌菌血症及病毒性肺炎。患者术后两周出现高热及肺部影像学进展。初始经验性给予左氧氟沙星治疗无效。血培养及药敏试验(AST)最终证实为新诺卡菌感染。治疗方案随即调整为甲氧苄啶-磺胺甲噁唑(TMP-SMX)联合亚胺培南/西司他丁。尽管初期病情缓解,但因患者出院后未遵医嘱服药导致病情复发,需再次入院治疗。经长达六个月的规范抗生素治疗,患者最终获得完全康复。
该病例的启示在于,确诊诺卡菌病是实施有效靶向治疗的前提。此外,尽管诺卡菌菌血症发生率低,但对于存在基础疾病及免疫抑制风险的术后癌症患者,临床医师应保持高度警惕。本病例强调了血培养在早期诊断中的关键作用,以及足疗程抗生素治疗对预防复发的重要性。
诺卡菌介绍
诺卡菌属(Nocardia species)是一类广泛存在于土壤、腐烂植物及水体中的革兰阳性需氧放线菌。由于其生长缓慢,且临床常规培养耗时较长,该菌的检出率往往被低估。诺卡菌感染主要累及细胞免疫受损人群,如HIV感染者、血液恶性肿瘤患者、实体器官移植受者及长期应用糖皮质激素者。然而,近年研究表明,约18%–45%的诺卡菌病发生于免疫功能正常者。
随着分子分类学的进步,目前已知的119种诺卡菌中,有54种被证实与人类感染相关。其感染呈现地域性差异,最常见的受累部位包括肺部、中枢神经系统(CNS)及皮肤软组织。值得注意的是,诺卡菌菌血症在临床上极为罕见,仅占所有诺卡菌感染病例的1.3%至7.7%。此类患者预后较差,死亡率高达40%左右,且微生物学复发率约为5%。
在此,我们报告一例54岁女性乳腺癌患者,在改良根治术后并发罕见的新诺卡菌菌血症及呼吸道合胞病毒(RSV)肺炎。本病例旨在探讨诺卡菌在肿瘤术后患者中的致病潜力,并强调对共感染风险患者进行及时病原学诊断和规范化治疗的必要性。
病例介绍
一般情况与既往史
患者女,54岁,中国籍。因“左乳肿块进行性增大伴疼痛”入院。既往体健。本次入院前5个月,患者曾置入经外周静脉穿刺中心静脉导管(PICC)。
入院检查与手术
入院胸部CT示左乳占位性病变伴左侧腋窝多发淋巴结肿大,肺部未见明显异常。穿刺活检病理诊断为:非特殊型(NST)浸润性癌。免疫组化结果:ER (-),PR (-),HER2 (3+),Ki-67指数30%。
患者术前顺利完成新辅助化疗,方案包括:阿霉素+环磷酰胺(1周期)及卡铂+曲妥珠单抗+帕妥珠单抗(2周期),耐受性良好。随后在全身麻醉下行左乳改良根治术。
术前实验室检查:体温正常,C反应蛋白(CRP)阴性,血红蛋白 90 g/L(中度贫血),白细胞计数正常。
临床病程
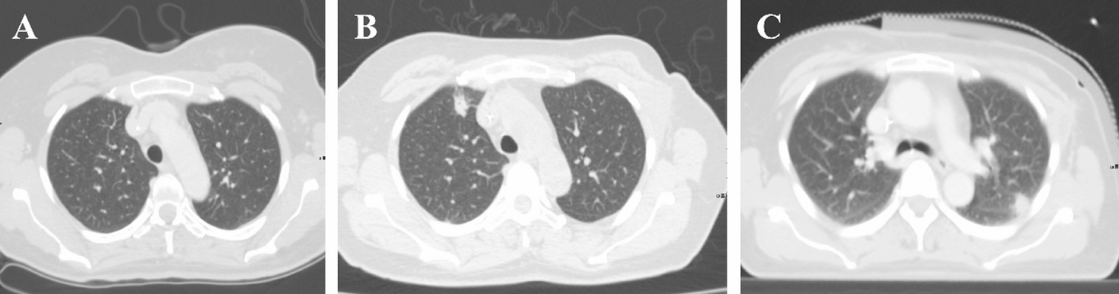
术后初期患者恢复平稳。术后第14天,患者突发高热(Tmax 39.4 °C)伴咳嗽。急查血常规示:白细胞 4.5 × 10^9/L,中性粒细胞 3.19 × 10^9/L;CRP及降钙素原(PCT)均在正常范围。给予双氯芬酸钠对症处理,热势未退。复查胸部CT示双肺多发结节状病变,提示炎症进展(图1A-B)。
辅助检查
真菌相关检测(G试验、GM试验)及结核感染T细胞检测(IGRA)均为阴性。由于实验室条件限制,未行呼吸道多重PCR检测。查体见手术切口愈合良好,引流液清亮,基本排除手术部位感染(SSI)。
微生物学诊断与初始治疗
临床初步诊断为肺部感染,经验性给予左氧氟沙星静脉滴注,并同时留取血培养(需氧/厌氧)及痰标本。
培养第4天,BD BACTEC FX系统报告需氧血培养瓶阳性。涂片革兰染色镜检示:革兰阳性、呈串珠状、细长分支丝状菌(图2A, B)。
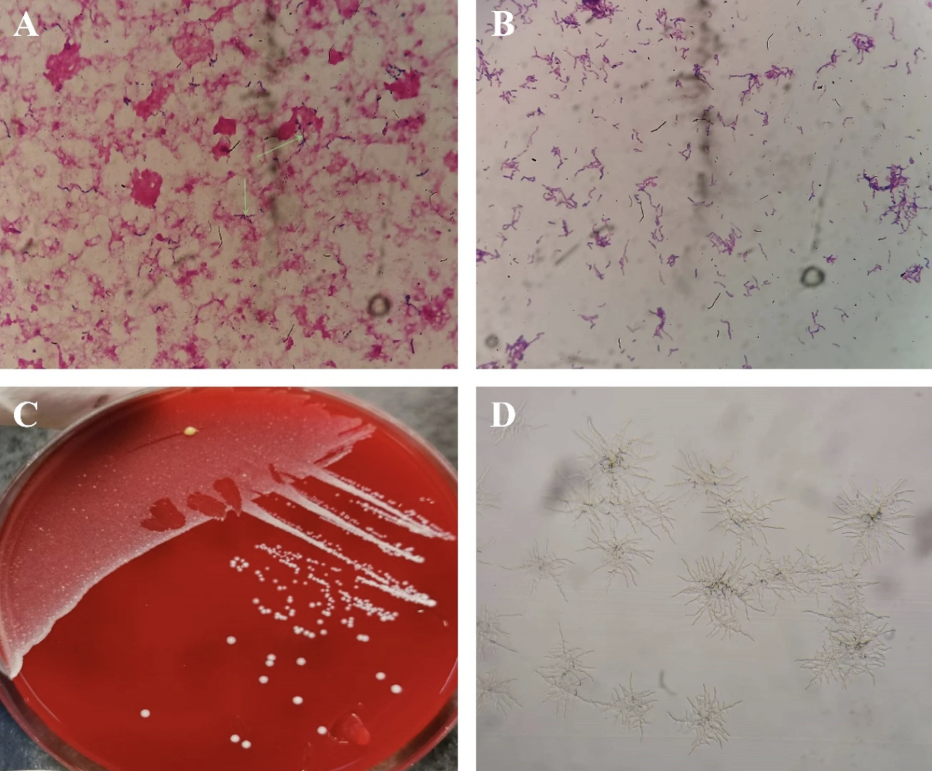
A) 血培养阳性标本的革兰染色(1000倍镜下);B) 需氧培养1天后,哥伦比亚血琼脂平板上菌落的革兰染色;
C) 需氧培养4天后,哥伦比亚血琼脂平板上新诺卡菌的生长情况;D) 需氧培养16小时后,MH琼脂平板上新诺卡菌的生长情况。
转种5%脱纤维羊血琼脂平板,菌落呈白垩状、隆起、干燥、皱缩且有凹陷(图2C)。MH琼脂平板37°C需氧培养16–24小时后,低倍镜下可见特征性气生菌丝(图2D)。
基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)最终鉴定分离株为新诺卡菌(N. nova)。同期脑脊液培养及脑部MRI均未见异常,排除中枢神经系统播散。
治疗调整与转归
基于革兰染色结果,抗生素调整为甲氧苄啶-磺胺甲噁唑(TMP-SMX,4片 q6h)。
用药2天后患者出现皮疹,考虑药物过敏,遂根据药敏结果(Sensititre RAPMYCOI MIC板)更换为亚胺培南/西司他丁。药敏结果显示该菌株对头孢曲松、利奈唑胺、TMP-SMX、亚胺培南、克拉霉素、阿米卡星敏感;对环丙沙星、阿莫西林-克拉维酸等耐药。
之后,患者症状缓解出院,医嘱带药口服利奈唑胺(600 mg, bid)。
复发与最终治愈
出院3周后,因患者依从性差未规律服药,再次因高热入院。复查血培养再次检出新诺卡菌。此外,血清学检测示呼吸道合胞病毒(RSV)IgM抗体水平升高(104.5 AU/mL),结合胸部CT左肺上叶新发结节(图1C),临床考虑由于免疫功能低下导致的新诺卡菌菌血症合并RSV感染。
再次入院后,给予联用抗组胺药物以预防过敏,患者对TMP-SMX耐受良好。经亚胺培南/西司他丁联合TMP-SMX静脉治疗两周后,病情稳定,改为口服TMP-SMX(4片 q6h)序贯治疗。患者于治疗启动后1个月出院,并继续维持口服治疗至6个月。随访至今,患者已完全康复。
讨论
本文报告了一例罕见的免疫功能低下女性发生播散性新诺卡菌(Nocardia nova)感染病例,临床表现为菌血症合并病毒性肺炎。诺卡菌病的发病率呈年龄相关性,以老年患者最高。近期来自西班牙(1,119株)和美国(1,299株)的大样本研究显示,西里亚克诺卡菌(N. cyriacigeorgica)和新诺卡菌复合群(N. nova complex)是最常见的致病菌种。然而,法国(160/793株)和中国(176/441株)的数据则呈现不同分布,以皮疽诺卡菌(N. farcinica)分离率最高(39.9%),其次为西里亚克诺卡菌(28.6%)。由于临床认识不足及诊断手段受限,诺卡菌病已成为不可忽视的公共卫生威胁。值得注意的是,虽然中国病例系列中绝大多数(7/9)菌血症由皮疽诺卡菌引起,但本例患者的病原体被证实为新诺卡菌,这与既往文献报道的某些特征存在差异。
诺卡菌病的诊断极具挑战性,这主要归因于标本采集或处理不当导致病原体难以分离培养。常规培养通常需要5至21天的长生长周期。诺卡菌病最常累及肺部,其次为播散性感染、肺外感染(常见于中枢神经系统)及皮肤软组织感染。肺部诺卡菌感染的诊断尤为困难,因为痰液或支气管肺泡灌洗液等呼吸道标本中常存在大量正常菌群,容易掩盖生长缓慢的诺卡菌。本例中,患者痰培养即为阴性。此外,若缺乏基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)和16S rRNA测序技术,菌种鉴定将更加困难。尽管如此,诺卡菌在Mueller-Hinton(MH)琼脂平板上形成肉眼可见的气生菌丝是其显著特征。临床上若革兰染色发现类放线菌样革兰阳性杆菌,结合MH平板上的气生菌丝形态,可快速提示诺卡菌感染的可能。
早期诊断是改善预后的关键。目前,诺卡菌依据其特有的“药敏模式”分为六种类型:I型(脓肿诺卡菌,N. abscessus)、II型(短链/少食诺卡菌,N. brevicatena/N. paucivorans)、III型(新诺卡菌复合群,N. nova complex)、IV型(巴西诺卡菌复合群,N. transvalensis complex)、V型(皮疽诺卡菌,N. farcinica)和VI型(西里亚克诺卡菌,N. cyriacigeorgica)。
准确的菌种鉴定及抗生素药敏试验(AST)对于制定精准治疗方案至关重要。Williams等关于菌血症的系列研究指出,新诺卡菌复合群的分离频率位居第二。新诺卡菌于1983年因其独特的耐药谱而被首次描述,并从星形诺卡菌复合群中独立出来。新诺卡菌复合群(涵盖 N. nova、N. elegans、N. veterana、N. kruczakiae 和 N. africana)通常对利奈唑胺、阿米卡星、TMP-SMX、头孢曲松、亚胺培南和克拉霉素敏感,但对环丙沙星、妥布霉素和阿莫西林-克拉维酸耐药。虽然大多数诺卡菌菌株对阿米卡星、利奈唑胺和TMP-SMX保持敏感,但其对β-内酰胺类和氟喹诺酮类抗生素的敏感性差异较大。研究表明,与金标准微量肉汤稀释法(MIC法)相比,Sensititre药敏板法操作步骤更少,且基于刃天青显色的终点判读简化了流程,具有更高的生物安全性和实验室效率。因此,本病例优先选择了Sensititre药敏板而非传统方法或Etest进行药敏检测。
尽管TMP-SMX是治疗诺卡菌病的基石,但考虑到药物过敏及潜在耐药性,常需评估替代方案。此外,TMP-SMX易引起肾功能损害和骨髓抑制等不良反应。利奈唑胺在治疗中重度诺卡菌病方面疗效确切,既往及最新研究均显示诺卡菌对其保持100%的敏感性。本例患者起初经验性使用左氧氟沙星无效,随后的AST证实该菌株对左氧氟沙星耐药,这与新诺卡菌已知的药敏类型相符。
重症诺卡菌病偶可合并真菌、分枝杆菌或病毒感染(二重感染)。患者第二次住院期间,呼吸道合胞病毒(RSV)IgM抗体持续高滴度(>100 AU/mL),胸部CT示左肺上叶新发结节,且血培养再次分离出新诺卡菌,提示存在诺卡菌菌血症与RSV肺炎的混合感染。约半数诺卡菌病患者会出现播散,尤其是向中枢神经系统播散。目前,TMP-SMX虽为首选药物,但其耐药率波动较大(4.0%–45.3%)。鉴于Etest法、纸片扩散法及微量肉汤稀释法的重现性欠佳,解读诺卡菌AST结果时应持审慎态度。
关于感染来源,患者入院时无肺部感染证据,但在乳房切除术后2周出现发热、咳嗽及影像学肺部感染征象。推测手术全麻可能加剧了化疗相关的免疫抑制状态,促使气道定植的诺卡菌进展为播散性血流感染。既往数据显示,58.9%的癌症患者诺卡菌菌血症与中心静脉导管相关。因此,本例不能完全排除手术部位或导管相关感染的可能性,尽管中心静脉导管在整个抗感染治疗期间未予拔除。
文献报道,免疫功能低下患者诺卡菌感染的病死率高达27%,免疫功能正常者为7%,而诺卡菌菌血症的死亡风险更高。尽管如此,本例免疫受损患者最终获救,这得益于以下关键因素:第一,整个病程中对诺卡菌病进行了迅速且准确的诊断;第二,初始采用口服TMP-SMX联合静脉输注亚胺培南/西司他丁的方案疗效显著;第三,患者未并发中枢神经系统感染且未出现严重的药物不良反应,从而保证了良好的临床转归。
结论
诺卡菌菌血症在临床上属罕见,血培养仍是检出该病原体的有效手段。由于诺卡菌生长缓慢,彻底根除需至少六个月的针对性抗感染治疗,因此精准的病原学鉴定对治疗成功至关重要。即使在缺乏MALDI-TOF MS(基质辅助激光解吸电离飞行时间质谱)的情况下,通过革兰染色结合Mueller-Hinton琼脂上气生菌丝的形态学观察,亦可鉴定至属水平。一旦鉴定到种,参考该菌种既往的固有药敏谱即可调整治疗方案,而无需完全依赖药敏试验结果。虽然TMP-SMX(甲氧苄啶-磺胺甲噁唑)是诺卡菌病的首选药物,但对于磺胺类药物过敏或耐药的患者,应选用替代抗生素。综上所述,早期诊断与合理的抗菌药物治疗是改善患者临床预后、确保治疗成功的关键。
Peng-Peng Tian, Li-Sha Zhu, Wen Fan, et al. Nocardia Nova bacteremia and viral pneumonia in a breast cancer patient post modified radical mastectomy: a case report. BMC Infect Dis. 2025 Oct 22;25(1):1390. doi: 10.1186/s12879-025-11837-y.
排版编辑:肿瘤资讯-slb











 苏公网安备32059002004080号
苏公网安备32059002004080号


