在激素受体阳性人类皮生长因子受体2(HER2)阴性晚期乳腺癌的治疗中,CDK4/6抑制剂耐药后的策略选择一直是临床难点。当患者在经历内分泌联合治疗、抗体药物缀合物(ADC)以及多线化疗后依然出现疾病进展,甚至发生肝、脑等多发转移时,如何精准破局?本期【PIK TALK】聚焦北京医院李超教授团队分享的一例极具挑战性的真实病例。该患者携带罕见的PIK3CA双位点突变及扩增,在多线治疗失败后,通过伊那利塞联合方案实现了深度缓解,为复杂耐药背景下的精准治疗提供了宝贵参考。同时,特邀四川省人民医院罗静教授和山西省肿瘤医院王玉教授结合该病例,从机制探索到临床决策进行深度解析,探讨这一绝地反击方案如何为多线耐药人群的个体化管理提供新的破局思路。
案例报告
初诊与辅助治疗(2021年6月-2023年10月)
患者女性,61岁。2021年7月因右侧乳腺导管浸润癌(组织学分级II级,大小2×1.8×1.5cm,淋巴结2/28阳性)行改良根治术。免疫组化提示:雌激素受体70%~80%阳性、孕激素受体40%~50%阳性、HER2零表达、Ki-67指数30%~40%,分子分型为管腔B型。
术后序贯蒽环类+环磷酰胺→紫杉类方案辅助化疗8周期及局部放疗,并于2022年5月起接受阿那曲唑辅助内分泌治疗。
晚期一至三线治疗:多线耐药与快速进展
晚期一线:2023年10月发现第5腰椎转移(无进展生存27个月),给予哌柏西利+氟维司群+地舒单抗治疗,无进展生存维持15个月。
关键转折:分子检测锁定靶点
2025年1月复查发现肝脏多发转移及多发骨转移,累及枕骨、肱骨、股骨、肩胛骨及多个椎体。团队第一时间对肝转移灶行穿刺活检及二代测序。检测显示,患者携带PIK3CA的G118D(78.3%)及Y1021C(61.4%)双突变,并伴FGFR1、JAK2、CCND1、PIK3CA扩增,以及RAD51D、BRCA1、CDK12、NF1等基因缺失。肝转移灶免疫组化出现雌激素受体阴性、孕激素受体弱阳性、HER2低表达(免疫组化2+,荧光原位杂交阴性),提示转移灶受体表型发生改变(异质、演变)。
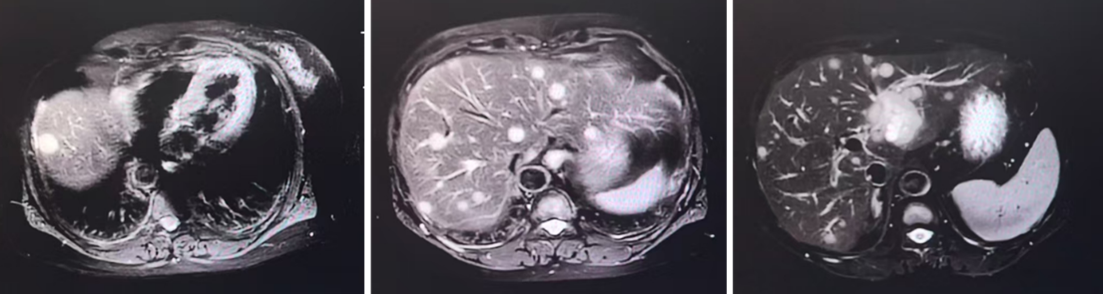
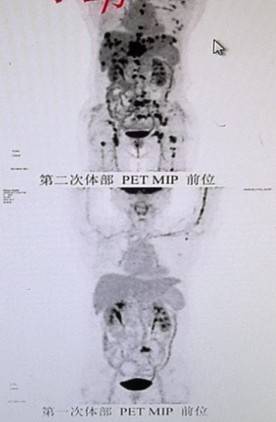
晚期二线(ADC尝试):
尽管明确了PIK3CA双突变这一强驱动机制,但因当时伊那利塞尚未可及,2025年3~4月患者随后接受德曲妥珠单抗300毫克治疗2程,但评效为疾病进展,且出现2级胃肠道反应。
晚期三线化疗:2025年4月换用紫杉醇脂质体+卡铂化疗3程,评效为稳定,但因乏力、骨髓抑制、骨痛等不良反应暂停用药。
四线精准挽救方案(2025年8月至今)
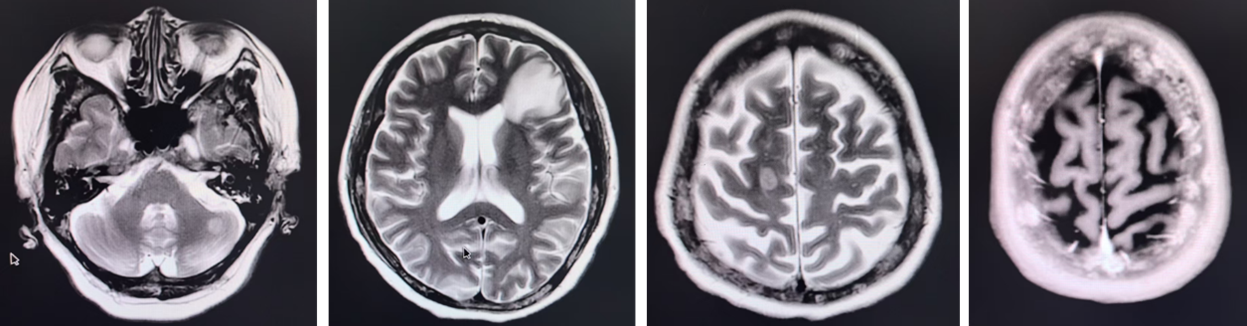
2025年8月,患者出现脑部多发转移(额叶、小脑及颅骨)。在完成颅内放疗后,基于其PIK3CA突变及扩增背景,考虑到患者基础情况较差,无法耐受化疗,且既往激素受体存在表达,参考INAVO120研究治疗模式,医疗团队果断采取联合靶向策略。
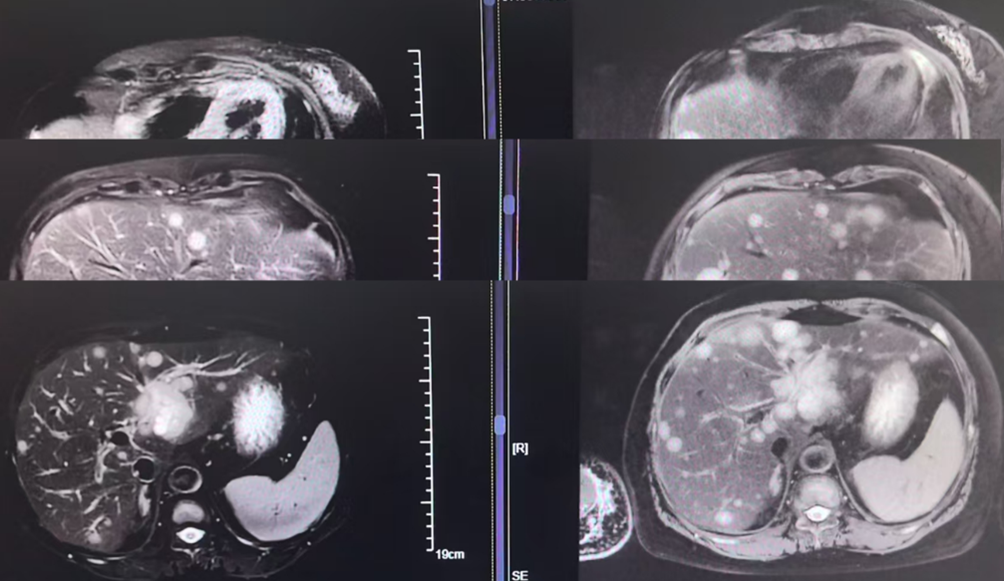
 四线方案: 阿贝西利 + 依西美坦 + 伊那利塞(Inavolisib)。
四线方案: 阿贝西利 + 依西美坦 + 伊那利塞(Inavolisib)。
疗效评估: 治疗后复查影像学,患者肝脏病灶显著缩小,评效实现部分缓解。
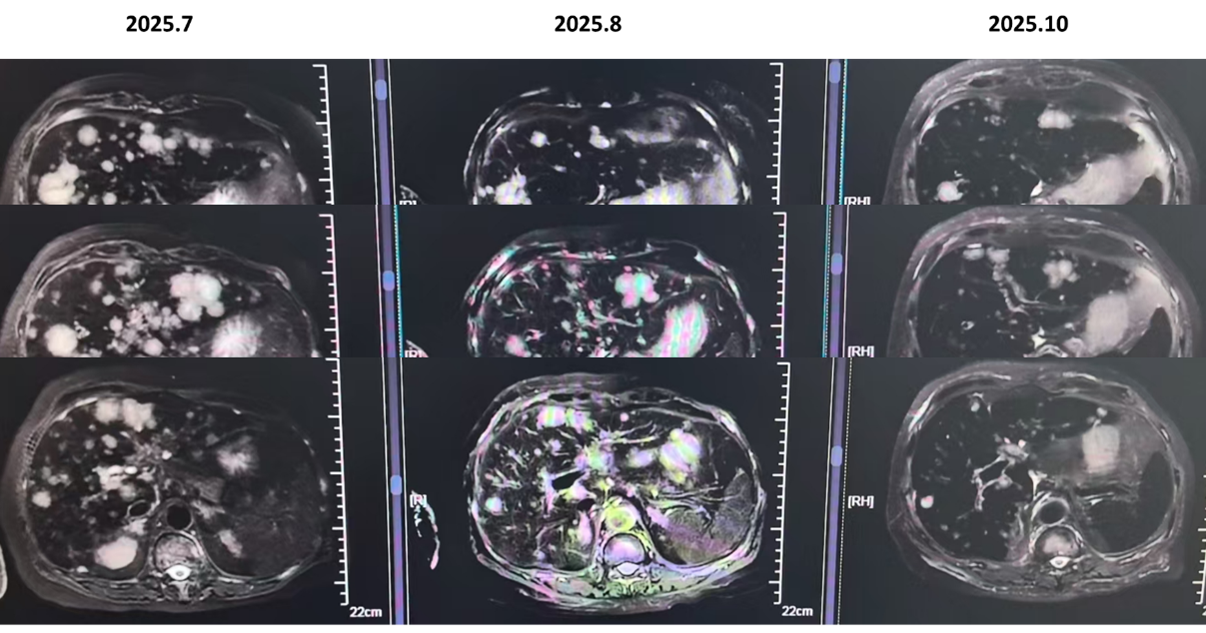 安全性管理:治疗期间出现骨髓抑制、2级血糖升高及口腔溃疡。团队通过将阿贝西利减量(从150毫克每天2次减至100毫克每天2次)及个体化调整伊那利塞剂量(3至6毫克每天1次),成功平衡了疗效与安全性。患者继续规律治疗至今。
安全性管理:治疗期间出现骨髓抑制、2级血糖升高及口腔溃疡。团队通过将阿贝西利减量(从150毫克每天2次减至100毫克每天2次)及个体化调整伊那利塞剂量(3至6毫克每天1次),成功平衡了疗效与安全性。患者继续规律治疗至今。
专家深度点评
点评专家
四川省人民医院乳腺专病中心主任,乳腺外科主任
中国临床肿瘤学会乳腺癌专家委员会委员
中国抗癌协会乳腺癌专业委员会委员
中国医师协会外科学分会乳腺外科专家组委员
四川省女医师协会乳腺疾病专委会主任委员
四川省抗癌协会乳腺癌专业委员会常务委员
四川省抗癌协会肿瘤整形专业委员会副主任委员
四川医疗卫生与健康促进会乳腺病学专委会主任委员
点评专家
山西省肿瘤医院乳腺放疗科主任
中国抗癌协会乳腺癌专业委员会常委
国家肿瘤质控中心乳腺癌专家委员会委员
山西省抗癌协会乳腺癌专业委员会主任委员
山西省乳腺癌规范诊疗与质量控制专家委员会主任委员
山西省女医师协会临床肿瘤专业委员会主任委员
北京肿瘤防治协会放疗专业委员会副主任委员
山西省抗癌协会姑息与康复专业委员会副主任委员
山西省抗癌协会肿瘤免疫专业委员会副主任委员
山西省医师协会肿瘤医师分会总干事
罗静教授:
该例患者的诊疗过程具代表性,其治疗难点在于一线CDK4/6抑制剂耐药后,肿瘤呈现出的高度侵袭性与复杂的分子演变。从生物学本质来看,该病例最显著的特征是PI3K通路的多重变异叠加。
该患者在肝转移灶的二代测序中,PIK3CA不仅检出高丰度的G118D和Y1021C双位点突变(变异比例分别高达78.3%和61.4%),还伴有PIK3CA的扩增。这种双突变+扩增的模式构成了对PI3K-AKT-mTOR通路的多重变异叠加,导致信号轴亢进,提示PI3K通路存在强驱动特征,可能与一线获益有限及后续治疗快速失效相关,是值得重点关注的生物学基础之一。
面对如此强悍的驱动因子,常规治疗难以奏效。伊那利塞作为新一代高选择性PI3Kα抑制剂,其独特之处在于双重作用机制:不仅能高选择性抑制激酶活性(对p110α的选择性是其他亚型的300倍以上),更能特异性诱导突变p110α蛋白的降解。这种从源头清除致癌蛋白的策略,使其在处理高丰度、多突变病例时更具优势。更为重要的是,伊那利塞INAVO120研究[1]展现了同类最广的位点覆盖,包括该患者涉及位点在内的62个PIK3CA突变位点。这种从源头多位点清除致癌蛋白的策略,使其在处理此类高丰度、多位点突变的难治病例时更具临床优势。

在INAVO120研究中,伊那利塞三联方案将PIK3CA突变人群的中位无进展生存从7.3个月显著延长至17.2个月,降低了58%的疾病进展风险(风险比:0.42)。即便在该例患者已出现脑转移及多脏器转移的高风险负荷下,四线应用含伊那利塞的方案仍能观察到肝脏病灶的部分缓解,这有力证明:针对PIK3CA这一核心驱动基因精准打击,是打破耐药天花板、实现晚期挽救治疗的关键。
王玉教授:
从全病程管理的视角审视本病例,其决策逻辑为激素受体阳性HER2阴性晚期乳腺癌的排兵布阵提供了三点深刻启示,尤其是在ADC失败后的靶向路径选择。
该例患者在二线治疗时虽表现为HER2低表达,但德曲妥珠单抗仅维持2程便发生疾病进展。这警示临床医生:对于伴有PIK3CA高丰度突变的患者,肿瘤可能对PI3K信号轴产生高度依赖,单纯针对HER2表型的ADC在此时可能不足以封锁其逃逸路径。这一发现再次强调了逢进展即活检的重要性,只有通过动态的基因画像,才能在经验治疗失效时锁定真凶。
四线方案采用PI3K抑制剂+CDK4/6抑制剂+芳香化酶抑制剂的三靶向联合模式,对安全性管理提出了挑战。该例患者在治疗中出现了血糖升高,这是PI3K抑制剂常见的机制相关副反应。得益于伊那利塞对α亚型的高选择性,其3~4级高血糖发生率在INAVO120研究中仅为5.6%,远低于前代药物。本案例通过及时的二甲双胍干预及个体化的剂量调整(如阿贝西利减至每天2次100毫克,伊那利塞在每天1次3至6毫克间动态调整),成功实现了患者的依从与部分缓解。
值得关注的是,该例患者在后线创新地联用了阿贝西利与伊那利塞。MORPHEUS研究已提供初步证据:伊那利塞与不同CDK4/6抑制剂(阿贝西利、瑞波西利)联用时均表现出良好的药代动力学兼容性,不存在药物间相互作用[2]。这为临床在耐药后灵活排兵布阵、构建以伊那利塞为核心的多靶点精准重构格局提供了重要依据,也为去化疗、强靶向的治疗趋势积累了宝贵的真实世界经验。
案例提供专家
北京医院肿瘤内科副主任医师
中国抗癌协会肿瘤临床化疗专业委员会委员
中国性学会乳腺病专委会委员
中国健康管理协会 乳腺健康管理分会委员
北京乳腺病防治学会 肿瘤免疫治疗专业委员会委员
北京整合医学学会个案管理工作委员会委员
北京整合医学学会中枢神经系统转移瘤多学科整合专委会委员
中西医结合学会周围血管病专业委员会委员
中国人体健康科技促进会 血管畸形及通路委员会委员
主要致力于乳腺恶性肿瘤的综合诊治
1.Jhaveri KL, Im SA, Saura C, et al. Overall Survival with Inavolisib in PIK3CA-Mutated Advanced Breast Cancer. N Engl J Med. 2025;393(2):151-161.
2.Loi S, Martin H, Oliveira M, et al. Abstract P4-07-23: Preliminary safety in the inavolisib + fulvestrant + ribociclib/abemaciclib arms of MORPHEUS-pan breast cancer: A Phase 1b/2 study of efficacy & safety of multiple treatment combinations in patients with metastatic/locally advanced breast cancer. Clin Cancer Res. 2025;31(12S):P4-07-23.
排版编辑:肿瘤资讯-XZY











 苏公网安备32059002004080号
苏公网安备32059002004080号


