整理:肿瘤资讯
来源:肿瘤资讯
多阶段达妥昔单抗β免疫策略
助力深度缓解
病例分享嘉宾

王娟 教授
中山大学肿瘤防治中心
儿童肿瘤科,副主任医师,医学博士
健康中国研究中心癌症防治专家委员会委员
广东省抗癌协会小儿肿瘤专业委员会青委会常务委员
广东省精准医学应用学会儿童肿瘤分会委员
广东省医师协会儿童安宁疗护医师分会委员
广东省精准医学应用学会生育力保护分会委员
广州市医师协会小儿外科医师分会委员
广东省医学会 儿童危重病学分会第三届委员会血液与肿瘤学组成员
以第一、共一或共通讯作者在Signal Transduction and Targeted Therapy、 Oncogene 、eClinicalMedicine、 Frontiers in Immunology等杂志发表SCI论文十余篇,多次在SIOP、SIOP-Asia、ASH、CAYA NHL等大会发言
患者资料
一般资料:女,5岁
主诉:因“确诊神经母细胞瘤2月余,外院完成2程化疗后3周”就诊。
现病史:2023年11月29日患儿无明显诱因出现发热、腹痛。当地医院CT示:左上腹膜后腹主动脉左旁一巨大肿块影(约7.2 cm×5.3 cm×8.3 cm),腹主动脉左旁及左肾上腺多个结节状软组织影,考虑神经母细胞瘤。2023年12月29日在外院行腹膜后肿物穿刺活检术,病理倾向:节细胞神经母细胞瘤。复查CT示左侧腹膜后肿块伴多发钙化,腹膜后、膈肌脚后方多发淋巴结转移,左侧髂血管旁淋巴结肿大,未除外转移。NSE: 117 ng/ml。胸骨及髂骨骨穿均见到肿瘤转移。外院骨扫描(ECT)阴性,颅脑MRI未见肿瘤转移。临床诊断:左腹膜后节细胞神经母细胞瘤(M期,高危组),MYCN(-)。2024-1-6、2024-1-27行CAV/VIP方案化疗2程,化疗后左侧腹膜后肿瘤稍缩小,评估为疾病稳定(SD);复查胸骨骨髓涂片未见肿瘤,评估为完全缓解(CR)。2024-2-18转我院继续治疗。
既往史:既往体健,否认蚕豆病、地中海贫血、先心病、先天性免疫缺陷,否认水痘、麻疹、肝炎、结核史,否认手术史,否认外伤史,否认输血史。
辅助检查
外院化疗前CT
左上腹膜后腹主动脉左旁一巨大肿块影,约7.2 ×5.3 ×8.3 cm,腹主动脉左旁及左肾上腺多个结节状软组织影,考虑神经母细胞瘤(图1)。
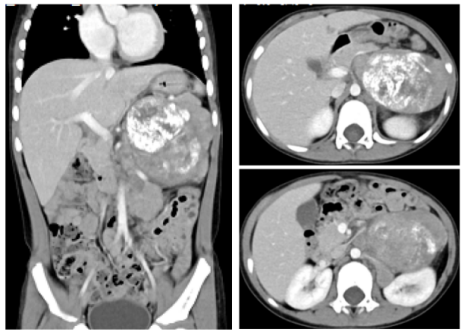
图1:外院治疗前CT
外院病理
(腹膜后穿刺物)病变倾向节细胞神经母细胞瘤,需待大体标本全面观察评估,请结合临床及影像学综合考虑(图2)。
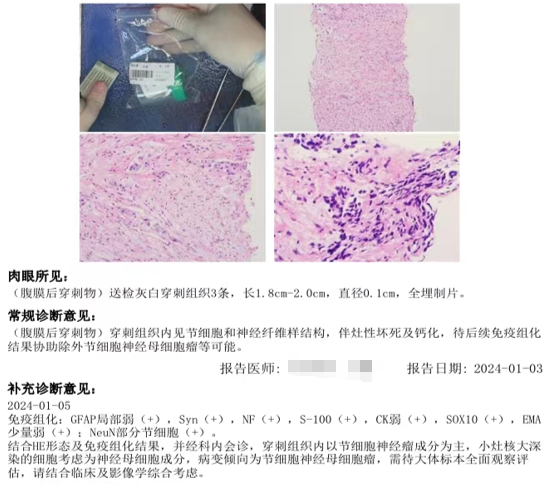
图2:病理结果
肿瘤组织NGS和分子核型分析
MYCN基因扩增阴性,未检测到ALK基因突变和扩增,未检测到胚系变异,无1p和11q缺失,无17q重复(图3)。
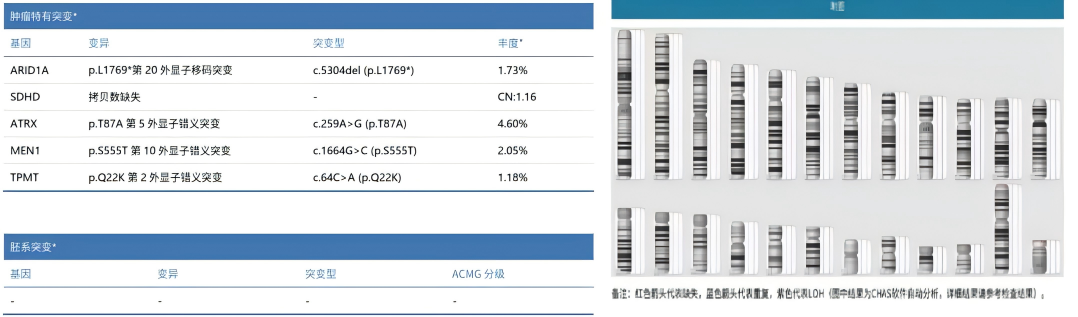
图3:肿瘤组织NGS和分子核型分析结果
双部位骨穿
左髂后骨髓涂片偶见成堆分布的转移癌细胞,符合转移癌骨髓象;胸骨骨髓涂片偶见成堆分布的转移癌细胞(图4)。
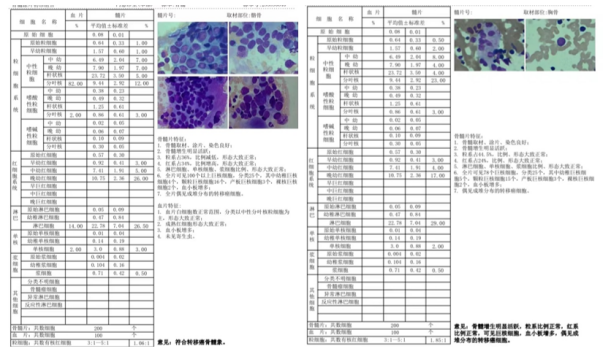
图4:治疗前双部位骨穿结果
疾病诊断
左腹膜后节细胞神经母细胞瘤(M期,高危组),MYCN(-),11q无缺失。
治疗历程
第一阶段:诱导治疗
2024-1-6、2024-1-27
在外院行CAV/VIP方案化疗2程,化疗后腹膜后病灶稳定(图5),疗效SD;胸骨骨髓涂片未见肿瘤(CR)。
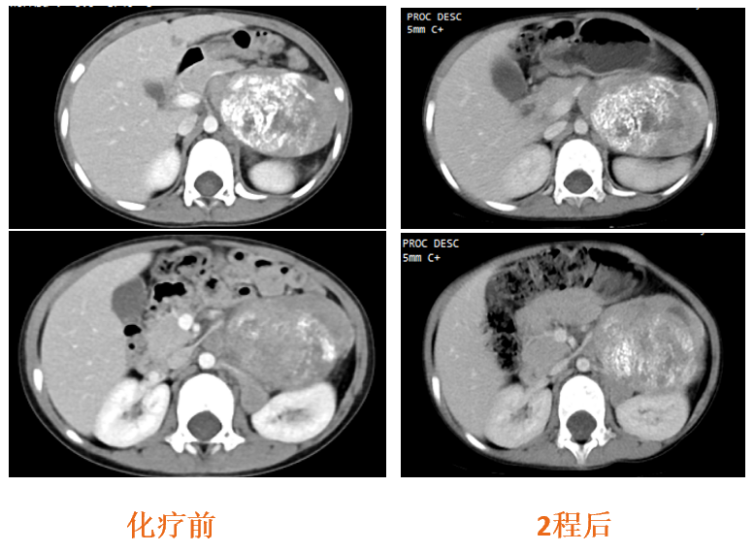
图5:治疗前及2程化疗后CT
2024-2-18
在我院行CAV方案联合达妥昔单抗β治疗1程,胸骨和髂骨骨髓涂片均CR,原发灶SD。
2024-3-18
在中山大学附属第一医院小儿外科手术切除原发灶及腹膜后淋巴结,术后病理示:考虑神经母细胞瘤分化型。
2024-3-18、2024-4-8
考虑到患儿术后体质虚弱,暂不联合抗GD2单抗,2024-3-18、2024-4-8行第4和第5程VIP、CAV方案化疗。
2024-4-11
复查腹盆CT示:左腹膜后团片状稍低密度灶,考虑术后改变(图6)。腹主动脉旁小淋巴结,盆腔未见明显异常。胸骨和髂骨骨髓涂片均未见肿瘤。
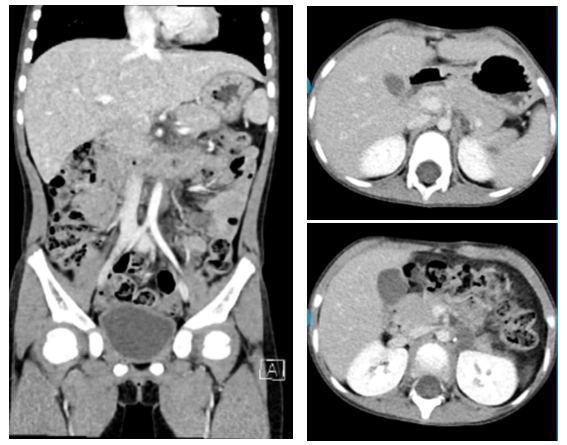
图6:术后CT
2024-4-29、2024-5-20、2024-6-12
患儿术后化疗后恢复良好,建议后续继续联合达妥昔单抗β治疗,2024-4-29、2024-5-20、2024-6-12行第6、7、8程VIP+达妥昔单抗β、CAV+达妥昔单抗β、VIP+达妥昔单抗β治疗(诱导化疗期间共联合4程达妥昔单抗β+GM-CSF,Q3W)。

图7:VIP方案联合达妥昔单抗β和GM-CSF

图8:CAV方案联合达妥昔单抗β和GM-CSF
患儿诱导治疗期间与达妥昔单抗β相关的不良反应包括疼痛、发热、过敏,反应程度轻微,耐受性良好。
诱导治疗后复查(图9):
123I-MIBG评分0分
PET/MRI阴性
双部位骨髓涂片均CR
外周血及骨髓ctDNA清零。
总体疗效评价为CR。
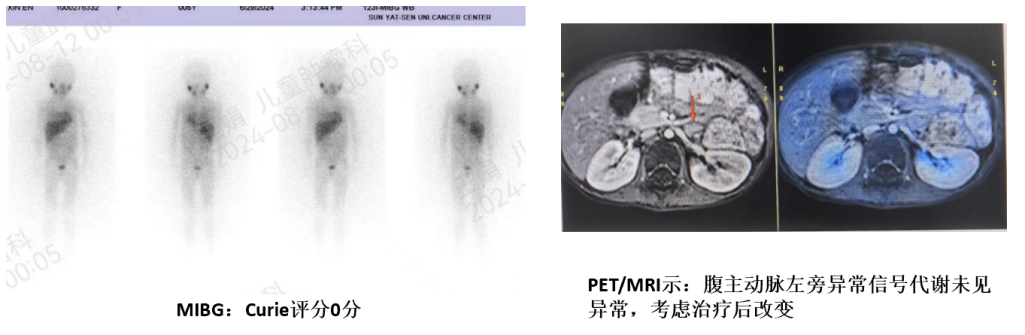
图9:诱导治疗后MIBG及PET/MRI
第二阶段:巩固治疗
2024-6-21至2024-7-19
在我院放疗科行腹部原发灶及区域淋巴结放疗,剂量21.6Gy/12f。
第三阶段:维持治疗
启动治疗前患儿疾病缓解状态为CR,脏器功能正常,体能状态评分90分。
2024-7-30至2025-2-13
行以下维持治疗方案共5程,每5周重复一次:
达妥昔单抗β:10 mg/m2/d,civ24h,d4-13
GM-CSF:250 ug/m2,s.c.,d1-14
PD-1抗体:3 mg/kg,ivdrip,d14
完成5程免疫维持治疗后患儿疾病持续缓解。
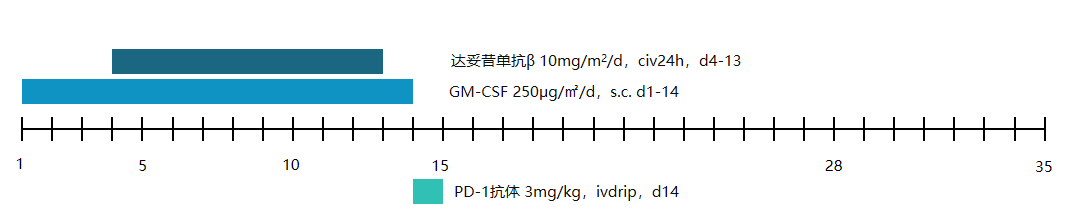
图10:维持治疗方案
2025-3-11至2025-5-29
患儿符合入组“一项脐带血自然杀伤(NK)细胞治疗儿童高危、复发/难治性神经母细胞瘤的I期临床研究”,2025年3月11日至2025年5月29日输注脐血NK细胞共8次(QW×4,Q2W×4),输注过程顺利。
随访与疗效评估
患儿完成达妥昔单抗β+GM-CSF+PD-1抗体维持治疗后定期随访。截至2026年1月6日,随访时间10个月,患者一般情况良好,复查MFBG疗效评价为持续CR。
病例点评专家

张翼鷟 教授
中山大学肿瘤防治中心
教授,主任医师,博士生导师, 博士后合作导师
儿童肿瘤科主任,神经母细胞瘤首席专家
华南肿瘤学国家重点实验室 PI,中山大学肿瘤防治中心学术委员会委员
国家卫健委儿童血液病恶性肿瘤专家委员会副主任委员
国家卫健委儿童血液病恶性肿瘤专家委员会实体肿瘤内科专委会主任委员
中国研究型医院协会儿童肿瘤专业委员会副主任委员
中国医师协会儿科分会肿瘤学组副组长
中国抗癌协会儿童肿瘤专委会常委
CSCO 中国抗淋巴瘤联盟常委
CSCO中国抗淋巴瘤联盟儿童及青少年学组 常务副组长
《中国小儿血液与肿瘤杂志》副总编辑
广东省抗癌协会小儿肿瘤专委会候任主委
广东省精准医学应用学会儿童肿瘤分会主任委员
专家点评
高危组神经母细胞瘤的标准治疗模式通常包括诱导治疗、巩固治疗及维持治疗三个阶段。研究显示,初治高危神经母细胞瘤患儿在早期治疗阶段获得良好的缓解状态,与长期预后显著相关。2018年一项纳入1242例初治高危神经母细胞瘤患儿的回顾性分析(纳入COGA3973、ANBL02P1、ANBL0532、ANBL12P1研究的患者)结果显示,诱导治疗后缓解程度达到或超过部分缓解(PR)的患儿长期生存显著提高,巩固治疗后缓解状态达到CR的患儿,接受抗GD2单抗后3年无事件生存(EFS)率可达64%,显著高于获得VGPR、PR患儿的生存,说明通过诱导治疗获得很好的缓解,可转换成患儿的生存获益。然而,研究显示,仅20.8%的患儿诱导治疗后能达到CR,这说明初治高危神经母细胞瘤诱导化疗疗效亟须进一步提高。抗GD2单抗已成为初治高危神经母细胞瘤的标准维持治疗,维持治疗应用抗GD2单抗的初治高危神经母细胞瘤患儿的5年生存能达到60%以上。那么,在诱导治疗、巩固治疗阶段中提早应用抗GD2单抗,是否能进一步提高缓解率,从而改善高危神经母细胞瘤患儿的生存呢?2022年COG的一项诱导化疗联合达妥昔单抗治疗初治高危神经母细胞瘤患儿的Ⅱ期前瞻性临床研究结果获得ASCO会议口头发言,该方案中诱导化疗的第3至第5程联合达妥昔单抗治疗,共入组42例患儿,其中38例完成诱导化疗后的评估,诱导治疗后的总体有效率为86.8%(11例CR,22例PR),与历史结果相比,诱导治疗期间联合抗GD2单抗能进一步提高缓解率。不良反应方面,与达妥昔单抗相关的不良反应主要包括发热和疼痛,耐受性良好。另外,圣裘德儿童医院也开展一项前瞻性Ⅱ期研究NB20123,入组64例患者,在诱导治疗和巩固治疗基础上联合人源化抗GD2单抗(hu14.18K322A),诱导治疗期间应用6程hu14.18K322A,巩固治疗期间在自体干细胞输注后第2天联合1程hu14.18K322A,初始47例患者在巩固治疗期间还接受了hu14.18K322A及亲代来源的自然杀伤细胞(NK细胞)治疗,结果显示:诱导治疗结束后的CR率可提高到34%,3年EFS率和OS率分别为73.7%和86%。2025年ANR会议上,圣裘德儿童医院更新了NB2012研究延长随访的生存情况,5年EFS率和OS率分别达到70.2%和85.8%,与3年EFS率和OS率接近,提示晚期复发率低。根据以上研究可以看出,在诱导治疗阶段联合抗GD2单抗可明显提高缓解率,尤其是进一步联合NK细胞输注可能进一步改善高危神经母细胞瘤患儿的生存。
本例分享的案例为初治高危组神经母细胞瘤患儿,在诱导治疗阶段联合4程达妥昔单抗β,诱导结束治疗后获得CR。为进一步提高临床疗效,在维持治疗期间探索性地采用达妥昔单抗β联合PD-1抗体的方案,共维持治疗5程,疗效持续CR。NK细胞治疗是一种新兴的免疫治疗手段,与外周血来源的NK细胞相比,脐带血NK细胞具有来源广泛、易于采集等优势,脐带血已被证明是NK细胞很有前途的无创性来源。中山大学肿瘤防治中心儿童肿瘤科正在开展“一项脐带血自然杀伤(NK)细胞治疗儿童高危、复发/难治性神经母细胞瘤的I期临床研究”(NCT06631391),本例病例符合入组条件,且自愿入组,共输注脐带血NK细胞(共8次)。截至2026年1月本例患儿已随访10个月,持续完全缓解。
诱导治疗阶段联合抗GD2单抗治疗初治高危神经母细胞瘤的循证医学证据相对较少。诱导治疗期间联合抗GD2单抗的最佳疗程数、诱导化疗联合抗GD2单抗时是否需要调整化疗剂量等临床问题,尚需进一步探索与论证。目前,诱导化疗联合抗GD2单抗治疗高危神经母细胞瘤在国内外已有多项前瞻性研究正在开展(包括本中心),期待研究结果能为抗GD2单抗在诱导治疗或巩固治疗阶段的应用提供更多循证医学证据,进一步提高高危神经母细胞瘤患儿的生存。

“码”上关注【神母菁英学院】
了解更多神母资讯~
参考文献
1、 Navin Pinto, Arlene Naranjo, Emily Hibbitts, et al. Predictors of differential response to induction therapy in high-risk neuroblastoma: A report from the Children’s Oncology Group (COG). Eur J Cancer. 2019 May: 112:66-79.
2、 Sara Michele Federico, et al. A pilot induction regimen incorporating dinutuximab and sargramostim for the treatment of newly diagnosed high-risk neuroblastoma: A report from the Children’s Oncology Group. 2022 ASCO PEDIATRIC ONCOLOGY 10003.
3、 Wayne L. Furman; Beth McCarville; Barry L. Shulkin, et al. Improved Outcome in Children With Newly Diagnosed High-Risk Neuroblastoma Treated With Chemoimmunotherapy: Updated Results of a Phase II Study Using hu14.18K322A. J Clin Oncol. 2022 Feb 1;40(4):335-344.
4、 Saulnier Sholler GL, Gerner EW, Bergendahl G, et al. A Phase I Trial of DFMO Targeting Polyamine Addiction in Patients with Relapsed/Refractory Neuroblastoma. PLoS One. 2015 May 27;10(5):e0127246.
5、 Oesterheld J, Ferguson W, Kraveka JM, et al. Eflornithine as Postimmunotherapy Maintenance in High-Risk Neuroblastoma: Externally Controlled, Propensity Score-Matched Survival Outcome Comparisons. J Clin Oncol. 2024 Jan 1;42(1):90-102.
6、 Song M, Huang Y, Hong Y, et al. PD-L1-expressing natural killer cells predict favorable prognosis and response to PD-1/PD-L1 blockade in neuroblastoma. Oncoimmunology. 2023 Dec 1;13(1):2289738.
排版编辑:Fu
责任编辑:木子李
版权归肿瘤资讯所有。欢迎个人转发分享,其他任何媒体、网站如需转载或引用本网版权所有内容,须获得授权,且在醒目位置处注明“转自:良医汇-肿瘤医生APP”。











 苏公网安备32059002004080号
苏公网安备32059002004080号


