六至七成晚期乳腺癌为激素受体阳性HER2阴性 ,病程相对较长,个体差异较大,而且肿瘤之间和肿瘤内部的差异显著。虽然内分泌治疗仍然是基石,但是几乎所有患者最终都可产生耐药,而生物学靶向药物和新型细胞毒性药物正日益成为解决该问题的手段。
2026年1月12日,影响因子全球排名第一神刊、美国癌症学会官方期刊《临床医师癌症杂志》在线发表德克萨斯大学MD安德森癌症中心和贝勒医学院的长篇综述:激素受体阳性HER2阴性晚期乳腺癌全程个体化治疗。本文总结了目前对激素受体阳性HER2阴性晚期乳腺癌的生物学机制认识,重点阐述了原发和继发耐药的机制,包括驱动基因变化,这些变化与临床因素共同指导治疗方案的选择和治疗顺序。作者详细阐述并讨论了基因组和转录组分析指导治疗选择,以及如何在决策过程中考虑副作用和患者整体体验。本文回顾了靶向治疗的最新进展,例如细胞周期蛋白依赖性激酶CDK4/6、磷脂酰肌醇激酶PI3K和蛋白质激酶AKT抑制剂,以及新一代雌激素受体降解剂,同时还探讨了抗体缀合药物和生物学标志物指导肿瘤非特异性生物治疗的日益广泛作用。作者还探讨了不断发展的生物学概念,包括肿瘤微环境对耐药和疾病进展的影响,并分析了乳腺小叶浸润癌独特的临床表现和当前的治疗方法。来自当代临床试验的新数据,有望改进临床和生物学标志物指导下的工作步骤,并改善激素受体阳性HER2阴性晚期乳腺癌患者的结局。持续的多组学研究和适应性临床策略,对于进一步应用精准肿瘤学治疗这种最常见的晚期乳腺癌亚型至关重要。重要的是,患者报告结局、共同决策和真实世界证据,对制定综合治疗计划、指南和政策发挥着越来越重要的作用。现代治疗格局的特点是采用个体化方法,将临床特征、生物学标志物和患者意愿,贯穿于疾病的整个过程。
以动态的精准策略,驾驭HER2阴性
激素受体阳性晚期乳腺癌的漫长征途
激素受体阳性HER2阴性乳腺癌是晚期乳腺癌最常见的亚型,其病程虽然相对漫长,但是异质性强,且几乎对所有内分泌治疗最终都可产生耐药。德克萨斯大学MD安德森癌症中心和贝勒医学院的长篇综述对该领域从生物学机制到临床实践的最新进展进行了系统梳理,其核心思想可概括为:治疗策略必须从一成不变的固定顺序,转变为与时俱进的动态精准模式。这要求我们如同经验丰富的舵手,根据航海图(生物学标志物)和洋流变化(耐药机制演变),在整个疾病航程中不断调整航向。
一、基石与挑战:理解内分泌耐药的内在机制
内分泌治疗是激素受体阳性晚期乳腺癌的基石,但是其疗效受到原发或继发耐药的严峻挑战。理解耐药机制,是实施精准治疗的第一步。
耐药的定义与临床意义 :临床上,我们将早期乳腺癌术后内分泌治疗2年内复发,或晚期乳腺癌一线内分泌治疗6个月内进展,定义为原发耐药;而将早期乳腺癌术后2年内分泌治疗结束后12个月内复发,或晚期乳腺癌一线内分泌治疗6个月后进展,定义为继发耐药。这种区分并非文字游戏,而是直接关联到不同的生物学表现和后续治疗选择。通常,继发耐药(尤其是停药后较长时间复发)患者对后续内分泌治疗仍然可能有效。
耐药的核心驱动机制:肿瘤细胞通过多种狡猾的途径逃脱内分泌药物的控制。
雌激素受体通路的自身叛变:最经典的机制是ESR1基因突变,这好比锁芯(雌激素受体)发生变形,即使没有钥匙(雌激素)也能持续打开生长信号传导通路。这类突变常见于用过芳香化酶抑制剂治疗的患者,是换用选择性雌激素受体降解剂(如艾拉司群、伊鲁司群)的强指征。
旁路信号的激活:当雌激素受体主通路被阻断,肿瘤细胞可激活其他信号通路作为备用引擎继续驱动生长。其中, PI3K-AKT-mTOR 通路是最重要的旁路之一。PIK3CA、AKT1等基因的激活突变,以及PTEN基因的失活,都可导致该通路过度活跃。
细胞周期的调节失控:CDK4/6抑制剂(如 哌柏西利、瑞波西利、阿贝西利 )的成功,印证了靶向细胞周期的重要性,但是其耐药常与 RB1 基因缺失或突变相关。RB1蛋白是细胞周期的刹车,一旦失灵,CDK4/6抑制剂就难以发挥作用。
肿瘤微环境的助纣为虐:肿瘤周围基质细胞、免疫细胞等构成的微环境,通过分泌各种因子,为肿瘤细胞提供庇护所,促进其存活和耐药。这对激素受体阳性乳腺癌虽然不如三阴性乳腺癌的作用突出,但是日益受到重视。
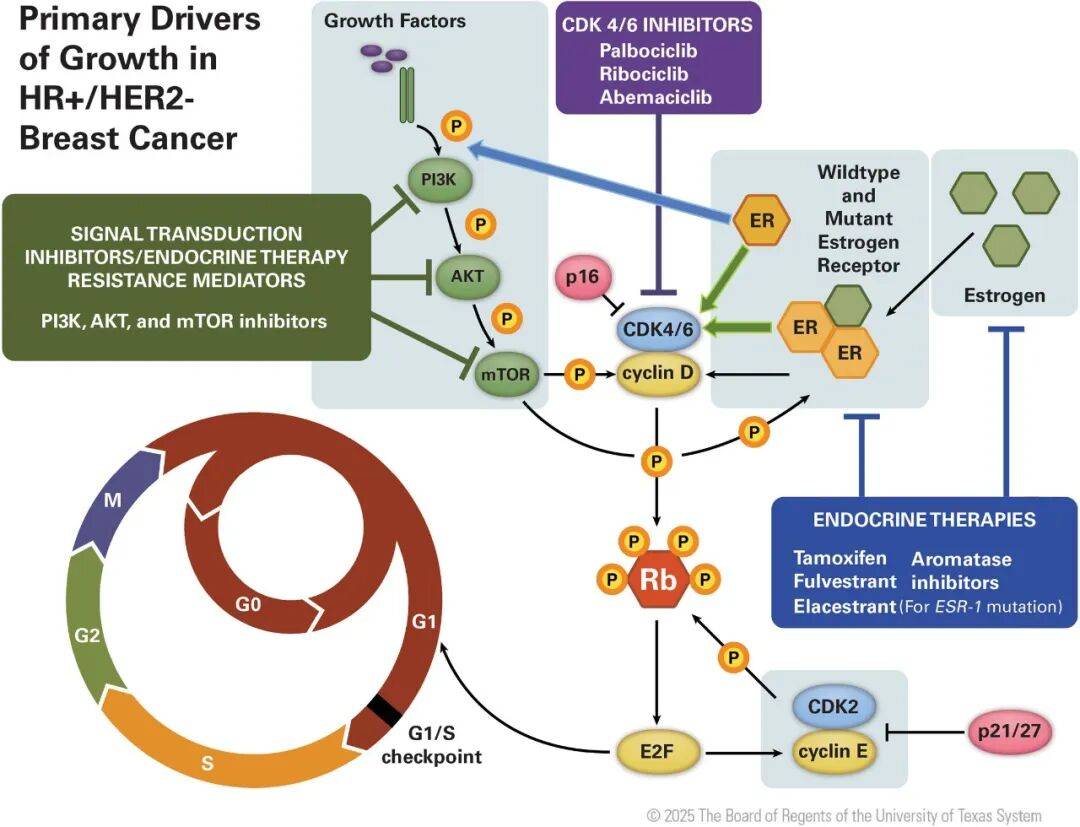
二、 治疗征途中的导航仪 :生物学标志物驱动的决策路径
该综述为我们描绘了清晰的生物学标志物指导治疗路线图,其精髓在于每次治疗决策点,都应该基于最新的肿瘤生物学检测结果。
一线治疗的金标准与个体化考量:
标准方案:对于绝大多数新发或复发的新诊断晚期乳腺癌患者,内分泌治疗联合CDK4/6抑制剂是无可争议的一线标准方案。多项三期临床研究(如PALOMA-2、MONALEESA-2、MONARCH-3)一致证实,联合治疗相比单用内分泌治疗,能够显著提高无进展生存率。
SONIA研究的启示与个体化选择:不过,近年公布的SONIA研究提出值得深思的问题:是将CDK4/6抑制剂用于一线,还是保留至二线?该研究表明,两组患者的第二次疾病进展时间相似。这意味着,对于肿瘤负荷低、疾病进展缓慢的患者,将CDK4/6抑制剂推迟至二线,可以减轻前期治疗毒性和经济负担。因此,决策应该根据医患共享,综合考虑肿瘤负荷、症状、患者对毒副作用的耐受度及经济因素。对于高负荷、有症状或恶性程度高的肿瘤,一线联合治疗仍是首选。
一线进展后的分水岭:疾病进展后,治疗选择呈现树枝状分化,关键在于再次活检(组织或液体活检)获取的分子信息。
PI3K通路突变:如果检测到PIK3CA突变,那么PI3K抑制剂 阿吡利塞 联合氟维司群或AKT抑制剂卡匹色替联合氟维司群是重要选择。尤其值得注意的是,对于在术后内分泌治疗期间或结束后12个月内复发的内分泌耐药患者, INAVO120 研究表明,新型PI3K抑制剂 伊那利塞 联合哌柏西利和氟维司群一线治疗,相比对照组展现巨大的生存优势,这为高风险患者提供了更前沿的一线强化方案。
ESR1突变:对于继发耐药患者,ESR1突变十分常见。 EMERALD 研究奠定了 艾拉司群 作为首个口服雌激素受体降解剂的地位,对ESR1突变患者疗效显著优于标准内分泌治疗。此外, 伊鲁司群 等新型雌激素受体降解剂也显示出良好前景。
种系BRCA突变:对于种系BRCA突变患者,PARP抑制剂(如 奥拉帕利、他拉唑帕利 )是高效的靶向治疗选择。
HER2低表达:这是全新概念,即使肿瘤被定义为HER2阴性,只要免疫组化显示1+或2+但是原位杂交阴性,抗体缀合药物 德曲妥珠单抗 与化疗相比,能够显著提高生存率, DESTINY-Breast04 研究彻底改变了这类患者的治疗格局。
无明确靶点 :对于不伴上述可治疗突变的患者,可选择 氟维司群 联合mTOR抑制剂 依维莫司 ,或根据情况选用其他抗体缀合药物(如 戈沙妥珠单抗、 德达博妥单抗 )或单药化疗。
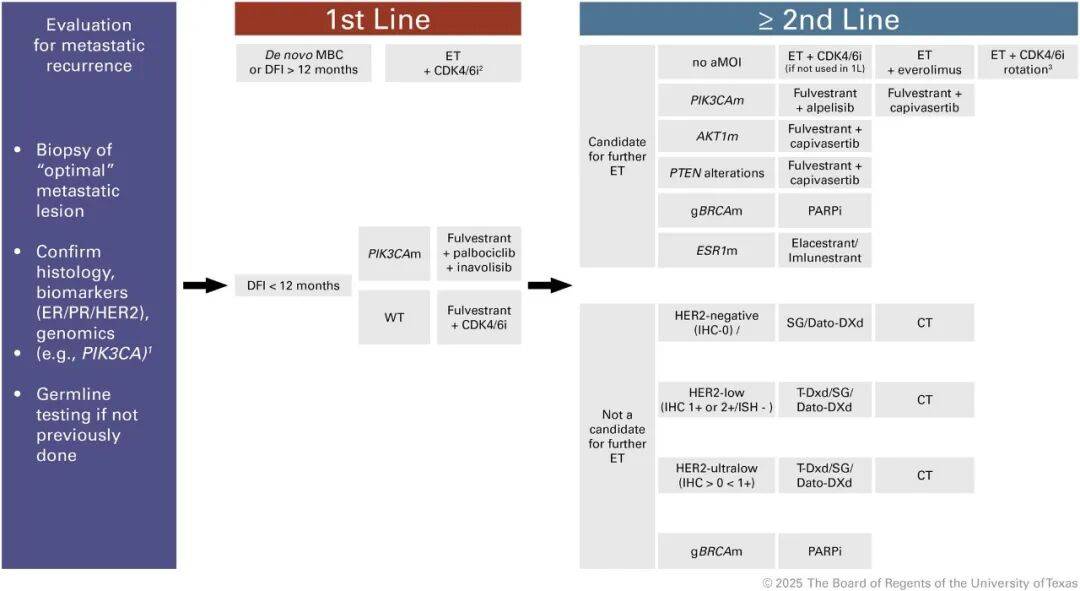
三、前沿与展望:动态监测与未来方向
该综述还强调了几个关键的未来方向:
液态活检与动态监测:循环肿瘤DNA检测技术使我们能够像雷达一样实时监控肿瘤的分子演变。PADA-1研究就是其中典范,该研究结果表明,对于芳香化酶抑制剂联合哌柏西利治疗患者,如果循环肿瘤DNA检测到新发的ESR1突变但影像学未进展,此时提前换用氟维司群,能够显著提高无进展生存率,这标志着治疗模式从等待临床进展向提前分子干预的转变。
新型药物层出不穷:新一代口服雌激素受体降解剂卡米司群、蛋白质降解靶向嵌合体韦普司群、CDK4/6抑制剂耐药后CDK2激活抑制剂、PI3K和mTOR双靶点抑制剂吉达利塞等,都被临床试验展现出克服耐药的潜力。
关注患者报告结局:现代肿瘤治疗不仅追求患者生存时间延长,更注重生活质量。将患者的主观感受(如症状、生活质量)纳入疗效评价和治疗决策,是实现真正以患者为中心个体化治疗不可或缺的一环。
结语
激素受体阳性HER2阴性晚期乳腺癌治疗已经进入充满希望的精准时代,其核心策略可总结为:以内分泌治疗为基石,CDK4/6抑制剂为首要强化手段;进展后务必根据分子分型进行分流,精准打击 PI3K、ESR1、BRCA 等关键靶点;积极采用 抗体缀合药物 等新型武器。作为临床医生,我们的职责如同战略家,要充分理解乳腺癌的生物学本质,利用好现有的武器库,并通过动态的分子监测,为每位患者在其疾病征途的每个阶段,制定出最合理、最个体化的治疗方案。这条路还很长,但是方向已经无比清晰。
对此,哈佛大学医学院德纳法伯癌症研究所、罗切斯特大学医学中心威尔莫特癌症研究所发表同期社论:激素受体阳性晚期乳腺癌精准治疗取得长足进步还是原地踏步?
激素受体阳性HER2阴性晚期乳腺癌是最常见的晚期乳腺癌亚型,虽然内分泌治疗和靶向治疗的进展改善了患者的结局,但是耐药和疾病进展仍然身份常见,而且现有治疗方案的最佳顺序尚不明确。本期综述提出了激素受体阳性HER2阴性晚期乳腺癌患者的管理框架,描述了相关领域知识空白以及精准肿瘤学工具(例如肿瘤组织或循环肿瘤DNA基因组分析)对治疗选择日益重要的作用。该综述还描述了改善患者结局的内分泌治疗和靶向治疗进展。
正如文章所述,近十年来,激素受体阳性晚期乳腺癌的治疗取得两项重大进展:首先是CDK4/6抑制剂的获批;其次是肿瘤组织和循环肿瘤DNA基因组分析被日益广泛用于治疗选择,这主要由于新型分子靶向治疗药物获批。对雌激素受体通路及其下游细胞周期调控作用的深入理解,促成CDK4/6抑制剂与内分泌治疗联合用药的研发和获批。这些新型药物的引入,显著提高了患者的无进展生存率,并且对许多患者也提高了总生存率,使其成为激素受体阳性晚期乳腺癌治疗领域最重大的进展之一。不过,部分患者接受这些治疗早期即出现疾病进展,正如文章所述,目前尚不明确是否任何患者都需要在一线治疗加入CDK4/6抑制剂。为了提高治疗的精准性,我们需要开发生物学标志物,以帮助识别那些对CDK4/6抑制剂原发耐药的患者,以及那些一线治疗可以安全免用CDK4/6抑制剂的患者。
近年来的重大转变是常规整合了新一代测序技术进行基因组和分子特征分析,包括肿瘤组织和循环肿瘤DNA分析。这些工具能够深入了解继发耐药机制,指导靶向治疗的选择,并且最新数据表明,在临床或影像检查发现疾病进展之前,根据基因组变化而进行适应性治疗调整,可以改善患者结局。
新一代测序已经成为评价激素受体阳性HER2阴性晚期乳腺癌的标准方法,尤其适用于CDK4/6抑制剂治疗后疾病进展的患者,或术后内分泌治疗期间或治疗结束后不久肿瘤进展的患者。大约40%的芳香化酶抑制剂治疗后患者检测到ESR1突变,该突变具有直接的治疗意义,可指导选择性口服雌激素受体降解剂的选择,尤其是艾拉司群和伊鲁司群。PIK3CA突变测定使临床医生能够提供PI3K和AKT通路抑制剂,例如伊那利塞和卡匹色替。重要的是,新一代测序结果是动态变化的,因为激素受体阳性HER2阴性乳腺癌治疗后可发生变化,患者通常可对定期分子检测获益,可识别继发潜在靶向突变;不过,每隔多久检测尚不明确。目前,仅当检测结果可能有助于选择治疗方案时才有指征。对于部分患者,即使分子数据无法直接确定最佳治疗方案,也能完善决策框架。例如,芳香化酶抑制剂治疗进展后未检测到ESR1突变,那么提示患者可能持续存在内分泌敏感性。相反,转移肿瘤突变负荷高可能有助于识别更易对免疫治疗有效的患者。
循环肿瘤DNA分析技术的发展提高了疾病全程反复分子谱分析的可行性。液体活检能够无创检测新出现的耐药突变,有时甚至早于影像检查或临床发现进展前数月,这为更早进行干预提供了可能。PADA-1和SERENA-6研究表明,循环肿瘤DNA检测到ESR1突变时,无需临床或影像学证据,将芳香化酶抑制剂更换为选择性口服雌激素受体降解剂,即可延长无进展生存。不过,这些疗效能否转化为总生存延长,还需要长期随访。尽管如此,这些研究代表了分子适应性治疗理念的转变,但是最佳时机和适用于临床常规应用的合适临床终点仍然处于积极研究之中。需要进行包含交叉试验和精心选择终点研究,以确保由突变所致治疗更换所见任何获益,能够反映患者结局实际改善,而非由诊断较早所致生存时间较长。
该综述强调,激素受体阳性HER2阴性晚期乳腺癌的治疗进展目前主要集中于精准医疗领域。新一代测序技术的日益普及,使临床医生能够以前所未有的方式预测和应对肿瘤演变。未来的挑战在于如何改进这些工具的应用时机和方式,如何在临床背景下解读其结果,并确保个体化治疗不仅根据分子特征,而且也根据每位患者的个体需求。在追求精准肿瘤学的道路上,过去十年激素受体阳性晚期乳腺癌治疗取得长足进步。不过,知识的进步也揭示了更大或更复杂的差距。因此,虽然取得进步,但是在追求精准肿瘤学的过程中,我们似乎比以往任何时候都更需要努力,以期为每位激素受体阳性晚期乳腺癌患者找到合适的治疗方案。
CA Cancer J Clin. 2026 Jan 12;76(1):e70055. IF: 232.4
Personalizing therapies over the course of hormone receptor-positive/HER2-negative metastatic breast cancer.
Singareeka Raghavendra A, Damodaran S, Barcenas CH, Fuqua SA, Layman RM, Tripathy D.
The University of Texas MD Anderson Cancer Center, Houston, Texas, USA; Baylor College of Medicine, Houston, Texas, USA.
PMID: 41524544
DOI: 10.3322/caac.70055
CA Cancer J Clin. 2026 Jan 12;76(1):e70060. IF: 232.4
Pursuit of precision oncology in the treatment of metastatic hormone receptor-positive breast cancer: Making strides or barely moving?
Schlam I, Dhakal A.
Dana-Farber Cancer Institute, Harvard Medical School, Boston, Massachusetts, USA; Wilmot Cancer Institute, University of Rochester Medical Center, Rochester, New York, USA.
PMID: 41525040
DOI: 10.3322/caac.70060











 苏公网安备32059002004080号
苏公网安备32059002004080号


