得益于抗HER2靶向治疗的问世,HER2阳性转移性乳腺癌(MBC)患者的生存期已得到显著延长。然而,依然存在一座难以跨越的“险峰”——脑转移。据统计,高达50%的HER2阳性MBC患者最终会发生脑转移[1-2],这不仅严重损耗患者的生存质量,更是导致治疗失败和死亡的主要原因。遗憾的是,既往大多数关键性临床试验常将活动性脑转移患者拒之门外,使得这一高危群体的治疗选择捉襟见肘。
Tucatinib(图卡替尼),作为一种对HER2具有高度选择性的小分子口服酪氨酸激酶抑制剂(TKI),凭借其卓越的血脑屏障穿透能力,此前已在里程碑式HER2CLIMB研究中,通过联合曲妥珠单抗和卡培他滨,改写了脑转移患者的治疗指南。那么,如果将这一强效TKI与经典的抗体偶联药物(ADC)恩美曲妥珠单抗(T-DM1)强强联手,能否进一步突破疗效天花板?近期,备受瞩目的III期临床研究HER2CLIMB-02在肿瘤学顶级期刊《Annals of Oncology》上正式发表。该研究结果不仅证实了图卡替尼联合T-DM1在经治HER2阳性晚期乳腺癌中的显著无进展生存期(PFS)获益,更在脑转移亚组中交出了一份令人振奋的答卷[3]。

破局思路:垂直阻断与受体稳定机制
HER2阳性乳腺癌治疗虽已取得显著进展,但大多数转移性患者最终会产生耐药并发生疾病进展。本研究探索“图卡替尼 + T-DM1”联合方案,主要基于以下三大科学依据:
1. HER2通路的垂直抑制
通过针对HER2的细胞内(如TKI)和细胞外(如抗体/ADC)疗法同时进行靶向治疗,即“HER2垂直受体抑制”,可能改善HER2阳性转移性乳腺癌患者的预后。图卡替尼作为一种对HER2具有高度选择性的口服酪氨酸激酶抑制剂,与靶向HER2胞外域的ADC药物T-DM1联用,在机制上构成了完整的垂直抑制。
2. 独特的协同增效机制:稳定受体表达
乳腺癌模型的临床前研究结果表明,图卡替尼与T-DM1联合使用可增强单药的抗肿瘤活性。其潜在的分子机制在于:图卡替尼可能稳定了HER2受体在肿瘤细胞表面的表达,进而促进了DM1向肿瘤细胞内的递送增强。这一机制为两药联用提供了直接的细胞学证据。
3. 确证的颅内活性与前期数据支持
脑转移是HER2阳性患者治疗的难点。图卡替尼在HER2CLIMB研究中证实了改善脑转移患者生存的获益。在此前的Ib期研究中,图卡替尼联合T-DM1在既往接受过大量治疗的患者中显示出令人鼓舞的抗肿瘤活性(包括颅内缓解)和可控的毒性。
基于上述机制与前期数据,HER2CLIMB-02研究旨在更大规模人群中进一步验证该联合方案的疗效。
纳入“脑转移”的研究设计:直面真实世界的高危人群
HER2CLIMB-02是一项全球多中心、随机、双盲、安慰剂对照的III期临床试验。其研究设计的最大亮点在于对入组人群的“高包容性”,特别是对脑转移患者的接纳。
1. 入组标准:涵盖广泛经治人群
研究纳入了既往接受过曲妥珠单抗和紫杉类药物治疗的HER2阳性局部晚期或转移性乳腺癌(LA/MBC)患者。这意味着入组患者均为二线及以上人群,且允许既往使用过帕妥珠单抗(实际入组中约90%的患者既往使用过帕妥珠单抗,符合当前的临床现状)。
2. 脑转移患者的“全覆盖”
与许多仅纳入“经治疗且稳定”脑转移患者的试验不同,HER2CLIMB-02延续了HER2CLIMB研究的传统,允许纳入各类脑转移患者,包括:
未经治疗的脑转移;
既往治疗后进展的脑转移;
既往治疗后稳定的脑转移。
前提是这些病灶不需要立即进行局部干预。这一设计极大地提高了研究结果在真实世界临床实践中的外推性。
3. 治疗分组与终点
463例患者按1:1比例随机分配至两组:
试验组(n=228):T-DM1(3.6 mg/kg,IV,Q3W)+ 图卡替尼(300 mg,口服,BID);
对照组(n=235):T-DM1 + 安慰剂。
主要终点为研究者评估的无进展生存期(PFS),关键次要终点包括总生存期(OS)、脑转移患者的PFS及OS等。
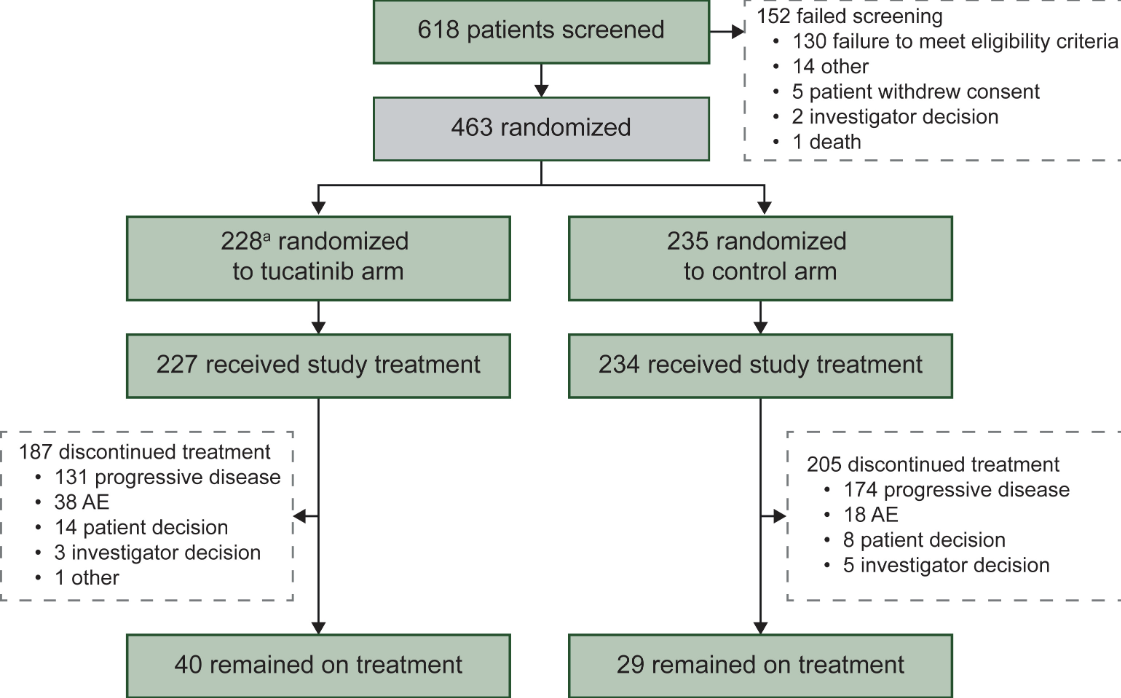
疗效深度剖析:PFS稳健获益,脑转移亚组表现抢眼
截至数据截止日期(2023年6月29日),中位随访时间达到24.4个月。研究结果显示,图卡替尼联合T-DM1在主要终点及多个关键亚组中均展现出统计学显著且具有临床意义的改善。
1. 全人群PFS:风险降低24%,打破二线治疗僵局
在全体意向治疗(ITT)人群中,联合治疗组的中位PFS达到9.5个月(95% CI 7.4-10.9),显著优于对照组的7.4个月(95% CI 5.6-8.1)。
风险比(HR):0.76(95% CI 0.61-0.95,P=0.0163)。这意味着联合治疗将疾病进展或死亡的风险相对降低了24%。
盲态独立审查(BICR):BICR评估的HR同样为0.76,进一步证实了研究者评估结果的可靠性。
这一结果在所有预设的亚组中保持一致,无论患者的激素受体状态如何,均能从联合治疗中获益。
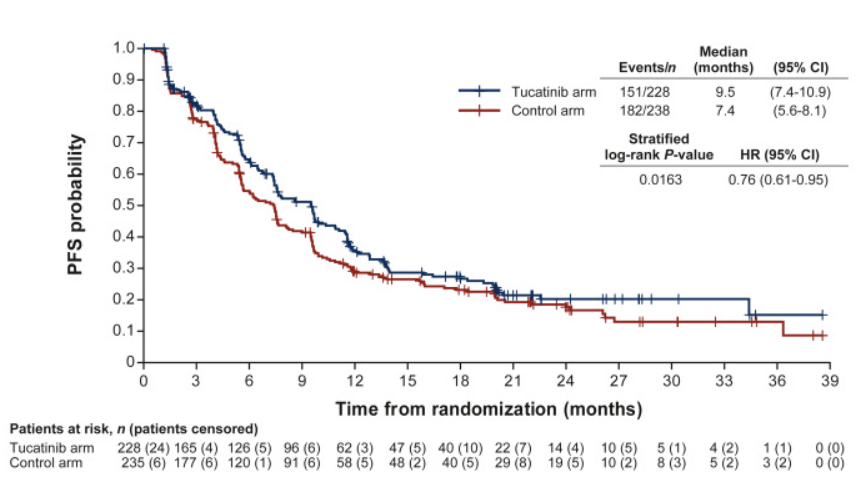
2. 脑转移亚组:HR 0.64,精准打击颅内病灶
本研究中,基线伴有脑转移的患者比例高达44.1%(204例),其中超过半数(52.5%)为活动性脑转移(未经治疗或治疗后进展)。这部分患者通常预后最差,治疗难度最大。
亚组分析显示,图卡替尼联合T-DM1为这一难治群体带来了更为显著的获益:
脑转移患者PFS:联合治疗组的中位PFS延长至7.8个月,而对照组仅为5.7个月。
风险比(HR):0.64(95% CI 0.46-0.89)。这意味着在脑转移患者中,联合方案将进展或死亡风险降低了36%。
非脑转移患者:同样观察到获益趋势(HR 0.88),中位PFS从8.5个月延长至9.7个月。
这一数据有力地支持了图卡替尼作为小分子药物在穿透血脑屏障方面的独特优势,也证实了其与T-DM1联用在颅内病灶控制上的协同效应。
3. 总生存期(OS):数据尚不成熟,长生存趋势显现
期中分析时,OS数据尚不成熟(仅发生目标事件数的53%),未达到预设的统计学差异界值。
中位OS:联合治疗组尚未达到,对照组为38.0个月(HR 1.23,95% CI 0.87-1.74)。
解读:值得注意的是,两组的OS数值均优于历史对照(如EMILIA研究中T-DM1组的中位OS为30.9个月)。这主要归功于近年来HER2治疗领域的飞速发展,后续治疗手段的丰富(如T-DXd、图卡替尼等药物的广泛使用)显著延长了患者的生存期。数据显示,约80%的患者在出组后接受了后续治疗,其中近半数接受了T-DXd。这在客观上导致了OS数据的“截尾”和统计学分析的复杂性,需要更长时间的随访来明确最终生存获益。
4. 缓解率与临床获益
在有可测量病灶的患者中,联合治疗组的确认客观缓解率(ORR)数值上更高(42.0% vs 36.1%)。虽然中位缓解持续时间(DoR)略短于对照组(10.4个月 vs 12.5个月),但在临床获益率(CBR)方面,联合组再次占据优势(59.2% vs 55.7%)。
安全性全景:肝脏事件需关注,整体可控可逆
HER2CLIMB-02研究显示,图卡替尼联合T-DM1的安全性特征与既往认知一致,未出现新的非预期安全信号,主要的不良事件集中在消化道和肝脏。
1.常见不良事件(TEAEs)
联合治疗组最常见的TEAEs包括恶心(65.4%)、腹泻(56.7%)和疲劳(48.9%)。值得欣慰的是,这些不良事件绝大多数为1-2级,属于轻中度,通过常规的对症处理即可有效缓解。3级腹泻的发生率仅为4.8%,未发生4级及以上腹泻事件。
2. 重点关注:肝转氨酶升高
本研究中,联合治疗组≥3级TEAE的发生率高于对照组(68.8% vs 41.2%),其主要驱动因素为肝转氨酶的升高。
发生率:联合组中,≥3级丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)升高的发生率均为16.5%,而对照组仅为2.6%。
机制探讨:这一比例高于单药T-DM1的历史数据(EMILIA研究中约为3-4%)和单药图卡替尼的历史数据(HER2CLIMB研究中约为5%左右),提示两种药物联用可能在肝毒性方面存在一定的叠加效应。
临床管理与转归:尽管发生率较高,但肝脏事件呈现出典型的暂时性、可逆性特征。通过方案规定的暂停给药或剂量下调,绝大多数患者的肝功能可恢复正常。两组中,肝脏事件缓解或恢复至1级的中位时间均为22天。经独立外部肝病专家审查,未发现符合Hy's Law(海氏法则)的严重药物性肝损伤病例。联合组虽有1例肝衰竭死亡病例,但经判定可能与肝转移进展相关,与药物无关。
这一结果提示临床医生,在使用该联合方案时,需加强对肝功能的主动监测(特别是在治疗早期的前几个周期),一旦发现转氨酶升高,应及时依据指南进行剂量调整,这并不影响后续治疗的继续进行。
深度讨论:后T-DXd时代的临床定位与未来展望
HER2CLIMB-02研究的成功,为HER2阳性晚期乳腺癌的治疗格局增添了一块重要拼图。在当前的临床实践中,我们需要结合最新的治疗背景来审视这一研究的价值。
1. 在T-DXd主导时代的独特价值
必须承认,自HER2CLIMB-02研究启动以来,HER2治疗领域发生了翻天覆地的变化。凭借DESTINY-Breast03研究的压倒性优势,德曲妥珠单抗(T-DXd)已无可争议地取代T-DM1,成为二线治疗的标准方案(SOC)。
然而,这并不意味着图卡替尼联合T-DM1方案失去了用武之地。相反,它在以下几个场景中具有不可替代的战略地位:
T-DXd不适用人群:对于存在间质性肺病(ILD)高危因素、既往发生过ILD或因其他原因无法耐受T-DXd的患者,图卡替尼联合T-DM1提供了高强度的替代方案。
后线治疗的有力补充:目前对于T-DXd耐药后的最佳治疗策略尚无定论。考虑到图卡替尼与T-DXd完全不同的作用机制(小分子TKI vs ADC),以及T-DM1与其不同的载药机制,该联合方案有望成为三线及后线治疗的重要选项,为T-DXd进展后的患者提供持续的生存获益。
2. 脑转移患者的优选方案
脑转移一直是HER2阳性乳腺癌治疗的痛点。尽管T-DXd在脑转移患者中也显示出疗效,但图卡替尼凭借其小分子特性,在血脑屏障穿透性上具有理论优势。HER2CLIMB-02研究中脑转移亚组HR 0.64的优异表现,再次巩固了图卡替尼作为脑转移治疗基石药物的地位。对于脑转移负荷较重、或对CNS控制有更高需求的患者,含图卡替尼的方案(包括联合T-DM1)仍是极具竞争力的选择。
3. 治疗序列的排兵布阵
本研究虽然未纳入既往接受过TKI或T-DXd治疗的患者,但真实世界研究(如RWE数据)已初步提示,在接受过新型ADC药物治疗后,序贯使用图卡替尼方案仍能获益。未来的研究重点将转向探索最佳的药物排序:是先用T-DXd再用图卡替尼联合方案,还是在特定人群中优先使用小分子TKI?这需要更多前瞻性数据来回答。
结语
HER2CLIMB-02研究以翔实的数据证实,在既往经治的HER2阳性晚期乳腺癌患者中,图卡替尼联合T-DM1能够显著延长无进展生存期,且安全性特征可控。特别是对于临床棘手的脑转移患者,该联合方案展现出了令人鼓舞的抗肿瘤活性。
尽管治疗格局不断演变,但为患者提供多样化、精准化的治疗选择始终是临床的终极目标。图卡替尼联合T-DM1方案的成功,不仅丰富了现有的抗HER2武器库,更为晚期患者,尤其是脑转移患者,点亮了一盏新的希望之灯。
[1] Clayton, A.J,Danson, S.,Jolly, S.,et al. Incidence of cerebral metastases in patients treated with trastuzumab for metastatic breast cancer.Br J Cancer. 2004; 91:639-643.
[2]Pestalozzi, B.C,Holmes, E.,de Azambuja,et al. CNS relapses in patients with HER2-positive early breast cancer who have and have not received adjuvant trastuzumab: a retrospective substudy of the HERA trial (BIG 1-01).Lancet Oncol. 2013; 14:244-248.
[3]Hurvitz SA, et al. Tucatinib and trastuzumab emtansine for patients with previously treated HER2-positive locally advanced and metastatic breast cancer: primary analysis of the randomized phase III trial HER2CLIMB-02. Ann Oncol. 2025. doi: 10.1016/j.annonc.2025.11.005.
排版编辑:肿瘤资讯-slb











 苏公网安备32059002004080号
苏公网安备32059002004080号


