Menin作为关键核支架蛋白,与赖氨酸甲基转移酶2A(KMT2A/MLL)等表观遗传调控因子形成复合物,异常激活HOXA9/MEIS1等致癌基因表达,成为急性白血病(AL)发生发展的关键驱动机制[1]。这一靶点的发现为伴KMT2A重排(KMT2Ar)等亚型患者开辟了新路径——Menin抑制剂可精准阻断Menin蛋白与KMT2A融合蛋白的相互作用,有效抑制白血病细胞异常增殖并诱导其分化[1]。目前,Menin抑制剂种类众多,Revumenib(SNDX-5613)已获美国FDA批准用于复发/难治性(R/R)KMT2Ar或核磷蛋白1突变(NPM1m)AL;Bleximenib(JNJ-75276617)、Ziftomenib(KO-539)、Enzomenib(DSP-5336)、BN-104等多款药物正处于不同阶段临床试验。
在刚刚落幕的2025年美国血液学会(ASH)年会上,多项Menin抑制剂的最新临床研究结果集中发布,涵盖单药优化、联合方案探索等关键方向。本文将系统梳理2025 ASH中Menin抑制剂的关键进展,为临床实践和研究提供更丰富的循证依据。
伴KMT2Ar/NPM1m R/R AL:单药深耕,并行联合突破
(一)Menin抑制剂单药方案:亚型覆盖与疗效优化再获新证
Menin抑制剂单药在R/R AL中已展现明确疗效,2025 ASH大会进一步补充了不同药物、不同亚型人群的细分数据,为精准用药提供支持。
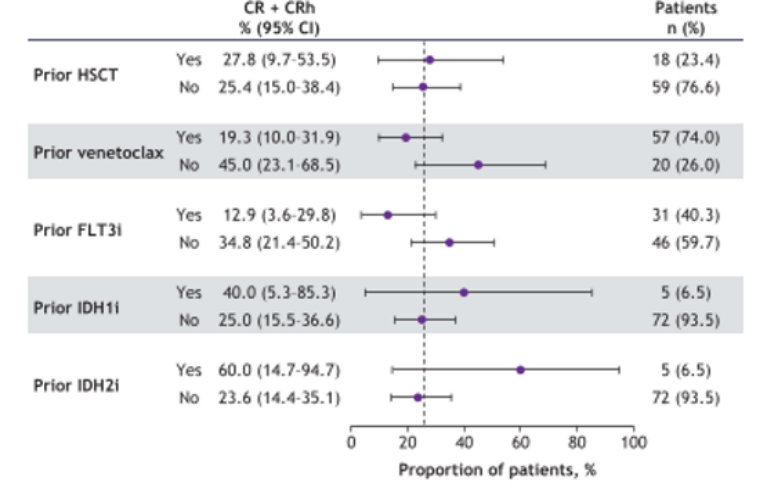
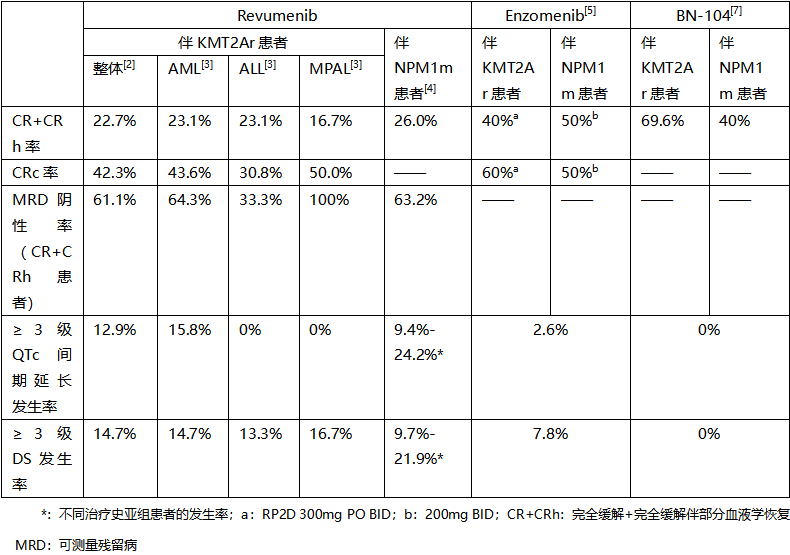
Revumenib作为首个获批的Menin抑制剂,已有既往研究验证了其在伴KMT2Ar R/R AL患者中的疗效[2]。2025 ASH公布的2期AUGMENT-101研究按白血病亚型分析,覆盖急性髓系白血病(AML)、急性淋巴细胞白血病(ALL)及混合表型急性白血病(MPAL)等,最新数据进一步拓展了Revumenib的循证证据(表1)[3]。其中,队列2C对伴NPM1m R/R AML进行了详细分析,整体结果与伴KMT2Ar患者相似(表1),另外亚组分析显示,既往接受过IDH抑制剂治疗的患者,其缓解情况呈现出一定优势(图1)[4]。
今年ASH更新的1期剂量递增/优化试验数据进一步验证了Enzomenib的治疗效果。研究未观察到剂量限制性毒性(DLTs)[5]。联用唑类药物的伴KMT2Ar患者的2期推荐剂量(RP2D)为300mg BID,在此剂量下疗效较优;伴NPM1m患者的剂量优化试验仍在进行中,已有初步结果披露(表1)[5]。
在国际Menin抑制剂不断刷新临床数据的同时,国内在研Menin抑制剂也不甘示弱。BN-104作为新型、高活性、高选择性的口服Menin抑制剂,其疗效覆盖伴KMT2Ar/NPM1m R/R AL患者,被国家药品监督管理局(NMPA)纳入突破性治疗品种,凭借其在难治患者群体中观察到的积极单药疗效和良好的初步安全性,展现出领先同类的潜力[6]。2024年ASH公布的1/2期研究数据令人瞩目(表1):接受200mg QD-600mg BID剂量递增治疗的伴KMT2Ar患者和伴NPM1m患者的复合完全缓解(CRc)率分别达69.6%、40%;安全性方面表现同样突出,未出现≥3级QTc间期延长或分化综合征(DS)等严重不良事件(AE)[7]。
(二)联合方案:协同增效,破解单药局限
针对单药治疗可能存在的缓解深度不足、耐药等问题,2025 ASH大会公布的联合方案数据或可进一步提升疗效,为患者带来更多治疗可能。
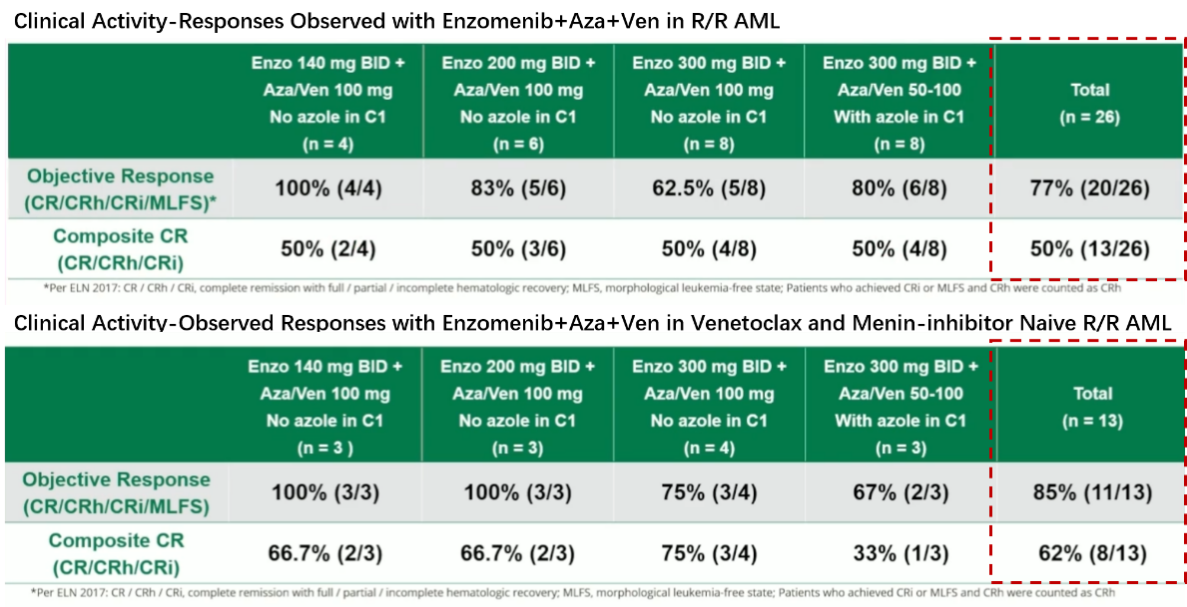
Enzomenib+VEN+阿扎胞苷(AZA)的1期研究初步探索了该组合在伴KMT2Ar/NPM1m R/R AML中的安全性与有效性,初步表现亮眼,既往未接受过VEN和Menin抑制剂的患者缓解率更优(表2);78%的应答患者实现MRD阴性[8]。安全性方面,未发生DLTs和治疗相关死亡;且药物间无显著相互作用,无需调整剂量[8]。
KOMET-007研究本次更新纳入了83例R/R患者,在更大样本量中进一步证实了Ziftomenib+VEN+AZA的价值[9]。伴NPM1m患者的CRc率及MRD阴性率分别为48%和60%;伴KMT2Ar患者则分别为28%和43%。研究同样观察到,既往未接受过VEN的患者疗效大幅提升(表3)[9]。2%的患者因Ziftomenib相关AE而停药,1例患者发生3级DS[9]。
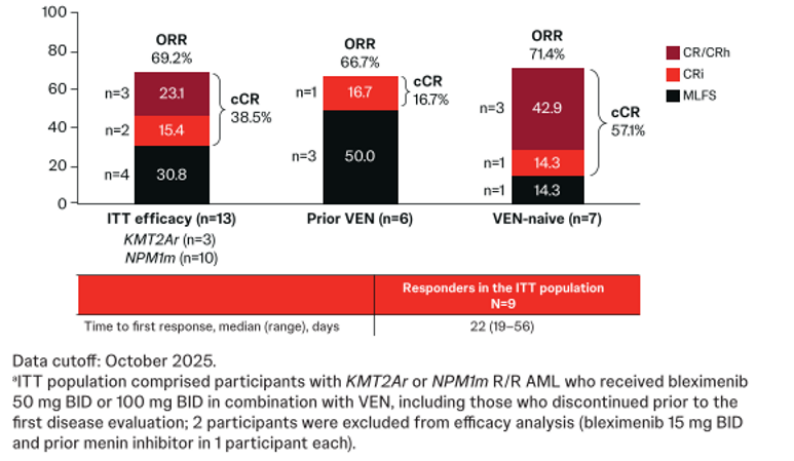
ALE1002研究在2025 ASH上公布了队列A1(伴KMT2Ar/NPM1m R/R AML患者)的最新数据,在13例接受Bleximenib+VEN治疗的意向治疗(ITT)人群中,CRc率为38.5%,其中VEN未暴露亚组的CRc率升至57.1%(图2)[10]。该结果证实,Menin抑制剂两药联合方案同样显效[10]。
伴KMT2Ar/NPM1m ND AL:方案迭出,深化精准施治
(一)Menin抑制剂单药方案:聚焦不适合强化疗人群
对于不适合强化疗(unfit)的老年或衰弱新诊断(ND)AML患者,2025 ASH 大会上公布了一项2期多中心试验(NCT06930352),旨在评估Ziftomenib单药在伴KMT2Ar/NPM1m unfit ND AML患者中的疗效,该研究目前仍处于多中心入组阶段[11]。
(二)Menin抑制剂+VEN+HMA方案:强化疗效,全口服方案成亮点
临床前研究已证实了Menin抑制剂与VEN/HMA的协同抗白血病作用,2025 ASH大会也公布了多项研究,从临床不同药物组合角度再次佐证了该策略的临床价值。
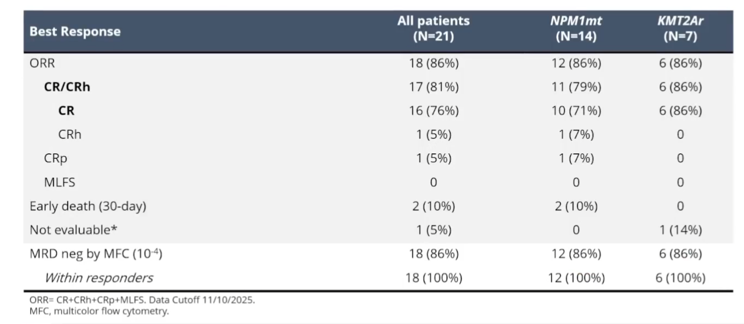
KOMET-007研究纳入了40例NPM1m ND AML患者,接受Ziftomenib+VEN+AZA治疗[12]。本次大会更新的1b期结果显示出深度缓解的潜力(表4),研究观察到1例2级DS和1例3级QTc间期延长[12]。

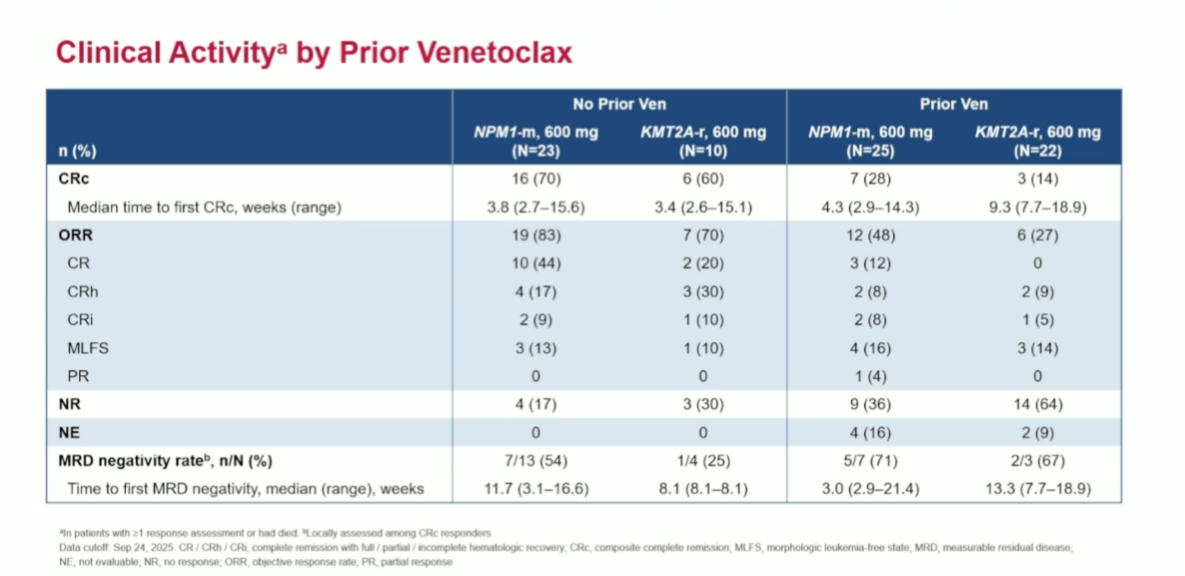
SAVE研究的最新结果进一步优化了给药便利性。21例伴KMT2Ar/NPM1m ND AML患者接受全口服SAVE方案(Revumenib+地西他滨/西达本胺复方制剂ASTX727+VEN)治疗,结果显示,整体人群、伴KMT2Ar及伴NPM1m患者均取得了深度缓解(表5)[13]。安全性方面,≥3级DS发生率为10%,无≥3级QTc间期延长[13]。
(三)Menin抑制剂+强化疗方案:为“适合”患者增添制胜利器
对于体能状态良好、适合强化疗条件的ND AML患者,强化疗是传统标准方案,但对于伴KMT2Ar/NPM1m等亚型,强化疗疗效仍不尽如人意。2025 ASH大会公布的多项研究,探索了Menin抑制剂与强化疗的联合策略,旨在突破传统方案的疗效瓶颈。
HOVON 181 AML/AMLSG 37-25研究是一项全球多中心双盲3期研究,旨在评估Bleximenib对比安慰剂联合标准化疗用于伴KMT2Ar/NPM1m ND AML的疗效和安全性,目前计划于2025年末启动全球入组[14]。
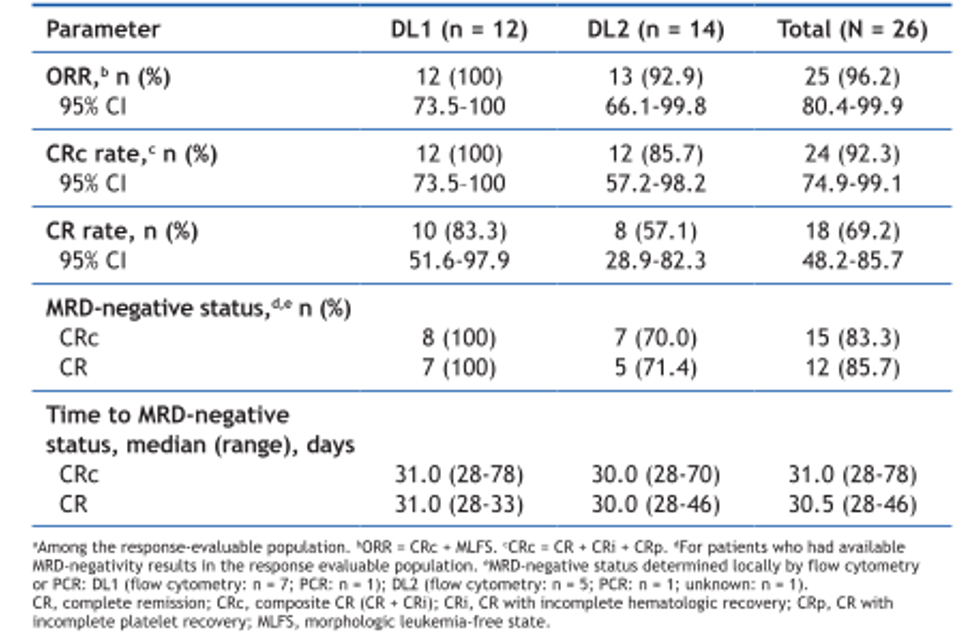
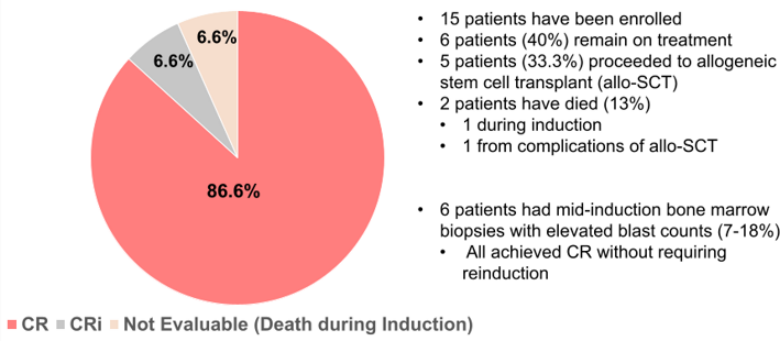
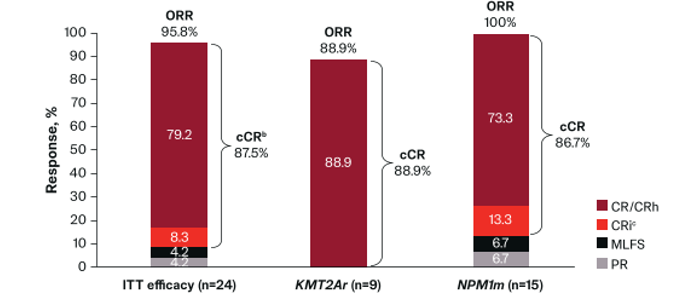
两项研究探索了Revumenib与“7+3”方案的联合效果。其中SNDX-5613-0708研究共入组30例伴KMT2Ar、NPM1m或NUP98r ND AML患者,接受Menin抑制剂联合“7+3”诱导、Revumenib+大剂量阿糖胞苷(HiDAC)方案或移植巩固治疗,后续再采用Revumenib单药维持治疗[15]。在剂量水平1(DL1,Revumenib 110mg/220mg q12h)队列中,实现了100%的CR率、CRc率及MRD阴性率(表6)[15]。另一项入组15例患者的ETCTN 10596研究结果显示,Revumenib联合“7+3”诱导后实现86.6%的CR率及93.2%的CR+CR伴不完全血液学恢复(CR/CRi)率(图3),目前研究正开启扩展队列,将进一步验证推荐剂量的安全性、疗效等[16]。
ALE1002研究的还更新了队列C1(入组44例伴KMT2Ar/NPM1mND AML患者接受Bleximenib[RP2D:100mg BID]联合“7+3”方案治疗)的数据[17]。该方案展现出较优的疗效与安全性平衡:ITT人群中,诱导后整体CRc率87.5%、MRD阴性率 80%(图4);AE与“7+3”方案相似[17]。
(四)Menin抑制剂联合其他方案:深入多阶段,拓展策略可观且耐受性良好
Menin抑制剂的临床探索已从单药/经典联合延伸至耐药破解、精准分层及延长生存,2025 ASH 大会公布的多项研究为其应用场景提供了新方向。
针对Menin抑制剂单药易出现的耐药问题,Revumenib开展了一项1/2期、多中心研究,探索其联合CELMoD类药物Mezigdomide治疗伴KMT2Ar、NPM1m或NUP98r R/R AL患者的效果。主要终点为DTLs(1期)和6周期内的CR/CRh率(2期),预计2025年末启动首中心入组[18]。
一项对13,458例ND AML患者的大规模基因组分析为Menin抑制剂的精准联合提供了遗传依据。研究发现,在携带NPM1、KMT2A或NUP98异常的患者中,63%存在FLT3、IDH1/2等可靶向共突变,且不同亚型的共突变谱存在差异[19]。这一结果提示,可基于患者的共突变特征个体化地实施Menin抑制剂联合靶向药策略,以进一步提升缓解深度[19]。
2025 ASH大会上亦有两项研究聚焦于Revumenib在移植后维持中的应用。一项回顾性分析提供了Revumenib在儿童HOX驱动AML(主要为KMT2Ar和NUP98r)移植后维持中的早期证据[20]。在10例移植后患儿中,于中位移植后111天启动Revumenib维持,结果显示所有患儿均存活,其中1例复发,无药物相关停药事件[20]。另有一项多中心1期试验(NCT06575296)正在评估Revumenib在伴KMT2Ar/NPM1m AL患者移植后维持治疗中的作用,目前研究已启动入组[21]。
Menin抑制剂真实世界研究:验证疗效,优化新方向
本次ASH大会发布的多项真实世界研究与荟萃分析进一步夯实了Menin抑制剂的临床价值,同时也揭示了治疗失败后的策略选择与临床试验外的应用现状,为这类药物的规范化使用提供了关键参考。
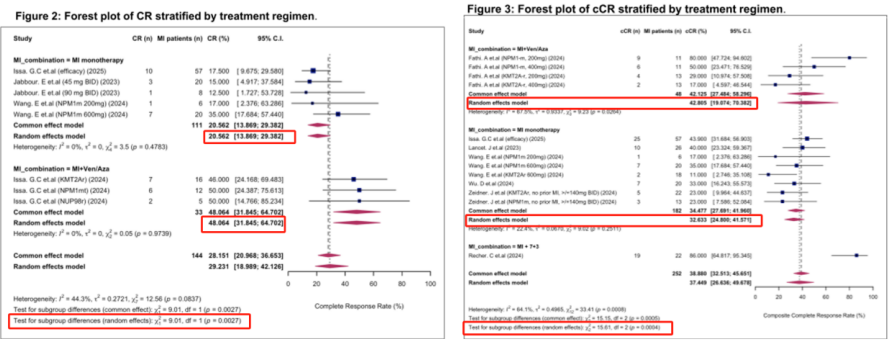
一项首次针对Menin抑制剂在伴KMT2Ar/NPM1m R/R AML患者中应用的系统综述与荟萃分析综合评估了其疗效与安全性[22]。该研究汇总分析了9项研究共546例患者的数据。合并分析显示,Menin抑制剂单药或联合治疗的CRc率为37.5%;亚组分析证实,与单药治疗相比,Menin抑制剂+Ven+AZA的疗效更显著(图5)[22]。整体耐受性与临床试验结果一致[22]。
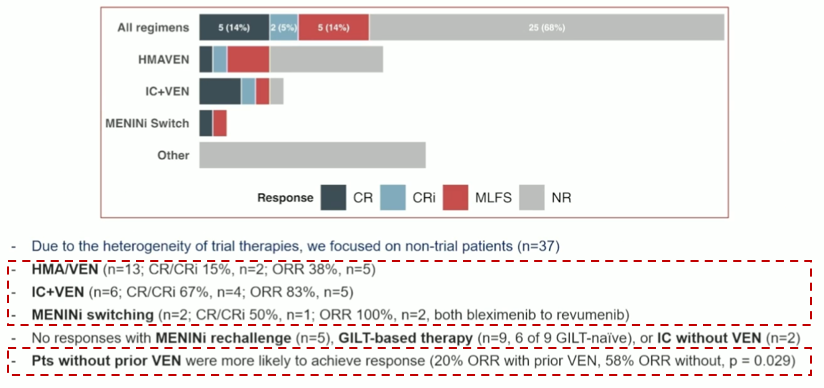
一项多中心回顾性研究通过分析84例R/R AML患者数据发现,Menin抑制剂治疗失败后患者预后较差,中位OS仅4.4个月,但针对性治疗策略,如采用基于VEN的方案和换用另一种不同的Menin抑制剂显示出一定的活性(图6)[23]。该研究明确提出,优化治疗序列、探索耐药机制及开发逆转耐药的联合方案,是进一步改善这类患者预后的关键方向[23]。
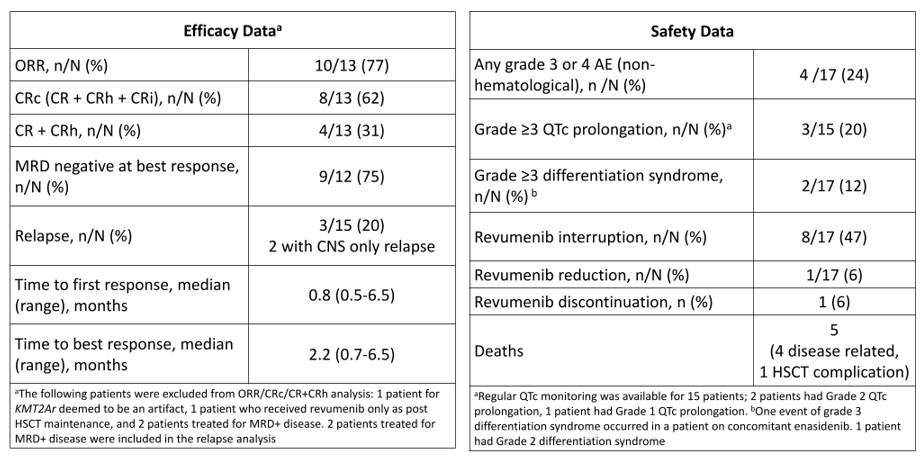
一项单中心回顾性研究则填补了临床试验外的应用空白,纳入17例不符合临床试验入组标准的患者接受Revumenib治疗,其中76%患者采用Revumenib三联方案[24]。结果显示,Menin抑制剂真实世界疗效与临床试验一致(表7),进一步验证了Revumenib在真实临床场景中的耐受性与实用性[24]。
总结
2025年ASH年会的数据表明,Menin抑制剂已从后线挽救治疗成功迈进维持治疗,乃至前线治疗,实现了多点突破。对于R/R患者,单药治疗显示出稳健疗效,其中BN104表现尤为突出,不仅缓解率高且未出现≥3级QTc间期延长或DS,为中国患者提供了更具针对性的治疗选择;而Menin抑制剂与VEN/AZA等的联合方案则显著提升了缓解深度与MRD阴性率。在ND患者中,无论是unfit患者采用的全口服联合方案,还是fit患者联用的强化疗方案,都带来了显著的高缓解率。同时,真实世界研究证实了Menin抑制剂疗效的普遍性,移植后维持等新策略也正在探索中。相信未来随着更多3期研究结果的出炉和治疗策略的不断优化,Menin抑制剂可引领伴KMT2Ar/NPM1m AL进入一个治疗前景更为广阔的新时代。
专家简介
北京协和医院血液内科主任
中华医学会血液学分会常委
北京医学会血液学分会副主任委员
北京医师协会血液科医师分会副会长
中华医学会血液学分会罕见病学组组长
中华血液学杂志编委
[1].Boussi L, et al. Trends Cancer. 2025 Sep;11(9):889-900.
[2].Aldoss I, et al. 2025 EHA. PS1473.
[3].Aldoss I, et al. 2025 ASH. Oral 1001(abs25-1793).
[4].Arellano ML, et al. 2025 ASH. Poster 3418(abs25-1788).
[5].Daver N, et al. 2025 ASH. Oral 763(abs25-2036).
[6].https://www.cde.org.cn/main/news/viewInfoCommon/54538c67b7e764fc51666567fc620241
[7].Wu D, et al. 2024 ASH. Abstract 2879.
[8].Watts J, et al. 2025 ASH. Oral 765(abs25-2037).
[9].Fathi A, et al. 2025 ASH. Oral 764(abs25-3910).
[10].O'Nions J, et al. 2025 ASH. Poster 5200(abs25-8679).
[11].Jain J, et al. 2025 ASH. Poster 5211(abs25-12366).
[12].Roboz GJ, et al. 2025 ASH. Oral 766(abs25-3899).
[13].Jen WY, et al. 2025 ASH. Oral 47(abs25-11655).
[14].Raaijmakers M, et al. 2025 ASH. Poster 1654(abs25-8025).
[15].Aldoss I, et al. 2025 ASH. Poster 3425(abs25-8280).
[16].Mims AS, et al. 2025 ASH. Poster 5206(abs25-12876).
[17].Döhner H, et al. 2025 ASH. Poster 5199(abs25-7546).
[18].Chin K, et al. 2025 ASH. Poster 1657(abs25-12912).
[19].Ordemann R, et al. 2025 ASH. Poster 5248(abs25-3838).
[20].Cuglievan B, et al. 2025 ASH. Poster 3461(abs25-13960).
[21].BALL B, et al. 2025 ASH. Poster 5207(abs25-7170).
[22].BEKE K, et al. 2025 ASH. Poster 5154(abs25-1838).
[23].Chin K, et al. 2025 ASH. Oral 39(abs25-4550).
[24].Lqbal U, et al. 2025 ASH. Poster 3448(abs25-8553).
免责声明:
本资料的内容仅作为科学信息参考,仅用于医疗卫生专业人士的学术交流,请勿用于任何其他用途。若您不是医疗卫生专业人士,请勿观看和/或传播此资料。
本资料可能会出现某些药品信息,但该药品/适应症可能尚未获得国家药品监督管理局的注册批准。医疗卫生专业人士做出的任何与治疗有关的决定应根据患者的具体情况并应参照国家药品监督管理局批准的药品说明书。对于本资料可能提到的相关诊断、治疗方法,请遵守国家卫生健康委员会以及相关部门批准使用的指南或规定。
审批号:M-TIBSO-CN-202512-00031
本文转自:CCMTV血液频道











 苏公网安备32059002004080号
苏公网安备32059002004080号


