2025年12月27日,一场别开生面的学术盛会如约而至。“锵锵五人行 胃来空间探索——探讨2025胃癌成败故事”年度盘点会议以线上直播形式召开。天津医科大学肿瘤医院邓婷教授、南京大学医学院附属鼓楼医院魏嘉教授、中山大学肿瘤防治中心邱妙珍教授、西安交通大学附属第一医院吴胤瑛教授、北京大学肿瘤医院彭智教授,五位青年专家全副武装,化身“星际探路者”,围绕2025年胃癌领域的重磅研究进展展开深度探讨,从围手术期治疗到晚期一线、二线治疗,全面梳理这一年的成功经验与失败教训,为临床实践提供宝贵指引。


围手术期治疗:
免疫联合化疗格局初定,方案优化仍待探索
2025年无疑是胃癌治疗的“大年”,多项研究成果在国际顶级期刊重磅发表。在邓婷教授的主持下,邱妙珍教授首先介绍了胃癌围手术期免疫治疗MATTERHORN研究。该研究是一项全球、随机、双盲、安慰剂对照的III期临床试验,共入组948例II-IVA期可切除胃癌或胃食管结合部腺癌患者,随机接受FLOT方案联合PD-L1抑制剂度伐利尤单抗或安慰剂围手术期治疗。研究结果显示,该免疫联合方案可显著改善患者的无事件生存期(EFS)和总生存期(OS)。来自中国的III期ASTRUM-006研究于2025年10月报阳,在SOX方案新辅助治疗基础上联合PD-1抑制剂斯鲁利单抗,病理完全缓解(pCR)率相较对照组提高3倍以上,且EFS显著改善。

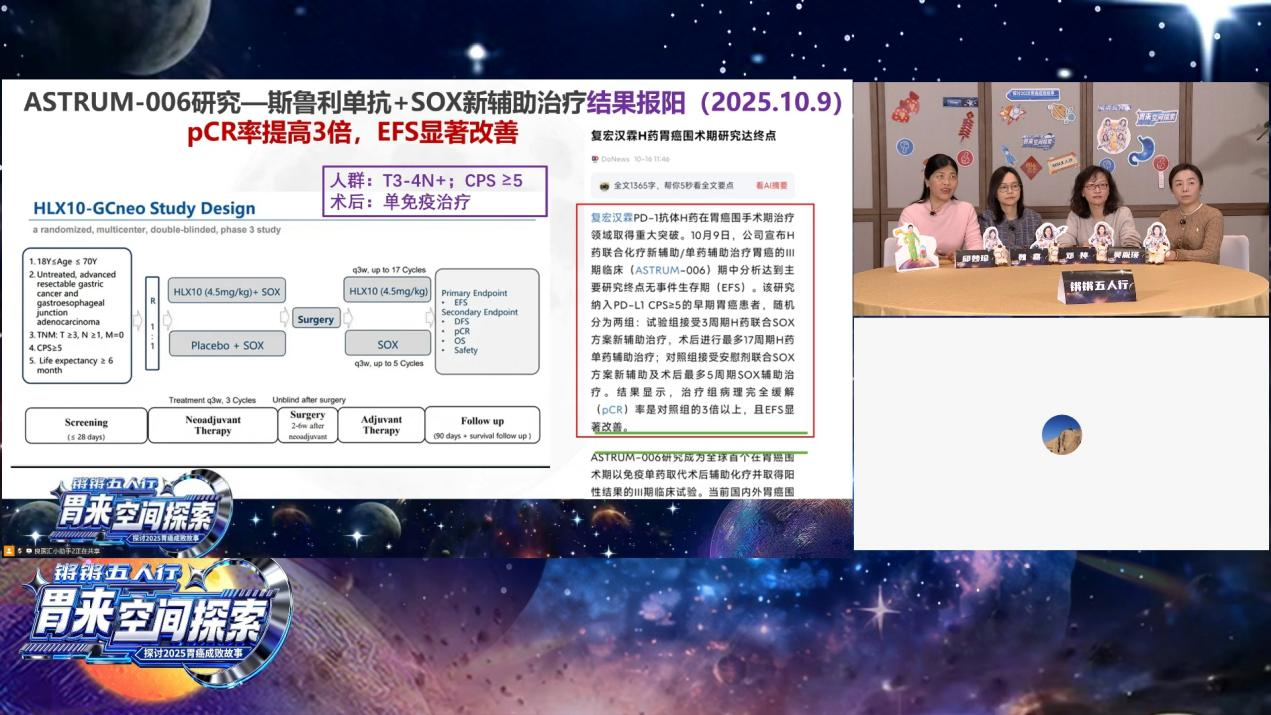
围绕“围手术期免疫治疗的应用”和“化疗配伍应选择三药方案还是两药方案”等核心问题,专家们展开了热烈讨论。
彭智教授指出,MATTERHORN等研究的阳性结果无疑将推动临床指南更新。但在具体临床实践中仍需做好精准分期,胃癌影像学分期准确度相对有限是一大挑战,应根据不同肿瘤分期制定个体化治疗策略。对于dMMR胃癌患者,未来甚至可能探索免手术的治疗模式,需结合患者的分期和生物标志物特点进行更为精准的治疗决策。
魏嘉教授认为,免疫治疗在围手术期的介入已是大势所趋,但若要进一步提高pCR率,仍需优选人群,PD-L1高表达人群的获益更为明显。三药化疗的耐受性是重要考量因素,特别是术后患者对化疗的耐受能力下降,临床实践中需权衡化疗强度与获益。对于基线分期较晚需要转化治疗的患者,个人倾向于联合放疗等局部治疗手段以提高整体治疗效果。
吴胤瑛教授补充道,MATTERHORN研究显示PD-L1阴性患者也能从免疫治疗中获益,只是阳性患者获益更多,后续更多研究可能会提供更细致的分层依据。对于胃食管结合部癌患者,联合放疗的局部介入可提高整体pCR率;对于dMMR患者,未来可能借鉴肠癌的治疗经验探索免疫优先方案。临床实践中应尽可能获取MSI状态及PD-L1表达等分子分型信息,为精准治疗提供依据,目前绝大多数中心已具备相应的检测能力。
邱妙珍教授分享了化疗配伍的临床经验,指出中国胃癌患者的体能状态评分和BMI普遍较欧美患者差,对FLOT三药方案的耐受性较差。而KEYNOTE-585研究中两药化疗方案联合免疫治疗同样显示出pCR率的显著提升,因此其临床常规实践多采用奥沙利铂联合氟尿嘧啶加免疫治疗的组合。
晚期一线治疗:靶向FGFR2b治疗曲折前行,抗血管生成之路任重道远
在晚期胃癌一线治疗领域,2025年两项重要研究结果却并不尽如人意。邱妙珍教授介绍了针对FGFR2b过表达人群的III期FORTITUDE-101研究,该研究在预先指定的中期分析中达到了总生存期(OS)主要终点,贝玛妥珠单抗联合mFOLFOX6方案相比安慰剂联合化疗显著改善了OS。然而,随着随访时间延长,延长随访的描述性分析显示治疗效果有所减弱,两组的OS生存曲线逐渐趋近。随后,FORTITUDE-102研究也宣布终止。针对这一结果,专家们从多角度进行了深入分析。

彭智教授分析认为,可能是早期随访时数据成熟度不足导致了对获益程度的高估,或者部分FGFR2b扩增患者在耐药后病情进展迅速,这一特点可能是后期获益减弱的原因之一,类似现象在c-MET扩增研究中也曾观察到。
邓婷教授则从眼部毒性管理角度进行了解读,指出该研究中试验组患者出现眼部毒性后需永久停药,影响了后续抗肿瘤治疗的连续性;同时视力下降也会降低后续化疗的依从性,这些因素可能都对最终生存结果产生了影响。
魏嘉教授对FGFR2b靶点的未来开发仍持乐观态度,认为该靶点在胃癌中的表达比例约为30%,这一人群不应放弃。FORTITUDE-101研究中期分析的阳性数据证明了靶向FGFR2b治疗的有效性,同时也为后续抗体设计规避毒性提供了宝贵经验,针对该靶点的ADC开发值得期待。
吴胤瑛教授补充道,ADC与传统单抗的作用机制不同,其携带的载荷(payload)也会发挥化疗作用。目前进行中的FGFR2b ADC临床研究在严密眼科筛查下尚未观察到严重眼部毒性事件,药物改构可能带来良好的应用前景,这部分占比约30%的人群仍有治疗希望。
邱妙珍教授表示,多家药企并未放弃FGFR2b靶点,仍有多项临床研究在进行中。期待FORTITUDE-101研究后续详细的亚组分析和分子标志物分析数据,以指导未来对该靶点的研发方向,包括是否需要将免疫组化cut-off值从10%进一步提高以筛选出更优获益人群。
另一项III期LEAP-015研究探索了仑伐替尼联合帕博利珠单抗和化疗对比单纯化疗治疗晚期胃食管腺癌的疗效。尽管该研究达到了无进展生存期(PFS)的主要终点之一,但OS未见显著获益。针对抗血管生成药物在胃癌领域的探索和应用,专家们展开了深入剖析。

彭智教授指出,目前一线抗血管生成治疗没有阳性结果,包括其团队开展的一线维持治疗研究也是阴性结果。抗血管生成药物在胃癌中整体获益有限,即使在后线治疗中也仅带来相对有限的获益,因此在一线治疗中很难通过随机对照研究证明其显著疗效。
邱妙珍教授持类似观点,表示通过基因检测、信号通路分析发现,血管生成通路在胃癌中呈现普适性表达,但并非关键驱动通路,因此其对抗血管生成药物在胃癌中的未来发展前景持保留态度。若要继续探索,则需要寻找优势获益人群。
魏嘉教授表示,抗血管生成药物在胃癌治疗中仍有其价值,关键在于精准选择人群。在一线治疗中,小样本探索性研究显示,肝样腺癌、胃癌肝转移患者接受传统标准治疗进展较快、预后较差,抗血管生成药物的引入可带来较为明显的获益提升。在其个人临床实践中,对于特定标志物阳性的患者,会考虑在免疫联合化疗基础上加用小剂量抗血管生成药物。
吴胤瑛教授分享了其中心正在进行的信迪利单抗联合安罗替尼加伊立替康脂质体的二线治疗探索,入组的多数是经过一线免疫治疗的人群,中期分析显示PFS可达6~7个月,初步结果令人鼓舞。但她同时指出,除了HER2等驱动基因阳性患者和肝样腺癌等特殊类型外,不太看好一线联合抗血管生成的前景。
晚期二线治疗:HER2阳性胃癌迎来治疗变革,ADC与双抗双雄并立
HER2阳性胃癌的二线治疗在2025年迎来了两项重磅阳性结果研究。邱妙珍教授介绍,DESTINY-Gastric04研究是一项全球、多中心、随机III期临床试验,纳入既往接受曲妥珠单抗治疗后进展、经再次活检确认HER2阳性的胃癌或胃食管结合部腺癌患者,随机接受德曲妥珠单抗或雷莫西尤单抗联合紫杉醇治疗。结果显示,德曲妥珠单抗组的mOS达14.7个月,显著优于对照组的11.4个月,死亡风险降低30%;mPFS分别为6.7个月和5.6个月,疾病进展或死亡风险降低26%。
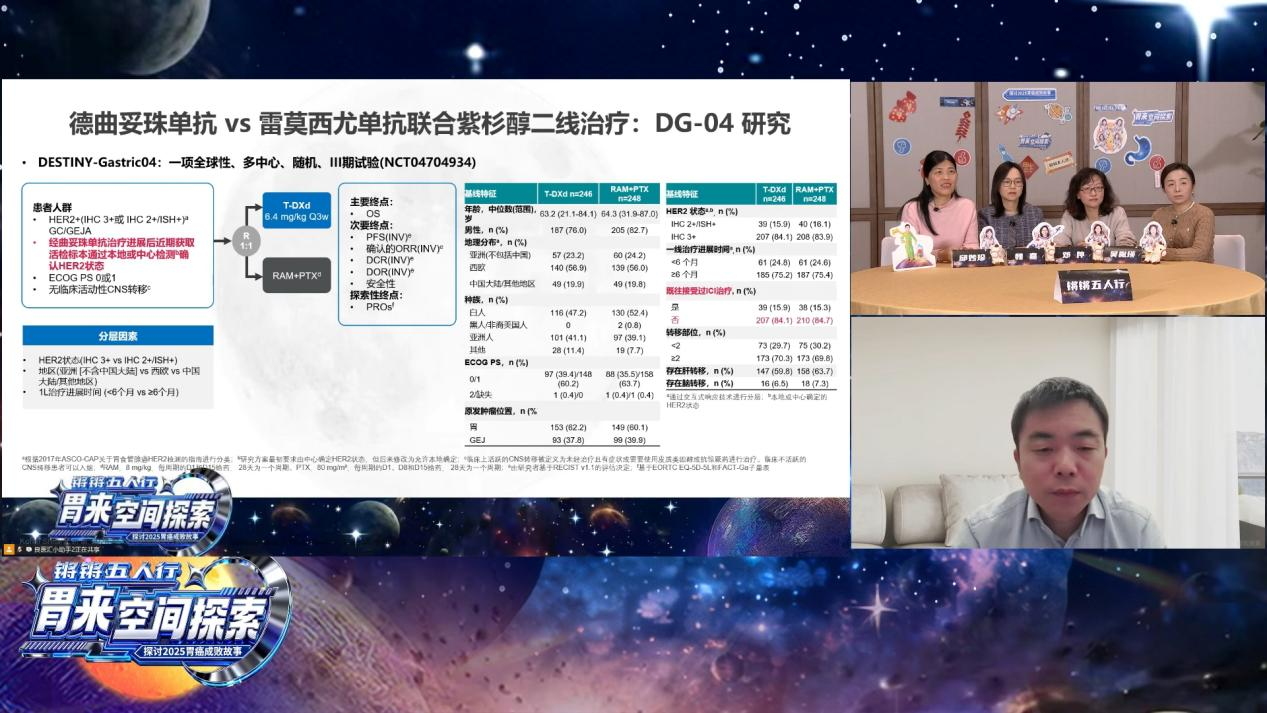
另一项由中国学者主导的KC-WISE研究同样取得了令人瞩目的成果。该研究是一项在中国51个研究中心开展的多中心、随机、双盲III期临床试验,纳入既往含曲妥珠单抗方案治疗后进展的HER2阳性胃癌患者。患者随机接受KN026(一种靶向HER2不同结构域的双特异性抗体)联合化疗或安慰剂联合化疗。结果显示,KN026联合化疗组的疾病进展或死亡风险显著降低75%,死亡风险显著降低71%,客观缓解率(ORR)达50.8%,优于对照组的10.8%。

围绕“再次活检的必要性”问题,专家们进行了深入讨论。
魏嘉教授强调,精准医疗时代对分子分型信息的需求使得能做活检的患者都应尽量进行再次活检,以指导后续治疗选择。其分享的长期生存病例充分说明了再次活检为治疗决策提供依据的重要性,只要能证实靶点阳性,抗HER2治疗的价值就很大。
吴胤瑛教授则提出了肿瘤异质性带来的挑战,临床中常见胃原发灶HER2阳性而肝转移灶已转阴的情况,如何理解这一现象值得深入思考。参照乳腺癌“曾阳即按阳”的处理原则,胃癌是否也应采取类似策略,有待进一步探讨。
彭智教授建议尽可能进行再次活检,尤其是在胃镜检查相对便捷的情况下。真正由HER2驱动肿瘤发生发展的患者可能从抗HER2治疗中获益更大,同时强调应遵循循证医学原则,优先采用标准治疗方案。
邱妙珍教授分析了两项研究设计差异对临床实践的启示。DESTINY-Gastric04研究筛选了1000余例患者,最终入组仅400余例,可能提示一线抗HER2治疗后HER2丢失率较高,似乎支持再次活检的必要性;但KC-WISE研究在不要求再次活检的情况下仍取得显著获益,又对这一观点提出了挑战。这可能与不同药物对HER2表达水平要求不同有关。临床决策时可结合患者活检意愿和条件进行个体化选择。
邓婷教授提出,目前曲妥珠单抗一线治疗进展后的患者面临二线治疗选择,应首选ADC还是双抗?综合专家观点,对于愿意接受再次活检且确认HER2阳性的患者,ADC德曲妥珠单抗是重要选择;对于无法或不愿接受再次活检的患者,双抗KN026也是可行的方案。展望未来,随着HERIZON-GEA-01等研究即将公布的一线治疗数据,HER2阳性胃癌的治疗格局将迎来重大变革,双抗有望前移至一线,ADC则可能成为二线标准选择。
展望2026:精准分层时代开启,综合治疗策略助力生存获益最大化
会议最后,五位专家对2026年胃癌诊疗前景进行了展望。彭智教授强调,除药物治疗外,应注重综合治疗策略的制定,尽可能为患者争取更多治疗机会,同时坚持标准规范治疗以保护患者的整体利益。吴胤瑛教授对国产创新药物的发展前景充满信心,表示中国学者主导的多项研究取得了突破性成果,国产创新药物展现出优异疗效,鼓励患者在可及的前提下积极参与临床研究。魏嘉教授指出,胃癌已进入精准治疗时代,但仍有相当比例的“灰区”患者需要更多关注,包括共表达阳性、免疫评分临界值等特殊人群的治疗优化,以及HER2阳性患者的全程管理策略都有待进一步探索。邱妙珍教授寄语患者心怀希望、积极参与临床研究,同时呼吁同道重视初诊时的全面分子检测,为患者制定精准化的治疗方案。邓婷教授总结道,胃癌治疗已进入精准分层时代,PD-L1、HER2、MMR和Claudin18.2四个常规检测靶点基本覆盖了当前可用药物的分层需求。再次活检在后续治疗中同样重要,可能为患者带来新的精准治疗选择。
2025年的胃癌诊疗领域既有突破性进展,也有值得反思的失败经验。从围手术期免疫治疗的确立,到一线靶向治疗的曲折探索,再到二线HER2靶向治疗的重大突破,每一项研究都为临床实践提供了宝贵启示。站在2025年的尾声,回望这一年的成败故事,展望2026年的无限可能,胃癌诊疗正朝着更加精准、个体化的方向稳步前行,为更多患者带来生存希望。
排版编辑:肿瘤资讯-Olivia











 苏公网安备32059002004080号
苏公网安备32059002004080号


