2025年,对于激素受体阳性(HR+)/人表皮生长因子受体-2阴性(HER2-)乳腺癌的诊疗而言,是具有变革意义的一年。随着多项重磅随访数据及分析结果的公布,瑞波西利贯穿乳腺癌全病程的获益正重塑HR+/HER2-乳腺癌临床诊疗范式——不仅提升了早期患者的治愈希望,更刷新了晚期患者的生存上限。本文将结合2025年NATALEE研究与MONALEESA系列汇总分析的最新进展,由北京大学肿瘤医院王楠医生分享一例伴肝转移及脑转移的高负荷乳腺癌患者的转归过程,同时邀请北京大学肿瘤医院李惠平教授进行病例点评。
北京大学肿瘤医院乳腺肿瘤内科主任
美国德克萨斯大学M.D.Anderson学习2年
中国女医师协会乳腺专业委员会主任委员
中华医学会乳腺学组副组长
中国抗癌协会乳腺癌专业委员会常委
中国女医师协会临床肿瘤学专委会副主任委员
中国进展期乳腺癌共识指南共同组长和执笔人
Associate Editor of “Breast Cancer Research and Treatment”
北京大学肿瘤医院乳腺肿瘤内科
北京大学医学部临床医学8年制,肿瘤学
主要从事晚期乳腺癌的诊断、规范化治疗的工作和研究
掌握晚期乳腺癌治疗的常见方案和治疗进展
曾于国内外医学杂志发表论文
女医师协会第二届乳腺专业委员会秘书
2025年度HR+乳腺癌诊疗盘点——瑞波西利
全病程获益版图
作为当前CDK4/6抑制剂中的领军者,瑞波西利在2025年欧洲肿瘤内科学会(ESMO)年会及圣安东尼奥乳腺癌研讨会(SABCS)上公布的NATALEE长期随访数据及MONALEESA综合分析,不仅巩固了其在晚期一线治疗中的核心地位,更在辅助治疗领域确立了新的治愈标准。
早期乳腺癌:迈向治愈新台阶
在早期乳腺癌(EBC)领域,NATALEE研究的5年里程碑分析结果为临床实践注入了强心剂。该研究最显著的突破在于覆盖人群广泛,不仅包含淋巴结阳性患者,更纳入了高危淋巴结阴性(N0)人群。5年随访数据显示,即便所有患者停用瑞波西利的中位时间已达2年,瑞波西利联合非甾体类芳香化酶抑制剂(NSAI)带来的获益仍在持续扩大:其5年无浸润性疾病生存率(iDFS)由对照组的81.0%显著提升至85.5%,绝对获益值从3年时的2.7%提升至4.5%[1];其中亚洲人群的复发风险降低达37%[2]。
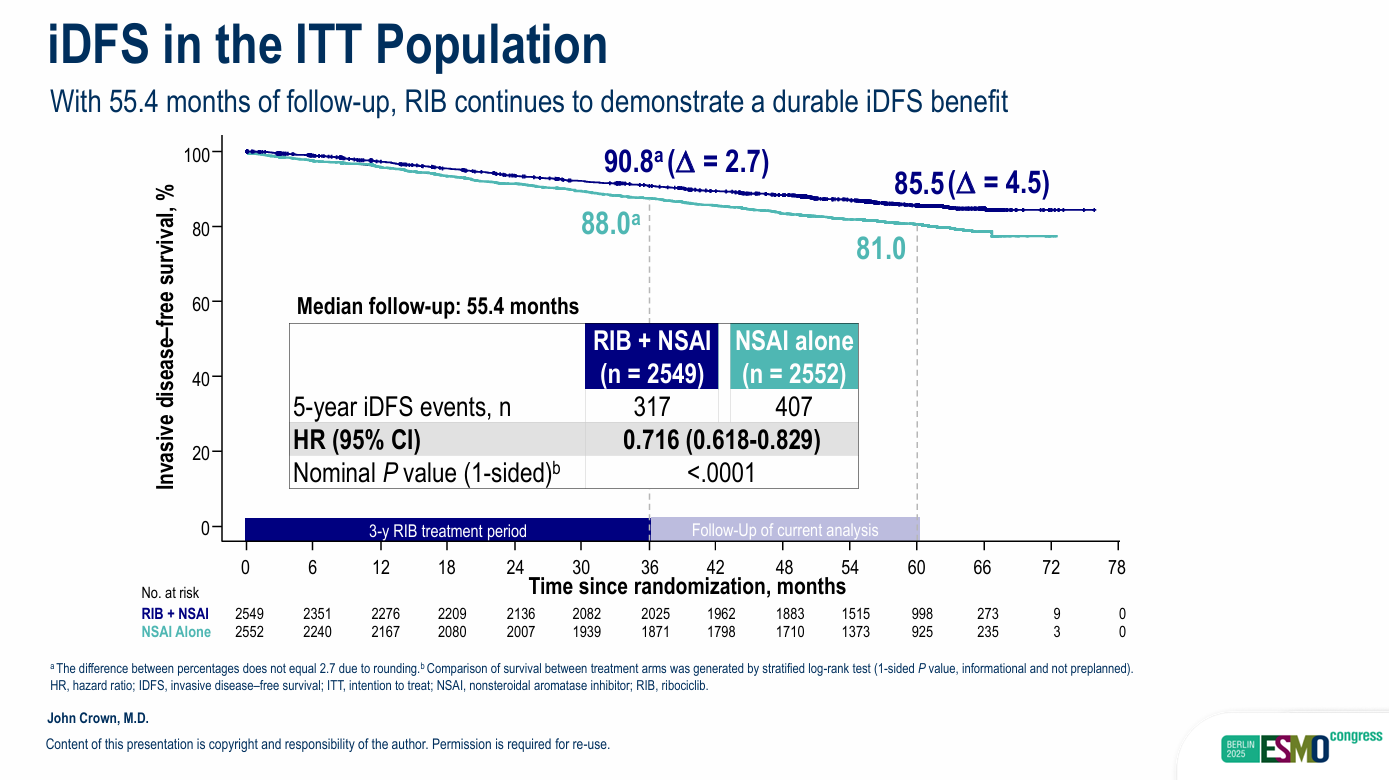
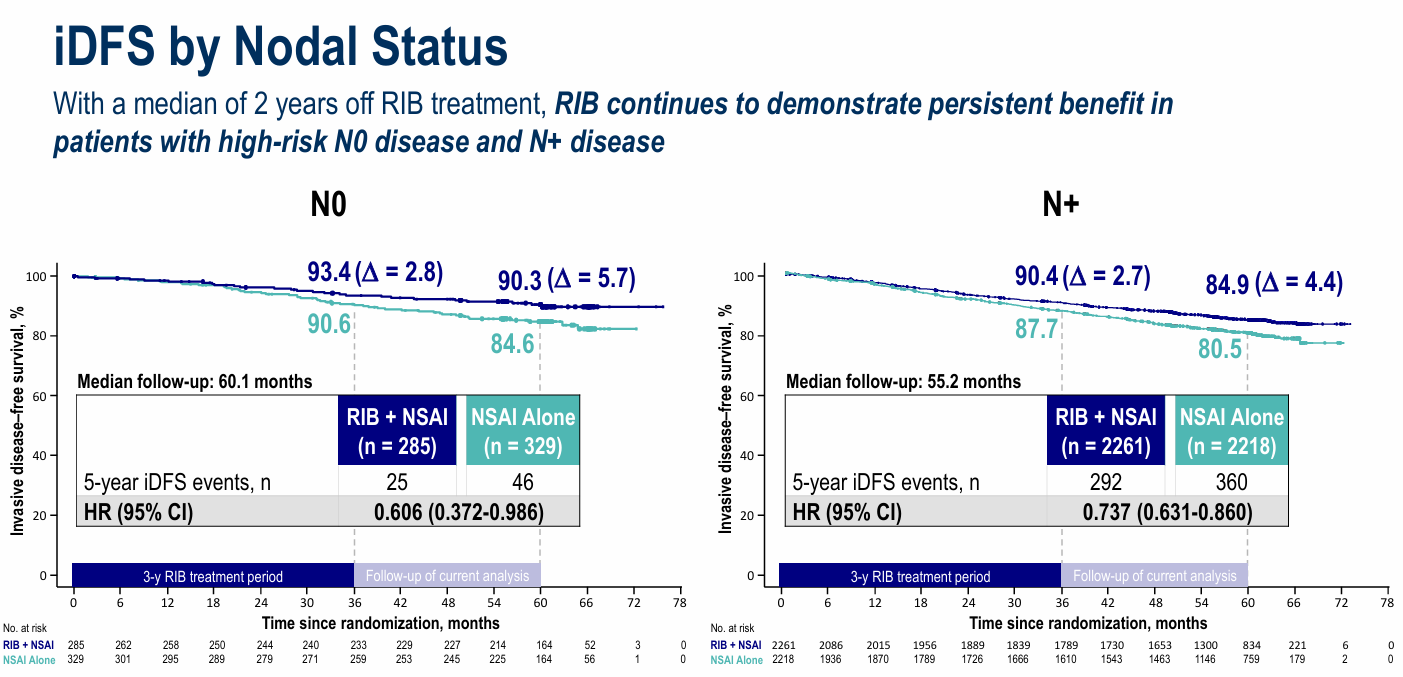
值得关注的是,在N0高危亚组中,瑞波西利联合AI已展现出明显获益趋势,风险比(HR)达0.606,置信区间上限首次小于1,这不仅为N0高危患者提供了优选治疗方案,也改写了辅助治疗的临床评价标准。
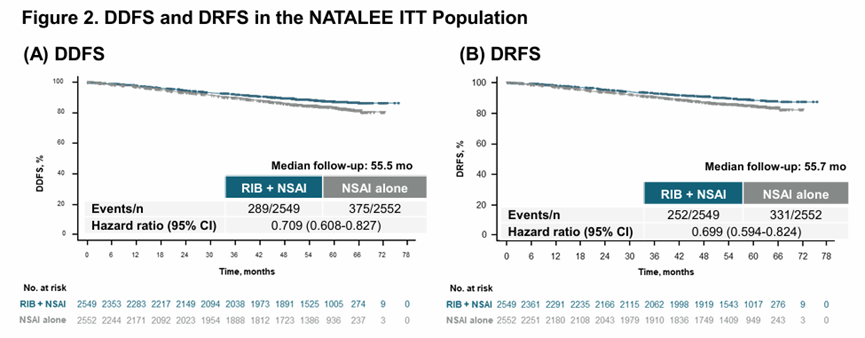
同时,瑞波西利联合AI使远处转移生存率(DDFS)风险降低约30%(HR=0.709)[3],意味着更多患者在瑞波西利的助力下正迈向临床治愈。
晚期乳腺癌:长生存数据的持续刷新
SABCS发布的MONALEESA系列研究汇总分析,首次提出长期响应(LTR,无进展生存期>4年)与超长响应(VLTR,无进展生存期>5年)的概念。数据显示,一线接受瑞波西利治疗的患者中,近1/4实现了LTR,绝经后人群中更有1/5实现了VLTR[4]。这种长达5年以上的无进展生存,使晚期乳腺癌的“慢病化”管理真正落到实处。即便初始伴有肝转移或高肿瘤负荷的高危患者,在强效CDK4/6抑制剂的一线干预下,仍有相当比例能进入VLTR行列。
指南与共识更新:权威背书——确立标准治疗地位
无论是早期降低复发,还是晚期实现超长响应,瑞波西利凭借唯一的全人群OS疗效与生活质量获益证据,成为连接早期治愈与晚期慢病管理的桥梁。基于这些坚实证据,全球权威指南在2025年进行了重磅更新:
《中国临床肿瘤学会(CSCO)乳腺癌诊疗指南(2025版)》推荐中、高复发风险HR+/HER2-早期乳腺癌患者(包括NATALEE研究全人群)采用AI联合瑞波西利的辅助强化治疗方案(Ⅱ级推荐,1B类证据);同时维持了瑞波西利在晚期解救内分泌一线治疗的I级推荐(1A类证据)[5]。
《中国抗癌协会/中华医学会肿瘤学分会乳腺癌诊疗指南与规范(2026版)》对瑞波西利的推荐等级进一步明确:在HR+/HER2-早期乳腺癌人群中,“推荐”瑞波西利联合AI(绝经前需同时联合卵巢功能保护药物)用于中危且pN1及高危人群——其中对于高危人群,瑞波西利的等级提升至“推荐”;同时“考虑”瑞波西利用于中危且pN0人群[6]。针对HR+/HER2晚期乳腺癌的解救治疗,“推荐”使用瑞波西利联合AI方案[6]。
《NCCN乳腺癌临床实践指南2025 V5 版》将瑞波西利联合AI标注为1类首选推荐,推荐范围明确覆盖淋巴结阳性及高危淋巴结阴性患者[7]。
在2025年11月落幕的ABC8国际共识会议上,全球专家以极高支持率通过投票,重申CDK4/6抑制剂联合内分泌治疗是一线治疗的标准方案,并特别强调:对于HR+/HER2-晚期患者,即便存在内脏转移,只要未达到“内脏危象”程度,以内分泌为基础的方案仍应作为优选,且绝经前患者在一线使用CDK4/6抑制剂的获益尤为显著。
基于NATALEE和MONALEESA-7研究,瑞波西利成为欧洲肿瘤内科学会临床获益量表(ESMO-MCBS)目前唯一在早期及晚期HR+/HER2-乳腺癌领域均获得最高评分的CDK4/6抑制剂 [8]。
临床实践分享:极高负荷晚期乳腺癌
的治疗转归
患者女性,44岁。
现病史:2023年4月因“咳嗽、咳痰、憋气”于外院就诊。CT检查显示:左肺结节,双肺感染及右侧胸腔积液。予抗感染及引流胸水,引流出1400ml血性胸水。
乳腺彩超显示:左乳实性结节,BI-RADS 5级。
复查胸部CT显示:左乳腺癌并肺内多发转移,左腋窝及锁骨上淋巴结转移,胸椎椎体及肋骨多发骨转移,双侧胸膜腔积液、胸膜增厚,肝多发转移可能。经乳腺穿刺、胸膜活检、胸水病理确诊左乳腺癌伴多发转移。
既往史:既往体健。
婚育史:适龄结婚,未育。
家族史:二姑肺癌,大伯直肠癌,否认乳腺癌及卵巢癌家族史。
查体:ECOG 1级,全身皮肤黏膜无皮疹、黄染及出血点。右锁骨上可触及肿大淋巴结,大小约为1.5×1.5cm,左锁骨上可触及肿大淋巴结,大小约为3×3cm,左腋下可触及肿大淋巴结大小约为2.5×2.5cm,均质硬固定无明显触痛,余浅表淋巴结未及肿大。左乳内上象限可触及肿物,大小约为3×4cm,质地硬,固定,无明显触痛,左乳头内陷,右中下肺及左下肺叩诊浊音,右中下肺及左下肺呼吸音弱,右肺可闻及胸膜摩擦音。
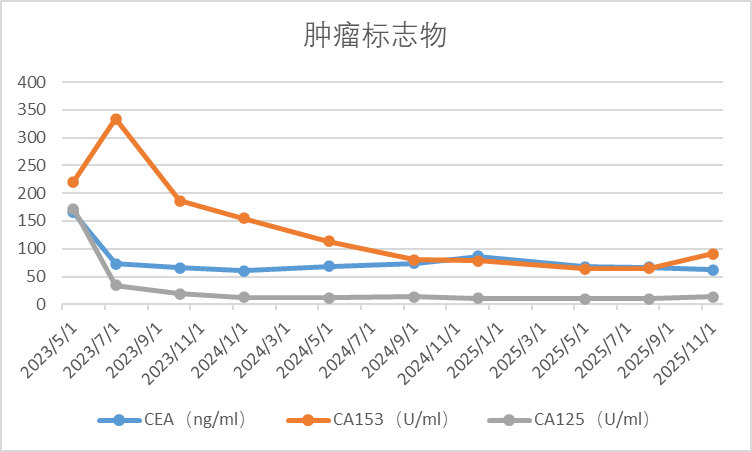
肿瘤标志物:2023-5-8化验显示:CEA 165.2ng/ml↑,CA153 220.3U/ml↑,CA125 172.1U/ml↑,肝功能 AST:87IU/L↑。
病理检查:
(乳腺结节穿刺):乳腺浸润性癌,Ⅱ级,免疫组化:ER+++95%,C-erbB-2 1+,Ki67+10%,PR+++95%
(壁层胸膜):可见癌浸润,结合病史及免疫组化符合乳腺癌转移;免疫组化:ER+++95%,Ki67+30%,C-erbB-2 1+,PR+++95%
(胸水):考虑腺癌。
影像学检查:
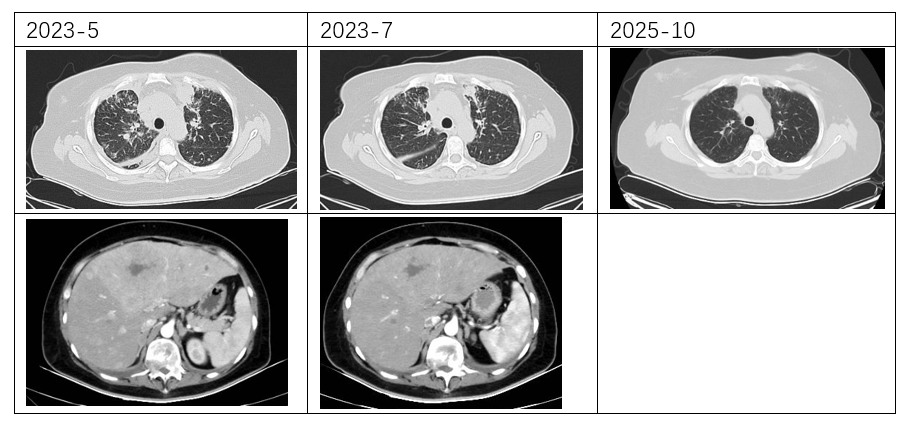
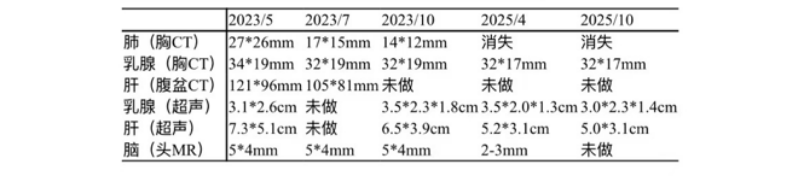
超声(2023-5基线):左乳11点见低回声占位,约3.1cm×2.6cm,边界不清、形态不规则,内见丰富血流信号,BI-RADS 6类;右乳片状低回声区,建议密切观察。双锁骨上区见低回声占位(左侧约1.8cm×1.5cm,右侧约2.4cm×1.1cm),左腋下见2.1cm×0.9cm低回声淋巴结,均考虑转移。肝体积增大、回声欠均匀,内见多发稍高回声占位(部分内见无回声区),较大约7.3cm×5.1cm,边界不清,考虑转移。
胸部CT(2023-5基线):双肺见多发结节(较大者约7mm×7mm),考虑转移;另见多发类结节影(较大者约27mm×26mm,内可疑支气管气象),需鉴别转移或实变。双肺轴心间质增厚,伴多发小叶间隔增厚,符合癌性淋巴管炎表现。双侧胸膜增厚、胸腔积液,考虑转移。双侧锁骨上区、纵隔多组、双侧内乳区、左腋下及腹膜后见多发肿大淋巴结(较大者约20mm×11mm),考虑转移。胸廓骨多发转移;T2、T12椎体压缩骨折。左乳结节约34mm×19mm,考虑恶性。
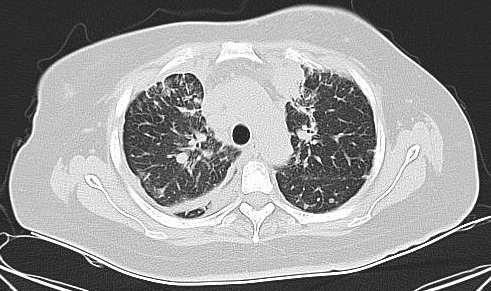
腹部CT(2023-5基线):肝脏体积增大,实质内弥漫多发稍低密度结节/肿物(部分可疑融合),较大约121mm×96mm,内见低密度坏死区;增强扫描动脉期高强化,门脉期强化稍减低,考虑转移。肝右后叶下方见11mm×10mm软组织密度结节,脾内见36mm×30mm稍低强化肿物(边界均不清),均考虑转移。双侧肾上腺不均匀增粗,伴15mm×8mm低强化结节,转移可能大。右肾微小囊肿。胆囊、胰腺、左肾未见异常。膀胱部分充盈,壁无明显增厚。左侧附件区形态饱满、强化欠均匀,转移待除外;子宫及右侧附件区未见异常。肝门区及腹膜后见26mm×17mm肿大淋巴结,考虑转移。腹腔、双侧髂血管旁及腹股沟区无肿大淋巴结,无腹盆积液。
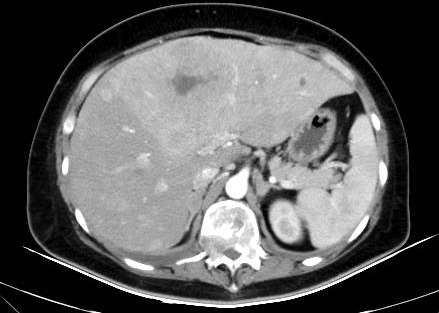
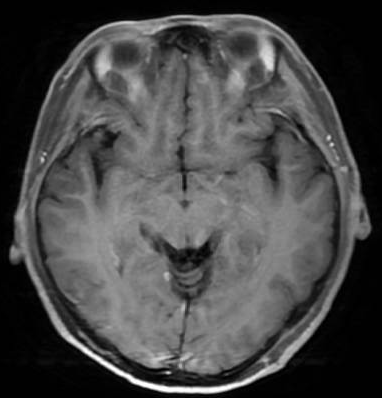
颅脑MR:双侧大脑半球脑回表面及小脑幕区见多发强化结节灶,最大约5mm×4mm,考虑肿瘤转移;小脑及脑干形态、信号未见明显异常;中线结构居中,各脑室系统无扩张,脑沟、脑裂无增宽。颈椎及顶骨骨质呈不均匀异常强化,考虑骨转移。
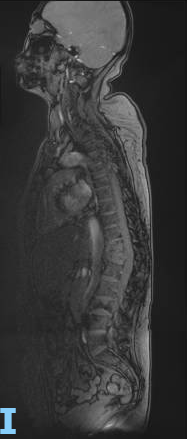
脊柱MR:T11-12、L3椎体发生压缩性骨折,考虑骨转移所致,T12椎体挤压椎管狭窄、变形。T8-L4多发转移。
诊断:左乳腺浸润性癌 cT2N3M1 IV期 Luminal A型 肺转移 骨转移 胸膜转移 胸腔积液 肝转移 脾转移 肾上腺转移可能 左附件转移可能 脑转移
治疗方案:
2023年5月开始治疗:瑞波西利(600mg,d1-21,每28天为一周期)+依西美坦(25mg,每日1次)+戈舍瑞林(3.6mg,每28天1次)。
疾病转归:
治疗仅8周后,复查胸CT、腹盆CT、头MR、肿瘤标志物,评效结果为缩小的SD,肿瘤标志物下降,肝功能恢复正常。基线27mm的肺部病灶在持续治疗中不断缩小,至2025年4月CT复查完全消失,并维持至今。脑转移灶5mm缩小至2-3mm。
复查胸部CT、腹盆CT、颅内MR、肿瘤标志物显示,疾病至今未进展。治疗不良反应为白细胞及中性粒下降1-2度,停药期间可恢复,无药物剂量调整。
专家点评——全方位证据链下的临床洞察
从PFS获益到OS金标准的跨越——为何一线必须选“最强”?
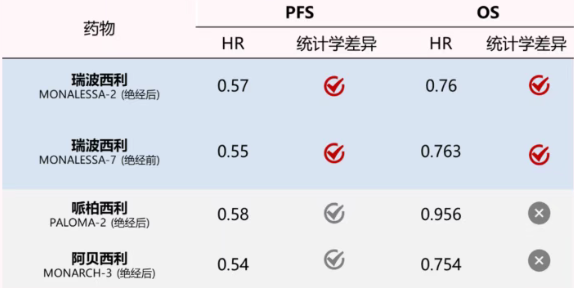
在晚期HR+乳腺癌的一线治疗决策中,OS是这一评估药物价值的“金标准”。本例中,44岁绝经前患者伴脑、肝、骨多处高危转移,预后风险极高。瑞波西利是目前唯一在绝经前(MONALEESA-7[9])、绝经后(MONALEESA-2[10])、一线及二线应用中均被证实具有统计学显著性OS获益的CDK4/6抑制剂。一线使用瑞波西利,能最大程度确保患者获得初始治疗的最佳收益,在疾病早期就给予最强效干预,避免因过早进展而丧失后续治疗机会。
“3+1”间歇给药:VLTR背后的临床智慧
2025年SABCS提出的VLTR概念,意味着晚期患者的用药时长将跨越5年甚至更久。在漫长的抗癌过程中,药物耐受性直接决定治疗能否持续获”。瑞波西利独特的间歇给药模式(3周用药、1周停药),不仅保证了剂量强度,更兼顾了机体免疫调节——为骨髓母细胞等正常组织提供了宝贵的修复窗口,显著降低了持续性疲劳、慢性腹泻等不良反应对患者日常生活的干扰。对于进行“慢病化”管理的晚期患者,良好的治疗体验和可控的安全性,是实现5年甚至更长生存期的基础。本例患者近30个月疗程中始终无需减量,正是瑞波西利高耐受性与高依从性的最佳体现,也是实现LTR/VLTR的基石。
高负荷人群的理念革新:从“被动化疗”到“主动干预”
对于本例中伴12cm肝转移及胸水的患者,既往临床上多倾向首选以化疗为主的挽救治疗方案。然而,最新的ABC8共识及《内脏转移及危象专家共识》正推动理念转变:从被动处理危象转向主动预防危象[11]。瑞波西利在MONALEESA-2和MONALEESA-7的内脏转移亚组中,均展现出无疾病进展生存期(PFS)翻倍延长及确证的OS获益,其缩瘤效果甚至超越化疗。本病例的疾病转归再次印证:当患者分子分型明确为HR+/HER2-,瑞波西利联合方案应作为治疗首选,以实现短期症状缓解与长期生存获益的双重保障。同时,对于本例伴多处椎体骨折的骨转移患者,瑞波西利能有效控制全身肿瘤负荷、稳定骨转移灶,间接降低骨相关事件(SREs)的发生风险——不仅延长了患者的生存实践,更通过维护骨骼稳定性和机体功能,大幅提升了患者的生存质量。
*声明:瑞波西利的注册研究结果未涉及侵袭性疾病患者的有效性和安全性数据
*NCCN指南唯一:联合AI
[1] Adjuvant ribociclib (RIB) plus nonsteroidal aromatase inhibitor (NSAI) in patients (pts) with HR+/HER2− early breast cancer (EBC): NATALEE 5-year outcomes.2025 ESMO LBA14.
[2] Analysis of Asian patients (pts) with HR+/HER2− early breast cancer (EBC) treated with ribociclib (RIB) + nonsteroidal aromatase inhibitor (NSAI): 5-year outcomes from NATALEE. 2025 ESMO Asia. LBA1.
[3] Five-Year Analysis of Distant Disease-Free Survival Across Key Subgroups From The Phase 3 NATALEE Trial of Ribociclib Plus a Nonsteroidal Aromatase Inhibitor in Patients with HR+/HER2− Early Breast Cancer. 2025 SABCS. Poster PS3-09-08.
[4] Razavi et al. 2025 SABCS, Poster PD5-10.
[5] 中国临床肿瘤学会. CSCO乳腺癌诊疗指南(2025版).
[6] 中国抗癌协会乳腺癌专业委员会/中国抗癌协会. 乳腺癌诊治指南与规范 (2026年版).
[7] National Comprehensive Cancer Network. (2025). NCCN Clinical Practice Guidelines in Oncology (Version 5.2025).
[8] Oosting SF, et al. Ann Oncol. 2023 Apr;34(4):431-439.
[9] Tripathy D, et al. Lancet Oncol. 2018.
[10] Hortobagyi GN, et al. N Engl J Med. 2022.
[11] 健康中国研究中心癌症防治专家委员会. 中华医学杂志,2025.
[12] Lu YS, et al. Clin Cancer Res. 2022;28(5):851-859.
[13] Johnston S, et al. NPJ Breast Cancer.2019 Jan 17;5:5.
[14] Richard S. Finn,et al. N Engl J Med 2016;375:1925-1936.
[15] Bishal Gyawali, et al. Nat Rev Clin Oncol. 2022 Oct;19(10):613-614.
[16]https://www.esmo.org/guidelines/esmo-mcbs/esmo-mcbs-scorecards/scorecard-158-1. [MONALEESA-7].
[17]https://www.esmo.org/guidelines/esmo-mcbs/esmo-mcbs-for-solid-tumours/esmo-mcbs-scorecards?scorecard=468. [NATALEE].
[18]https://www.esmo.org/guidelines/esmo-mcbs/esmo-mcbs-scorecards/scorecard-7-1. [PALOMA-2].
[19]https://www.esmo.org/guidelines/esmo-mcbs/esmo-mcbs-scorecards/scorecard-159-1. [MONARCH 3].
[20] Lu YS, et al. J Clin Oncol. 2024;42(23):2812-2821.
排版编辑:肿瘤资讯-小九











 苏公网安备32059002004080号
苏公网安备32059002004080号


