约50%的初诊弥漫大B细胞淋巴瘤(DLBCL)患者接受R-CHOP方案一线治疗可获得治愈 ,但复发/难治(R/R)患者预后较差,治愈性治疗方案有限[1]。既往研究显示,持续缓解时间(DoR)与总生存期(OS)密切相关[2],可能是预测DLBCL治愈可能性的关键指标。坦昔妥单抗(Tafasitamab)作为全球首个靶向CD19的Fc段增强型单克隆抗体,联合来那度胺在不适合移植的R/R DLBCL患者中展现出超长DoR优势。L-MIND研究数据显示,坦昔妥单抗治疗二线患者客观缓解率(ORR)达67.5%,完全缓解(CR)率52.5%,中位DoR仍未达到,5年DoCR率高达80.7%[3,4]。真实世界RE-MIND-2研究证实其OS(31.6-34.1个月)和DoR(26.1个月)显著优于传统方案[5]。本文基于现有循证证据,探讨坦昔妥单抗通过延长持续缓解时间提升R/R DLBCL治愈可能性的临床价值。
一、DLBCL治疗现状与持续缓解时间的临床意义
1.1 一线治疗失败后的严峻挑战
DLBCL是最常见的侵袭性非霍奇金淋巴瘤亚型。R-CHOP方案虽为一线标准治疗,但仍有约50%患者将面临复发或难治,即使接受化疗和自体造血干细胞移植(ASCT)仍有约50%的患者在移植后复发[1]。更值得关注的是,70%的复发发生在诊断后1年内,而1年内无复发患者5年复发风险可降至13%,2年无复发则进一步降至8%,与正常人群死亡风险相当[6]。这表明持续缓解时间是预测DLBCL治愈可能性的核心指标。
1.2 DoR作为OS替代终点的价值
在血液肿瘤新药研发中,由于OS受后续治疗干扰且随访周期长,监管部门普遍采用无进展生存期(PFS)等替代终点。近年有研究显示,DoR在预测OS获益方面优于PFS和ORR,能更灵敏地反映免疫治疗的长期疾病控制能力[2]。对于R/R DLBCL患者,治疗后2年维持缓解状态是判断潜在治愈的重要指标。
二、R/R DLBCL的分层治疗策略
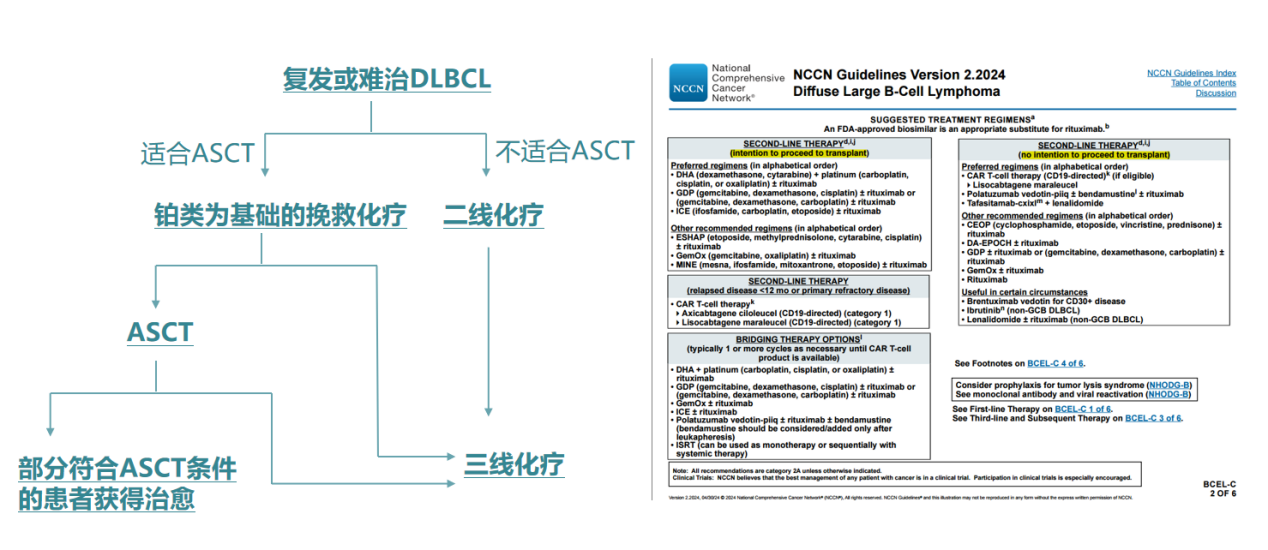
2.1 适合移植患者的治疗瓶颈
大剂量化疗联合ASCT是R/R DLBCL的主要治疗手段,但并非所有患者都适合该治疗方案,仅可挽救30%-40%初治治疗后复发的DLBCL患者[7]。西班牙Geltamo数据库显示,接受ASCT的791例患者中,6年PFS率为51%,OS率63%[8]。但临床实践中,因年龄、体能状态及医疗资源限制,实际移植比例更低,大量患者未能从该策略中获益。
2.2 不适合移植患者的未满足需求
对于不适合ASCT的患者,传统化疗优化空间受限。新型治疗方案Pola-BR(维泊妥珠单抗+苯达莫司汀+利妥昔单抗)治疗不适合移植患者DoR为10.9个月[9]。Glofitamab联合GemOx在III期STARGLO研究中获得25.5个月的中位OS,但100%患者在研究期间至少发生过一次不良事件[10]。 CAR-T产品在二线治疗中相比传统标准治疗中位无事件生存显著更优,达10.1个月,但48%的患者出现严重不良事件,可及性和毒性是限制其广泛应用的因素[11]。
三、坦昔妥单抗的作用机制与优势
坦昔妥单抗是一种人源化Fc段增强型抗CD19单克隆抗体,具备三重抗肿瘤机制[12-14]:
直接诱导凋亡:特异性结合CD19诱导B细胞凋亡
免疫介导杀伤:通过抗体依赖性细胞介导的细胞毒性(ADCC)和吞噬作用(ADCP)清除肿瘤细胞
协同增效:与来那度胺联用可进一步增强ADCC效应
这种独特的机制设计使其在清除残留病灶、维持长期缓解方面具有理论优势。
四、关键循证证据
4.1L-MIND研究:5年长期随访数据
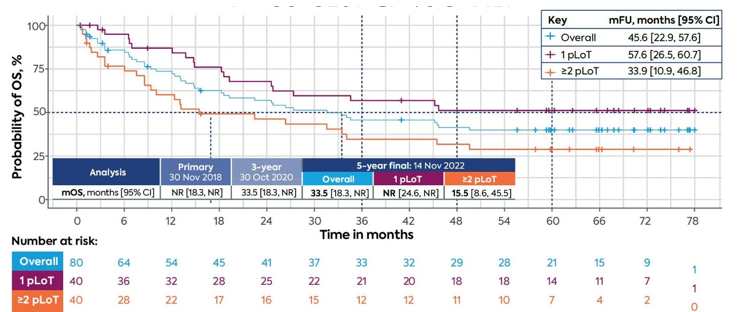
L-MIND是一项单臂II期研究,旨在评估坦昔妥单抗联合来那度胺治疗不适合ASCT的R/R DLBCL患者疗效,5年随访数据显示(中位随访44个月)[4]:
ORR 57.5%(CR 41.3%,PR 16.3%),二线患者ORR达67.5%(CR率52.5%)
中位PFS 11.6个月,二线治疗患者长达23.5个月
中位OS 33.5个月,二线治疗患者尚未达到
中位DoR仍未达到(95% CI: 33.8–NR),中位DoCR未达到)
5年DoCR率高达80.7%(95% CI: 59.1–91.6)
该研究数据显示,获得CR的患者具有较高的长期缓解维持率,提示潜在治愈可能。
4.2 RE-MIND-2真实世界研究
通过倾向性评分匹配,将L-MIND患者与真实世界接受系统治疗(BR、R-GemOx等)的R/R DLBCL患者对比[5]:
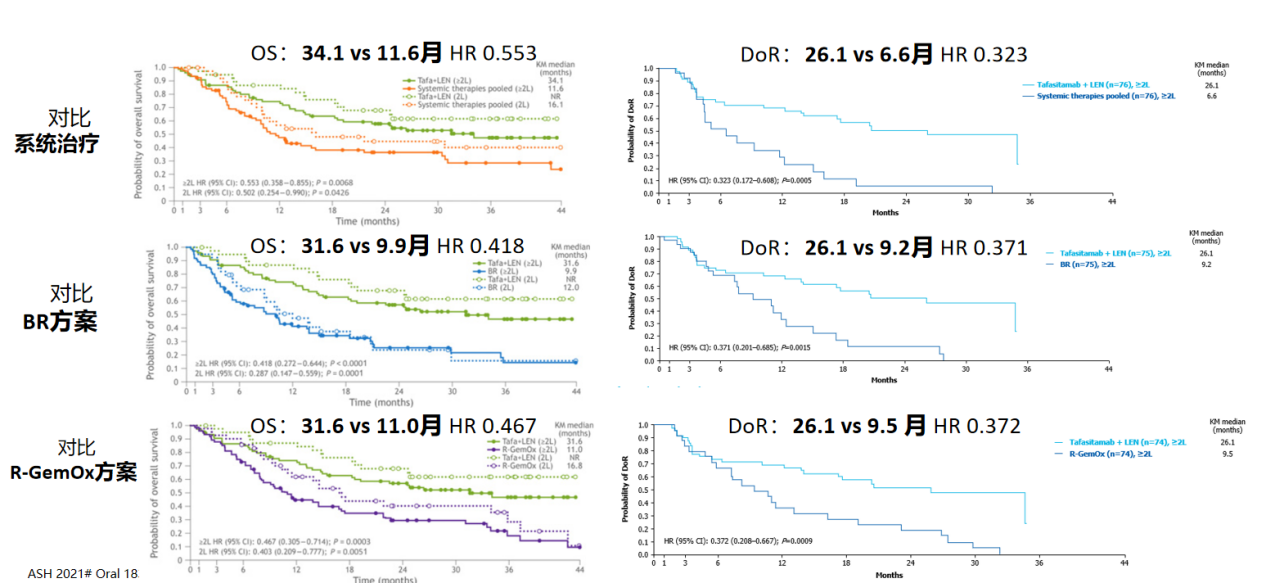
OS显著延长:34.1个月 vs 11.6个月(系统治疗),HR 0.553
DoR提升近4倍:26.1个月 vs 6.6-9.5个月
五、指南推荐与临床实践
基于L-MIND研究的卓越数据,坦昔妥单抗联合来那度胺获:
NCCN指南:R/R DLBCL二线优选推荐[15]
CSCO指南:R/R DLBCL二线I级推荐[16]
该方案为不适合移植或拒绝移植的患者提供了无需化疗、可门诊给药的治愈性治疗选择。
六、总结与展望
DLBCL一线治疗失败后,延长持续缓解时间是实现治愈的关键路径。坦昔妥单抗凭借独特的CD19靶向机制和Fc段增强设计,在不适合移植的R/R DLBCL患者获得较好的DoR,已获得国内外指南一致推荐。未来需进一步探索:
一线治疗中联合R-CHOP的协同价值(FRIST-MIND研究已显示ORR 93.9%)[17]
固定周期治疗后停药的可行性(SMART-STOP研究显示固定疗程治疗可获得良好的疗效)[18]
在中国人群中的验证性数据
坦昔妥单抗的出现,正将R/R DLBCL从"姑息治疗"推向"追求治愈"的新纪元。
[1] Crump M, Neelapu SS, Farooq U, et al. Outcomes in refractory diffuse large B-cell lymphoma: results from the international SCHOLAR-1 study. Blood . 2017;130(16):1800-1808.
[2] Hu C, et al. JAMA Netw Open. 2021 May 3;4(5):e218175.
[3] J. Duell et al. Poster: 323. LCML 2023
[4] Duell J, González-Barca E, Fusté P, et al. Five-year follow-up of the phase II L-MIND study of tafasitamab + lenalidomide in patients with relapsed/refractory diffuse large B-cell lymphoma. Haematologica . 2024;109(2):553-566.
[5] Nowakowski GS, et al. Clin Cancer Res. 2022 Sep 15;28(18):4003-4017.
[6] Maurer MJ, Ghesquieres H, Jais JP, et al. Event-free survival at 24 months is a robust end point for disease-related outcome in diffuse large B-cell lymphoma treated with immunochemotherapy. J Clin Oncol . 2014;32(10):1066-73.
[7] Cabanillas F, Shah B. Management of Relapsed or Refractory Diffuse Large B-Cell Lymphoma in the Era of Novel Therapies. Clin Lymphoma Myeloma Leuk . 2017;17(12):783-796.
[8] Bento L, Gutiérrez A, Magnano L, et al. Autologous Stem Cell Transplantation for Relapsed/Refractory Diffuse Large B-Cell Lymphoma: Real-World Data From the Spanish GETH-TC/GELTAMO Registry. Blood . 2023;142(Supplement 1):786.
[9] Sehn LH, Herrera AF, Matasar MJ, et al. Polatuzumab vedotin plus bendamustine and rituximab in relapsed/refractory diffuse large B-cell lymphoma: updated results of a phase Ib/II randomized study. Blood Adv . 2022;6(2):533-543.
[10] Dickinson M, Carlo-Stella C, Morschhauser F, et al. Glofitamab plus gemcitabine and oxaliplatin (Glofit-GemOx) versus rituximab plus GemOx in relapsed or refractory diffuse large B-cell lymphoma (STARGLO): a phase 3, randomised, open-label trial. Lancet . 2024;404(10466):1940-1954.
[11] Kamdar M, Solomon SR, Arnason J, et al. Lisocabtagene maraleucel versus standard of care with salvage chemotherapy followed by autologous stem cell transplantation in patients with relapsed or refractory large B-cell lymphoma (TRANSFORM): results from an interim analysis of an open-label, randomised, phase 3 trial. Lancet . 2022;399(10343):2294-2308.
[12] Horton HM, Bernett MJ, Pong E, et al. Potent in vitro and in vivo activity of an Fc-engineered anti-CD19 monoclonal antibody against lymphoma and leukemia. Cancer Res . 2008;68(19):8049-8057.
[13] Woyach JA, Johnson AJ, Byrd JC. The B-cell receptor pathway: a novel target for the treatment of B-cell malignancies. Blood . 2014;124(23):3553-3560.
[14] Jurczak W, Zinzani PL, Grosicki S, et al. Phase IIa study of tafasitamab (MOR208), an Fc-enhanced humanized anti-CD19 monoclonal antibody, in relapsed or refractory B-cell non-Hodgkin lymphoma. Ann Oncol . 2018;29(6):1266-1272.
[15] National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology: B-Cell Lymphomas, Version 5.2024.
[16] Chinese Society of Clinical Oncology. CSCO Guidelines for Diagnosis and Treatment of Lymphoid Malignancies 2024.
[17] Zinzani PL, Flinn I, Cencini E, et al. A phase 1b study of tafasitamab plus lenalidomide and rituximab in untreated diffuse large B-cell lymphoma (FIRST-MIND). Clin Cancer Res . 2021;27(22):6124-6134.
[18] Westin J, et al. SMART-STOP: A study of time-limited tafasitamab + R-CHOP in newly diagnosed diffuse large B-cell lymphoma. Oral presentation at: 65th ASH Annual Meeting; 2023. Abstract 856.
排版编辑:肿瘤资讯-Hanna











 苏公网安备32059002004080号
苏公网安备32059002004080号


