不可切除肝细胞癌(HCC)是全球最常见的恶性肿瘤之一,预后较差,主要归因于晚期诊断和高复发率。因此,临床迫切需要新的分子标志物和治疗靶点以改善HCC的早期诊断和治疗效果。热休克蛋白(HSPs)是维持细胞稳态的分子伴侣。其中,HSPH1(又名HSP110)已被报道在多种癌症中过表达并与不良预后相关。然而,HSPH1在HCC中的生物学作用和临床意义仍不清楚。为了解决这一临床需求,一项综合性研究利用生物信息学分析和实验验证,系统地评估了HSPH1在HCC中的表达模式、临床相关性、预后价值以及潜在的生物学功能,旨在确定HSPH1作为HCC潜在预后生物标志物和治疗靶点的价值。
研究背景
HCC是全球癌症相关死亡的主要原因之一。尽管治疗有所进步,但其总体预后仍然不佳。HSPs是高度保守的分子伴侣,在细胞应激条件下保护和重折叠受损蛋白。HSPH1(热休克蛋白家族H成员1)属于HSP110家族,是HSP70的核苷酸交换因子。
HSPH1已被证实参与肿瘤细胞的增殖、分化、侵袭和转移。泛癌转录组学分析显示HSPH1在多种癌症中高表达,并与不良预后相关。虽然HSP70和HSP90在HCC中的作用已得到充分研究,但HSPH1在HCC中的具体表达特征和临床意义尚未明确。
研究方法
研究设计与数据来源
本研究采用综合分析方法,结合了生物信息学分析和实验验证。研究从The Cancer Genome Atlas(TCGA)数据库获取了HCC的转录组学和临床数据。同时,从Gene Expression Omnibus(GEO)数据库下载了两个独立的微阵列数据集(GSE14520 和 GSE76427)用于进一步分析和验证。
临床样本与患者队列
研究纳入了2015年5月至2019年12月在南通大学附属医院住院的85例HCC患者。纳入标准包括:(1)经组织病理学确诊为HCC;(2)年龄18至90岁;(3)符合根治性手术切除条件,且术前未接受新辅助放化疗;(4)无重大手术禁忌证;(5)无已知内分泌或代谢紊乱;(6)无精神疾病史。所有患者均获得了配对的肿瘤组织和癌旁非肿瘤肝组织。本研究获得了南通大学附属医院伦理委员会的批准(批准号:LS20150623)。
生物信息学分析
差异表达与分期分析:使用UALCAN和GEPIA2在线平台比较HSPH1在HCC和正常肝组织中的mRNA表达,并评估其与临床肿瘤分期(I-IV期)的关联。
生存分析:利用Kaplan-Meier Plotter、GEO数据集和TCGA数据(通过GEPIA2)评估HSPH1表达与总生存期(OS)和无病生存期(DFS)之间的关系。
功能富集分析:通过基因集富集分析(GSEA)和KEGG通路分析,鉴定与HSPH1高低表达相关的信号通路。
免疫浸润分析:采用CIBERSORT算法和TIMER数据库,评估HSPH1表达与HCC肿瘤微环境中22种免疫细胞表型浸润水平的相关性。
实验验证
细胞系:使用正常人肝细胞系LO2作为对照,以及四种HCC细胞系(Huh7, MHCC97H, Hep-3B, SK-HEP-1)进行体外实验。
蛋白表达检测:使用Western blot和免疫组织化学(IHC)技术检测HSPH1蛋白在临床样本和细胞系中的表达水平。免疫荧光(IF)用于观察HSPH1的亚细胞定位。
功能实验:使用siRNA技术在Huh7和Hep3B细胞中敲低HSPH1的表达。通过CCK-8增殖实验和集落形成实验评估HSPH1对HCC细胞增殖和克隆形成能力的影响。
统计学分析
使用IBM SPSS 25.0进行统计分析。卡方检验用于分类变量关联性分析。Kaplan-Meier法和log-rank检验用于生存分析。采用单变量和多变量Cox回归模型评估预后因素,P值<0.05(在多变量分析中为<0.6)被认为具有统计学意义。
研究结果
HSPH1的定位、表达、疾病关联和泛癌分析
HSPH1是HSP110家族成员,位于13号染色体q12.3区域。根据NCBI基因数据库,该基因编码一种参与蛋白质稳态的分子伴侣。细胞器数据库预测HSPH1主要定位于细胞质和细胞核(图1A和B)。比较毒理基因组学数据库(CTD)显示HSPH1与肝癌、乳腺癌、皮肤癌等多种癌症存在关联(图1C)。此外,通过计时器数据库利用TCGA数据进行的泛癌转录组分析表明,HSPH1在乳腺癌、头颈部鳞状细胞癌和肾透明细胞癌等多种肿瘤类型中表达水平升高(图1D)。
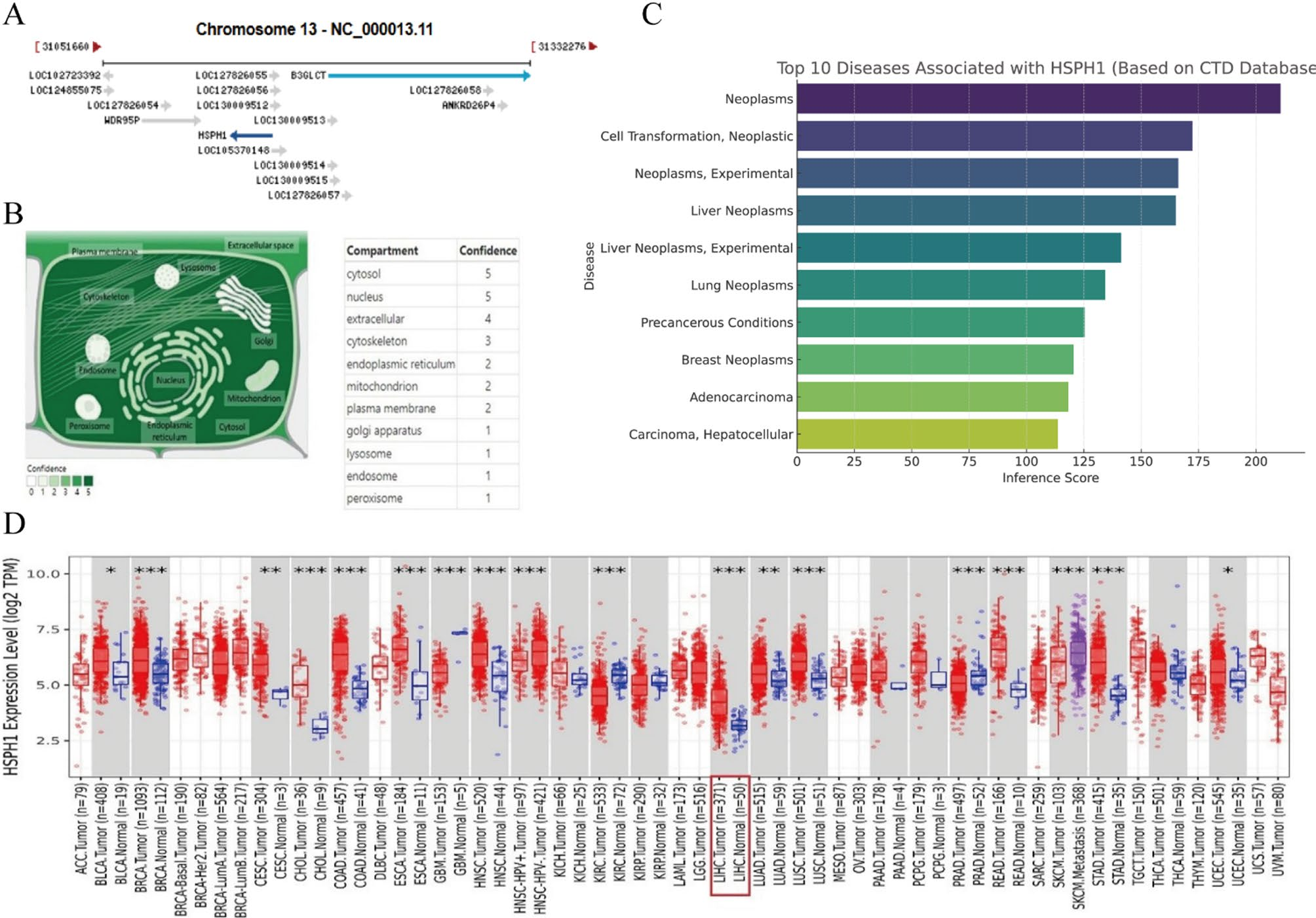 图1 HSPH1的定位、表达、疾病关联和泛癌分析
图1 HSPH1的定位、表达、疾病关联和泛癌分析
HSPH1在HCC中高表达且与晚期阶段相关
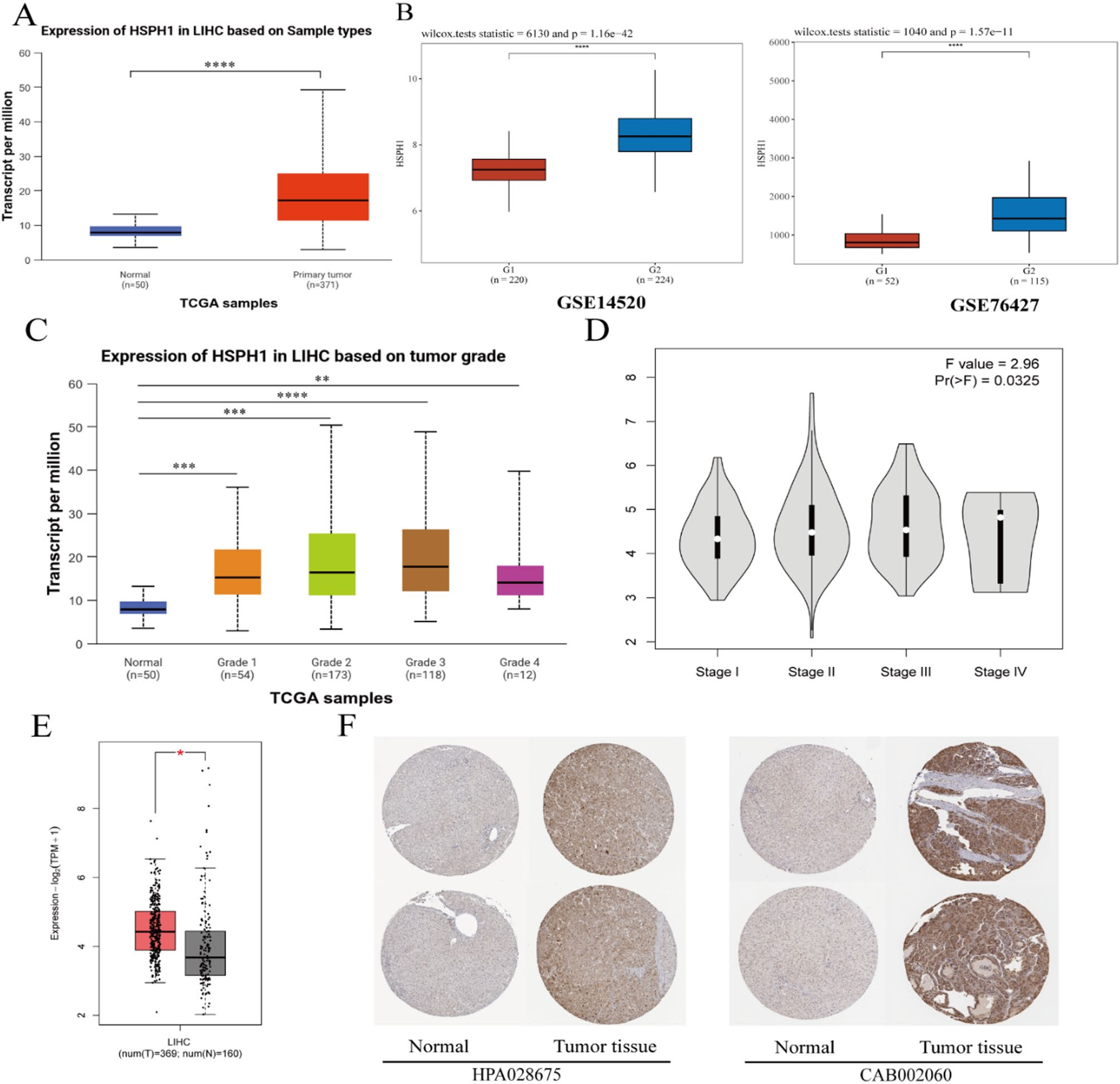
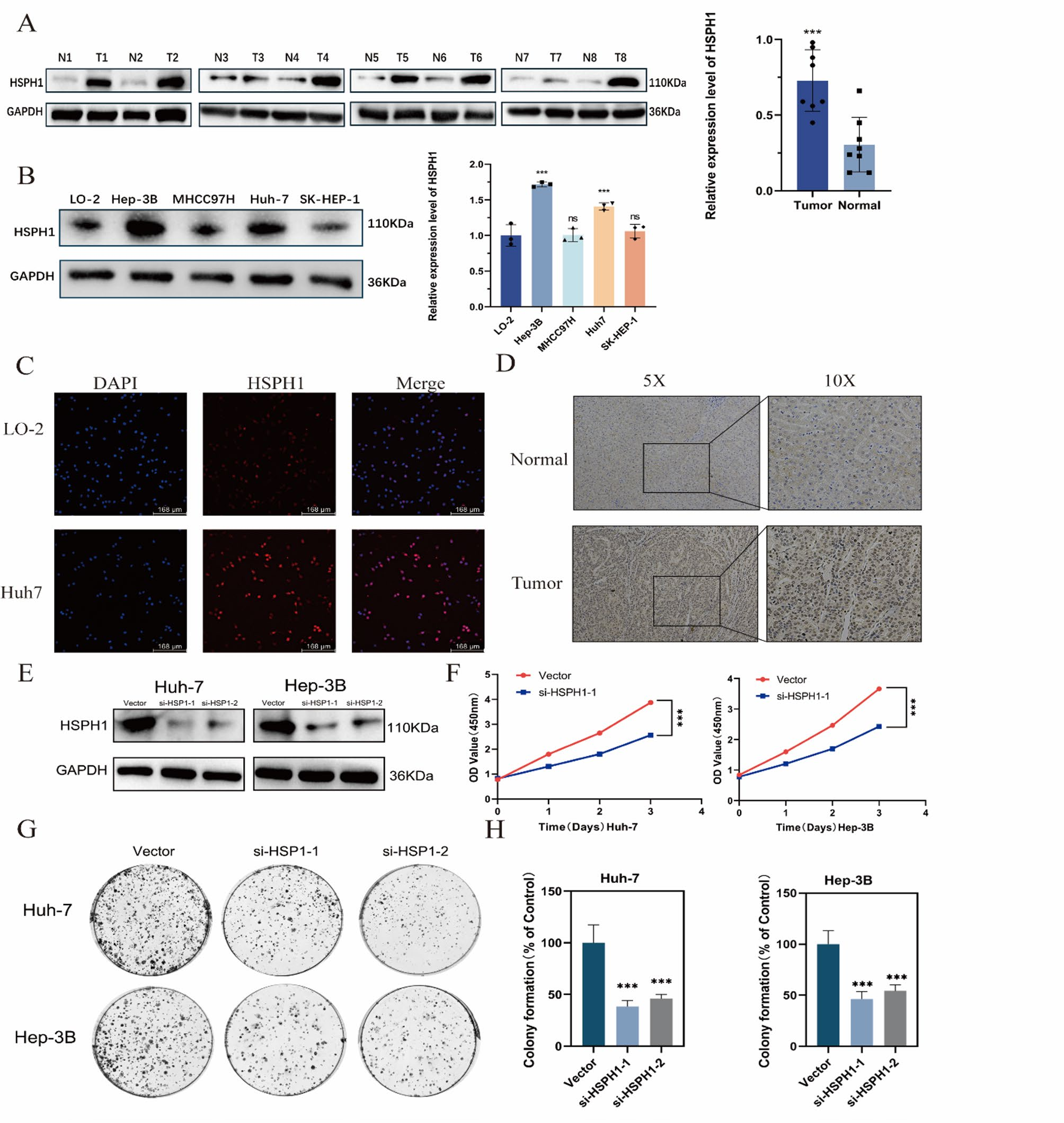
生物信息学分析(TCGA、GSE14520、GSE76427)和实验验证(Western blot、IHC)均一致证实,HSPH1在HCC组织和肝癌细胞系中的mRNA及蛋白水平均显著高于正常肝组织和正常肝细胞系。HSPH1的表达水平与HCC的临床分期(I-IV期)呈显著正相关,即肿瘤分期越晚,HSPH1表达越高。
HSPH1高表达预测HCC不良预后
Kaplan-Meier分析显示,无论是在KMplot数据库、GEO数据集(GSE14520, GSE76427)还是TCGA队列中,HSPH1高表达均与患者更短的总生存期(OS)和无病生存期(DFS)显著相关。
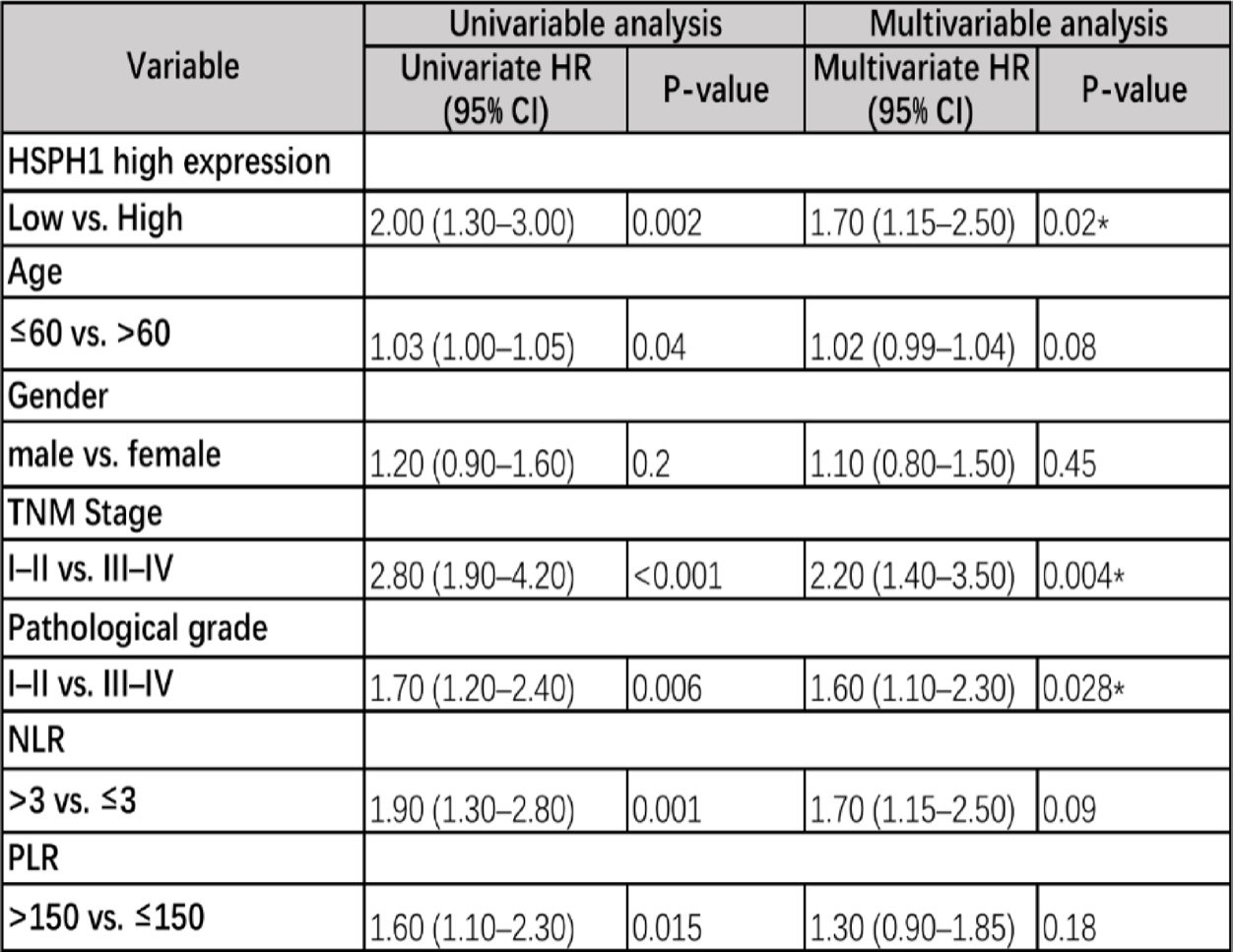
在纳入85例临床样本的分析中,单变量Cox分析显示,HSPH1高表达是OS的显著不良预后因素(HR=2.00, P=0.002)。多变量Cox分析进一步证实,HSPH1高表达(HR=1.70, P=0.02)以及晚期TNM分期和低病理分化是HCC患者OS的独立不良预后因素。
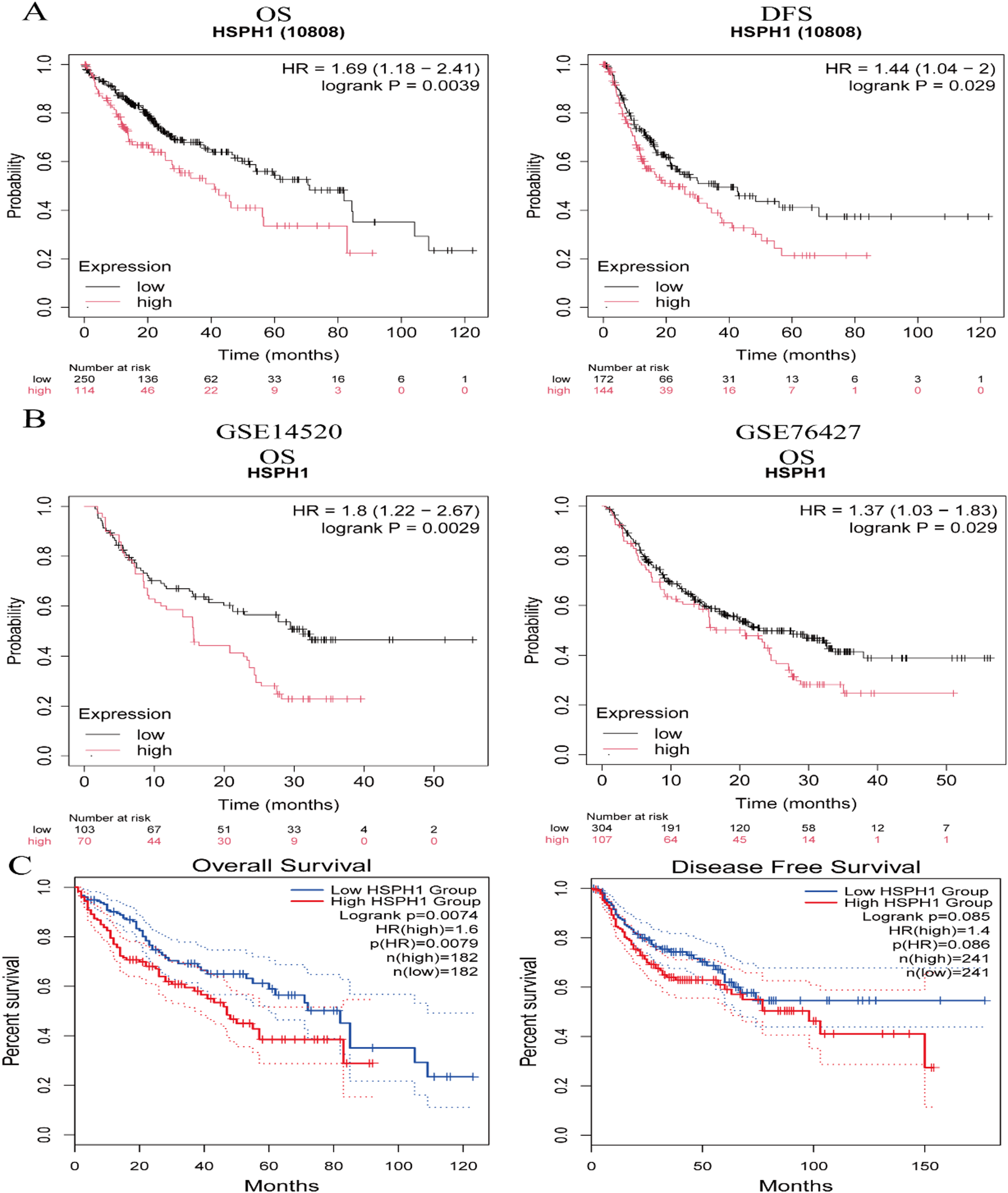
表1 HCC患者5年OS预后因素的单变量和多变量分析
HSPH1与HCC临床病理特征的关系
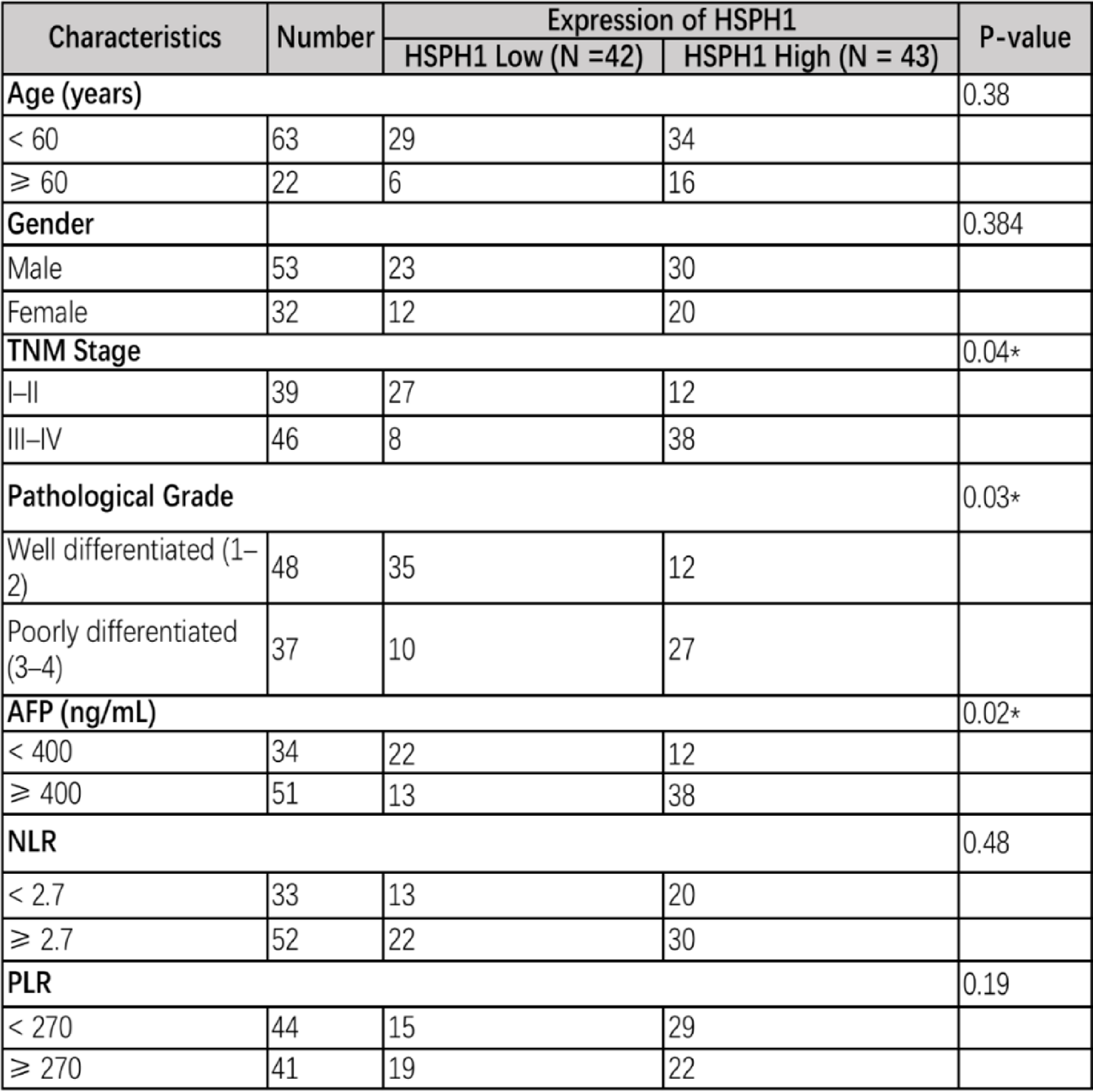
对85例临床样本的分析表明,HSPH1高表达与更晚的TNM分期(P=0.04)、更差的病理分化(P=0.03)以及更高的血清AFP水平(P=0.02)显著相关。
表2 HSPH1表达与HCC患者临床病理特征的关系
HSPH1的功能与通路分析
促进增殖:在Huh7和Hep3B细胞中敲低HSPH1后,细胞增殖能力(CCK-8检测)和集落形成能力均受到显著抑制。
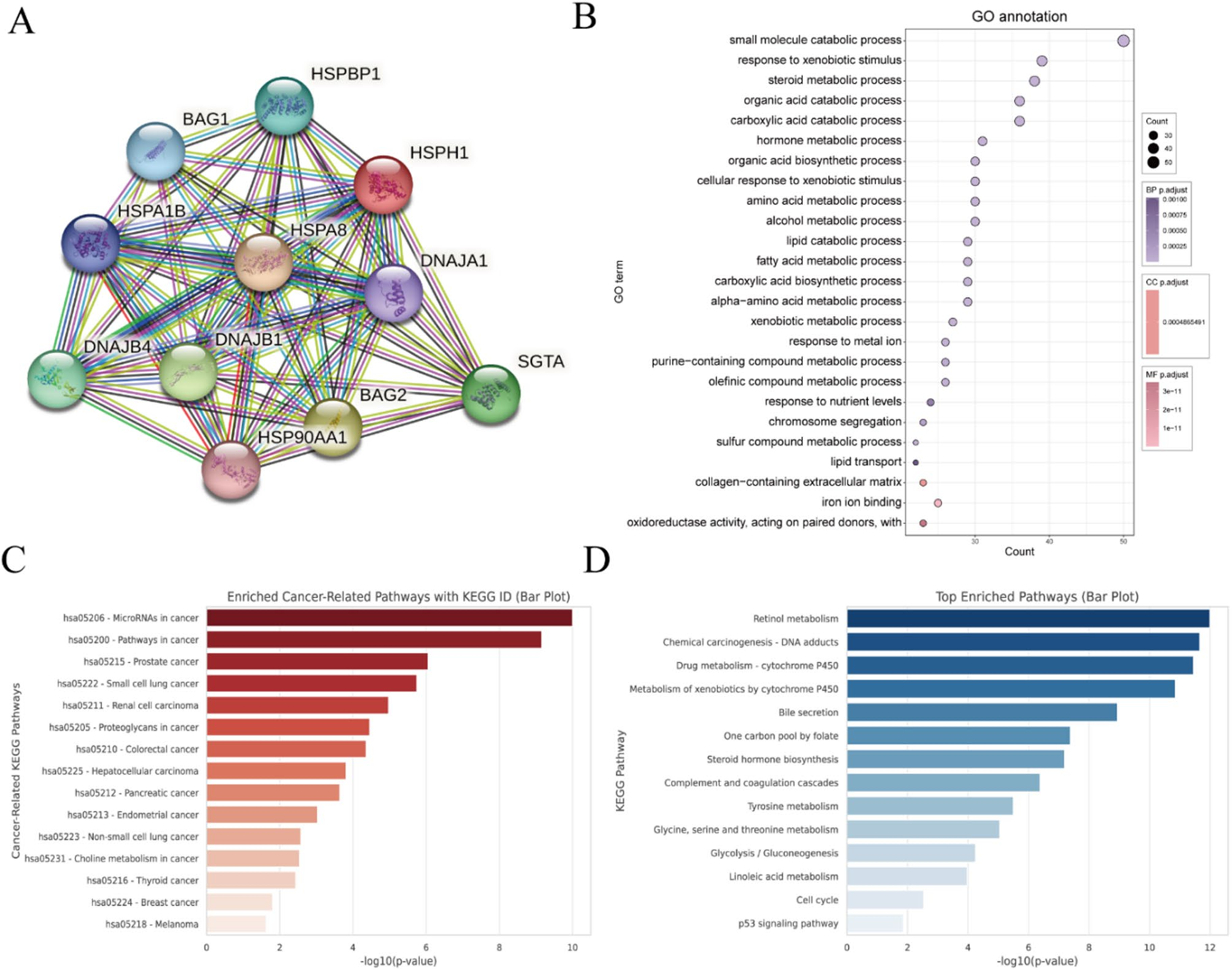
通路富集:GSEA分析显示,HSPH1高表达组显著富集于细胞增殖和基因组稳定性相关的通路,包括细胞周期、DNA复制和p53信号通路。
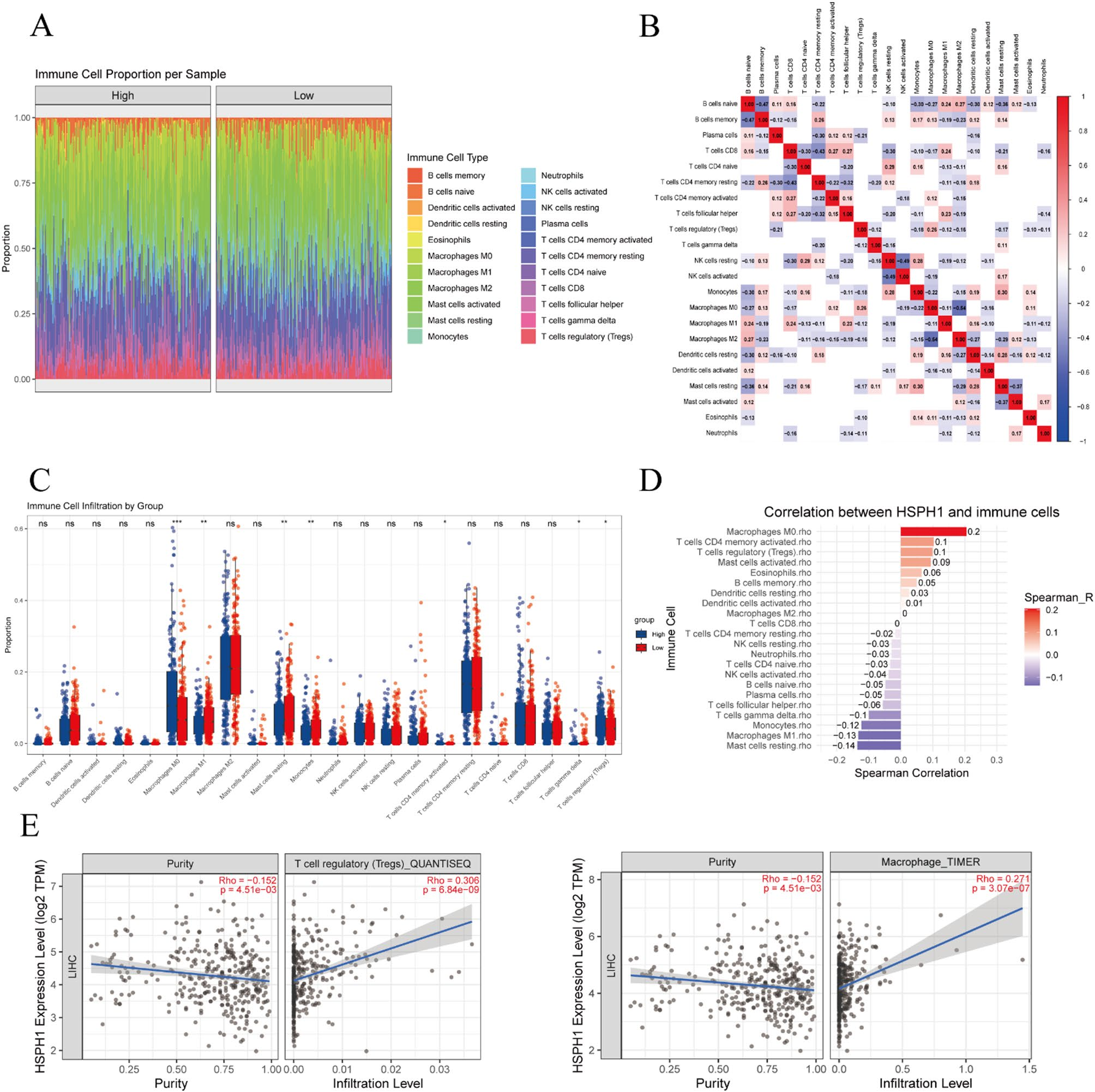
免疫浸润:免疫浸润分析显示,HSPH1的表达与多种免疫细胞的浸润水平相关。具体而言,HSPH1表达与激活的记忆CD4+ T细胞、M0巨噬细胞和M1巨噬细胞呈正相关,而与调节性T细胞(Tregs)、静息型肥大细胞和激活的NK细胞呈负相关。
结论
本研究通过生物信息学分析和实验验证,系统地证明了HSPH1在HCC组织和细胞系中均上调。临床上,HSPH1的高表达与晚期TNM分期、低病理分化等更具侵袭性的肿瘤特征相关,并且是HCC患者总生存期的独立不良预后指标。功能上,HSPH1通过参与细胞周期、DNA复制等通路促进HCC细胞的增殖,并可能通过调节巨噬细胞和调节性T细胞等来塑造免疫抑制性的肿瘤微环境。综上所述,HSPH1可作为HCC的候选预后生物标志物,并具有成为潜在治疗靶点的价值。未来需要更大规模的队列和更深入的机制研究来验证这些发现。
Huang T, Xu S, Li M, Lu C, Zhang J. Heat shock protein family H member 1 HSPH1 expression correlates with progression and prognosis of hepatocellular carcinoma. Sci Rep. 2025;15(1):31151. Published 2025 Aug 24. doi:10.1038/s41598-025-16843-3
审批编号:CN-171836 过期日期:2026-11-18
声明:材料由阿斯利康支持,仅供医疗卫生专业人士参考
排版编辑:肿瘤资讯-JYX











 苏公网安备32059002004080号
苏公网安备32059002004080号


