甲状腺癌发病率在全球范围内显著上升,其中甲状腺乳头状癌 (PTC) 最为常见。BRAF V600E 基因突变与PTC的侵袭性行为密切相关,其状态对制定确切治疗方案(如积极监测或手术干预)至关重要。
BRAF V600E检测多依赖侵入性活检。近期,福建医科大学团队最新研究提示,基于术前CT影像的纹理分析(特别是NDA方法)能够可靠地预测钙化性PTC中的BRAF V600E突变状态。值得注意的是,肿瘤的钙化区域同样可以用于预测突变,其诊断效能与实质区域相当。这一发现挑战了传统上在ROI勾画时避开钙化的做法,为PTC的非侵入性分子状态评估提供了新的思路。【肿瘤资讯】在此对该研究进行整理,以飨读者。

研究背景
甲状腺癌分子诊断的临床挑战
近几十年来,全球甲状腺癌的发病率呈显著上升趋势,其中超过80%的病例属于甲状腺乳头状癌(PTC)亚型。对于低风险的PTC,2015年美国甲状腺协会(ATA)指南已引入积极监测作为手术干预的安全替代方案。然而,对于高风险PTC,侵袭性的手术治疗仍是唯一可靠的选择。
BRAF V600E基因突变与PTC的发生发展密切相关,并驱动了更具侵袭性的肿瘤行为。因此,准确评估术前BRAF V600E突变状态对于制定明确的治疗决策至关重要。目前,BRAF V600E突变检测通常依赖于术前侵入性的细针穿刺活检(FNAB)样本或手术切除标本,但FNAB存在潜在的疼痛、出血和急性甲状腺肿胀等不良反应。
影像组学与纹理分析的优势
纹理分析(Texture Analysis, TA)作为一种成熟的技术,通过分析目标区域像素或体素灰度级的分布和关系,对肿瘤异质性进行定量分析。其核心优势在于能够从常规采集的医学影像中轻松获取纹理信息,无需额外的成像程序。越来越多的数据表明肿瘤异质性与不良的肿瘤生物学特性相关,TA已被应用于识别肿瘤分化程度、评估肿瘤特征和治疗疗效。
尽管已有少量研究利用纹理分析预测甲状腺癌的分子状态,但多数集中在超声图像上。虽然超声在甲状腺癌诊断中具有高敏感性和特异性,但也存在操作者和机器依赖性、图像数据有限以及特征代表性不足等局限性。相比之下,CT成像可以提供更直观、准确的信息,尤其在钙化灶(特别是大钙化和边缘钙化)的可视化方面表现突出。
研究目的
在进行纹理分析时,通常建议勾画感兴趣区(ROI)时排除钙化,尽管钙化在某些甲状腺肿瘤中普遍存在且对于区分良恶性肿瘤具有重要意义。然而,钙化灶的存在是否会影响纹理分析结果仍不确定,有待进一步研究。
本研究的主要目的是探讨基于术前CT影像的纹理分析在预测钙化性PTC中BRAF V600E突变的潜力,并比较不同纹理特征提取方法的诊断性能,同时探索肿瘤实质区域与钙化区域的预测效能差异。
研究材料与方法
研究对象与分组
本研究回顾性分析了两个医疗中心数据库中经手术病理证实为钙化性PTC的患者。共纳入600例行术前甲状腺CT扫描和BRAF V600E基因测序的患者,并根据以下标准进行排除:1)结节直径小于5mm;2)无钙化或不规则环形钙化,或钙化区域最大直径小于5mm;3)钙化伪影明显,影响观察和ROI勾画;4)多发甲状腺结节且病理与CT缺乏精确关联;5)伴有甲状腺炎或其他炎症病变;6)既往接受过临床干预。最终纳入475例患者。
来自第一个中心的375例患者按7:3的比例随机分为训练集和内部验证集,而来自第二个中心的100例患者则构成外部验证集。
CT检查
所有患者均接受了非增强和静脉期对比增强的64层螺旋CT扫描。增强扫描时,静脉注射75mL碘对比剂,流速3.5mL/s,静脉期扫描延迟设定为45-50秒。
纹理特征分析
由两位经验丰富的放射科医生(15年和8年)对所有CT图像进行回顾性分析。使用MaZda 4.6软件进行纹理分析。两位放射科医生达成共识,在肿瘤最大中央层面手动勾画实质区域ROI,并在最大钙化层面手动勾画钙化区域ROI。为减少伪影和对比剂影响,钙化区域ROI在非增强CT图像上勾画,而实质区域ROI在静脉期增强CT图像上勾画。
纹理分析(TA)分为三个步骤:
特征参数提取:MaZda软件采用六种分析方法(包括灰度直方图和绝对灰度梯度),从每个ROI中提取256个纹理特征参数。
相关特征选择:采用Fisher系数、POE+ACC(分类错误概率与平均相关系数组合)和MI(互信息)三种算法,每种算法选择10个最佳纹理特征参数。
降维与特征分类:采用主成分分析(PCA)、线性判别分析(LDA)和非线性判别分析(NDA)三种降维方法。软件基于降维结果对病灶进行分类,并计算预测BRAF V600E突变状态的错误率(R)。
为解决训练集中BRAF V600E突变阳性(n=162)和阴性(n=101)病例的类别不平衡问题,模型训练采用了加权交叉熵损失函数,权重与类别频率成反比。
统计学分析
采用SPSS、MedCalc和R软件进行统计分析。使用 ROC曲线评估联合参数的诊断性能,计算AUC、敏感性和特异性。使用Delong's test评估实质区域和钙化区域在诊断性能上的差异。P值 < 0.05 视为具有统计学意义。
研究结果
患者基线特征
训练集共263例,BRAF V600E阳性率为61.6%;内部验证集112例,阳性率为60.7%。两组在年龄、性别和突变率上无显著差异(P > 0.05)。外部验证集100例,阳性率为50%,与训练集在年龄、性别和突变率上均存在显著差异(均P < 0.001)。
纹理分析预测性能
不同纹理分析方法组合的BRAF V600E突变预测错误率(R)(表1、表2)显示:
NDA方法:无论在实质区域还是钙化区域,且无论结合哪种特征选择算法,NDA方法在三个数据集上均表现出卓越的诊断性能,R值低于10%。
LDA方法:表现出良好的诊断性能,R值低于25%。
PCA方法:表现较差,R值最高超过30%。
ROC曲线分析显示:
PCA方法的AUC范围为0.5至0.7。
LDA方法的AUC范围为0.7至0.94。
NDA方法的AUC均超过0.9。
最高的AUC值(0.969)出现在实质区域的POE+ACC联合NDA和钙化区域的MI联合NDA 组合中。
模型校准与临床效益评估
如图2和图3所示,最优预测模型(包括PTC实质区域和钙化区域的预测模型)在训练集上进行了校准曲线和决策曲线分析(DCA)评估,结果发现校准曲线紧密贴合理想曲线,表明模型具有高精度校准能力,证实了其在预测PTC中BRAF V600E基因突变方面的巨大潜力。DCA结果显示,在10%至90%的广泛阈值概率范围内,该模型提供了显著的临床净获益,优于“全部治疗”或“全部不治疗”这两种传统策略。
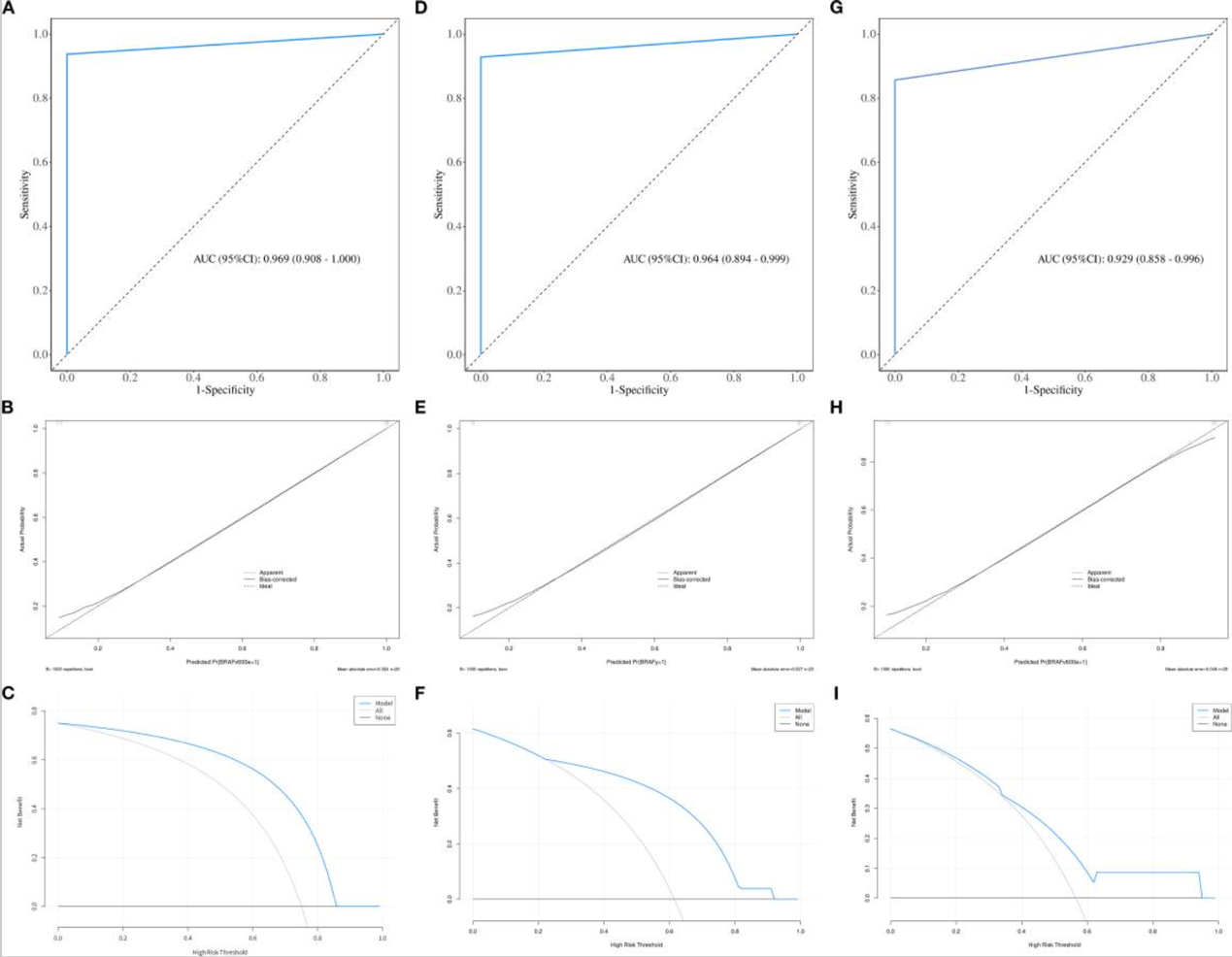
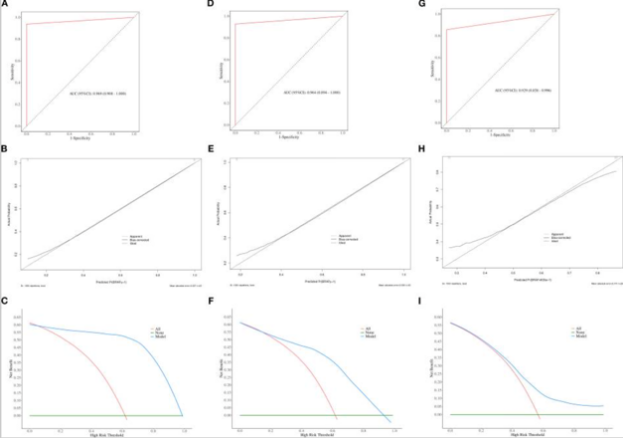
敏感性分析(稳健性评估)
为评估模型结论的稳健性,研究人员进行了敏感性分析,将采用加权交叉熵损失函数训练的模型与使用SMOTE*处理数据后训练的模型进行了比较。结果发现:
在独立的测试集上,两种模型的AUC-ROC(曲线下面积)无显著差异(分别为0.924和0.916)。
尽管SMOTE训练的模型在预测阴性病例的召回率上略有改善,但这一结果有力地表明,数据类别不平衡对我们的主要研究结论没有实质性影响。
研究讨论
非线性判别分析(NDA)的优越性
本研究证实,利用MaZda软件对PTC术前CT图像进行纹理分析能够有效预测BRAF V600E突变。其中,NDA方法在实质区域或钙化区域均表现出卓越的诊断性能。
我们推测NDA的优越性归因于其处理非线性数据的能力。BRAF V600E突变驱动丝裂原活化蛋白激酶(MAPK)信号通路的异常激活,涉及复杂的分子和细胞生物学效应,导致肿瘤高度异质性。由于肿瘤异质性和多因素关联,BRAF V600E突变相关的数据集具有非线性特征。NDA通过神经网络对数据进行非线性变换,将其投影到更低维度的特征空间进行线性分类,比线性分类器(如PCA、LDA)更适合此类数据集。
钙化区域的预测价值
多数影像组学研究强调在勾画ROI时避开钙化。然而,钙化在甲状腺肿瘤中普遍存在,且是重要的鉴别诊断指标。本研究创新性地分别在肿瘤实质区域和钙化区域勾画ROI进行分析,结果发现钙化区域的纹理分析同样可以用于预测BRAF V600E突变,且其诊断性能与实质区域无显著差异。
这一发现可能基于两个潜在的解释:首先,肿瘤细胞的快速增殖以及肿瘤本身分泌的糖蛋白和粘多糖,使得新血管生成和纤维组织容易发生钙盐沉积;其次,微钙化在PTC病例中可观察到50%,并已被证实是与BRAF V600E突变相关的重要因素。这提示我们在未来的影像组学实践中,对钙化区域的特征提取应给予充分重视。
局限性与展望
本研究存在一些局限性:首先,数据处理采用MaZda软件的默认格式,其对结果的影响需进一步研究。其次,研究对象仅限于大于5mm的结节和特定亚组(钙化性PTC),且排除了甲状腺炎等病变,限制了结果的普遍性。再次,纹理分析基于静脉期图像,尽管我们采用了标准化延迟时间(45-50秒),但延迟时间的变化对纹理特征和诊断性能的潜在影响仍需深入探究。最后,回顾性设计和CT扫描参数的差异可能引入测量偏差。未来的研究应通过前瞻性、多中心研究来进一步验证本研究的发现。
研究结论
本研究结论表明,利用MaZda软件对PTC术前CT图像进行纹理分析能够可靠地预测BRAF V600E突变的存在。其中,POE+ACC联合NDA或MI联合NDA的组合方法在预测BRAF V600E突变方面表现出最高的诊断性能。
肿瘤的钙化区域同样可用于预测BRAF V600E突变,且其诊断性能与实质区域无显著差异。这一结果为非侵入性评估PTC分子状态提供了新的方向,但仍需更大样本量的研究来进一步验证,以提升其潜在的临床应用价值。
Yongqin Chen, et al. CT-based texture analysis predicts BRAFV600E mutation in calcified papillary thyroid carcinoma.Front Oncol. 2025 Oct 22;15:1660725.
审批码TAC0056902-117536,有效期为2025-11-14至2026-11-13,资料过期,视同作废
排版编辑:肿瘤资讯-CYX











 苏公网安备32059002004080号
苏公网安备32059002004080号


