在德国柏林召开的2025欧洲肿瘤内科学会(ESMO)年会上,来自麻省总医院癌症中心的Samuel J. Klempner博士就胃食管癌(EGC)领域的下一代疗法(包括ADC、双特异性抗体、BiTEs和CARs)发表了专题演讲。【肿瘤资讯】整理了演讲的重要内容,以飨诸君。
EGC新疗法的III期临床研究概览
Klempner博士首先梳理了当前胃食管癌(EGC)领域中,除已获批药物(如T-DXd、卡度尼利单抗、维迪西妥单抗)外,正在进行的下一代疗法III期临床研究。数据显示,CLDN18.2和HER2是当下热门的靶点,而TOPO1正成为抗体药物偶联物(ADC)的主流载荷。
靶向CLDN18.2:AZD0901(MMAE)、IBI343(TOPO1)和SHR-A1904(TOPO1)等药物正在一线(1L)、二线(2L)或三线及以上(3L+)治疗中开展III期研究。
靶向HER2:SHR-A1811(TOPO1)、T-DXd(TOPO1)和RC48(MMAE)等正在1L或2L+治疗中,探索与化疗或PD-1抑制剂的联合应用。
其他靶点药物:靶向TROP2的MK-2870和靶向B7-H3的I-DXd分别在3L+和2L开展临床研究。
双特异性抗体:Rilvegostomig(PD-1/TIGIT双抗)正在HER2+人群中进行1L治疗的III期研究。
抗体药物偶联物(ADCs)的探索与突破
靶向CLDN18.2的ADCs
Klempner博士重点介绍了支持CLDN18.2 ADC进入III期临床的关键数据:
AZD0901(MMAE):作为一款CLDN18.2-MMAE ADC,其I期KYM901研究数据显示,在经治CLDN18.2高表达GC/GEJC人群(N=93例)中,确认的客观缓解率(cORR)为33%,其中2.2 mg/kg剂量组的cORR达47%,中位无进展生存期(PFS)为4.8个月,中位总生存期(OS)达11.8个月。
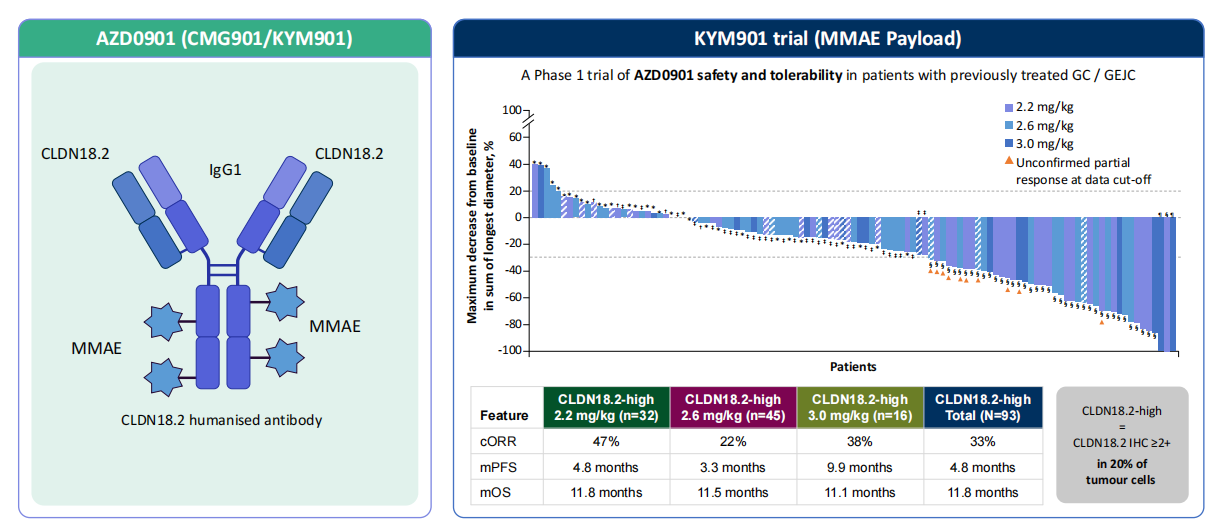
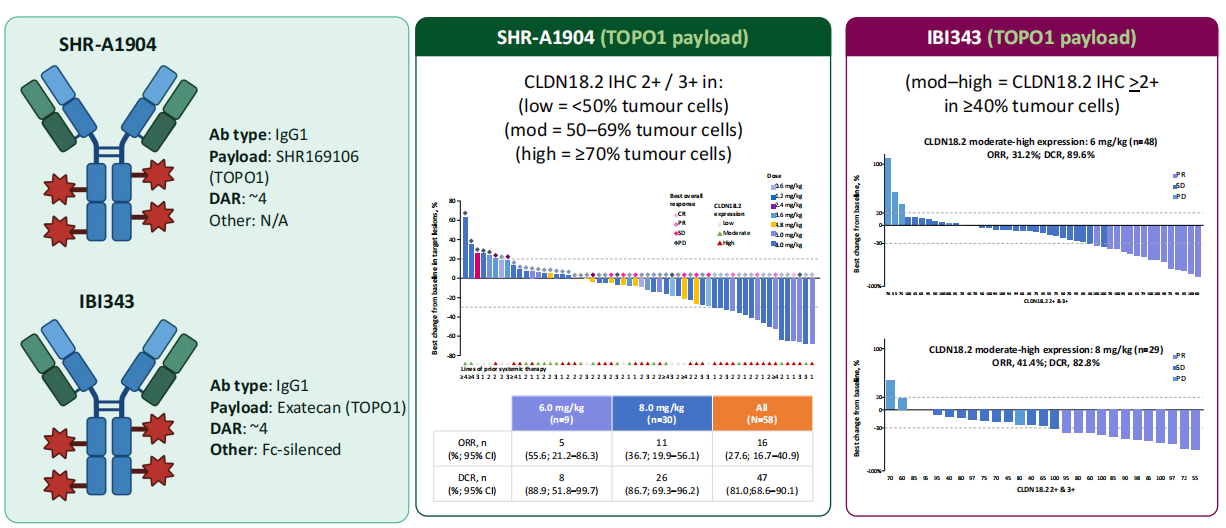
SHR-A1904(TOPO1):在58例患者中ORR为27.6%,在8.0 mg/kg剂量组中ORR为36.7%。
IBI343(TOPO1):在CLDN18.2中高表达人群中,6 mg/kg剂量组(n=48例)的ORR为31.2%,8 mg/kg剂量组(n=29例)的ORR达到41.4%。
生物标志物的重叠与空间异质性
Klempner博士指出,EGC的生物标志物(如dMMR、EBV+、HER2+、CLDN18.2+)存在明显重叠。例如,23.1%的HER2+肿瘤同时表达CLDN18.2。此外,肿瘤具有高度的空间异质性,不同靶点(HER2、CLDN18.2、MSLN)可能共存于同一细胞或相邻细胞。这提示,当前基于单克隆抗体研究设定的靶点阳性阈值,可能并非ADC、BiTEs或CARs等新疗法的最佳cut off值,而靶点共表达模式的影响仍亟待研究。
ADC的扩展策略
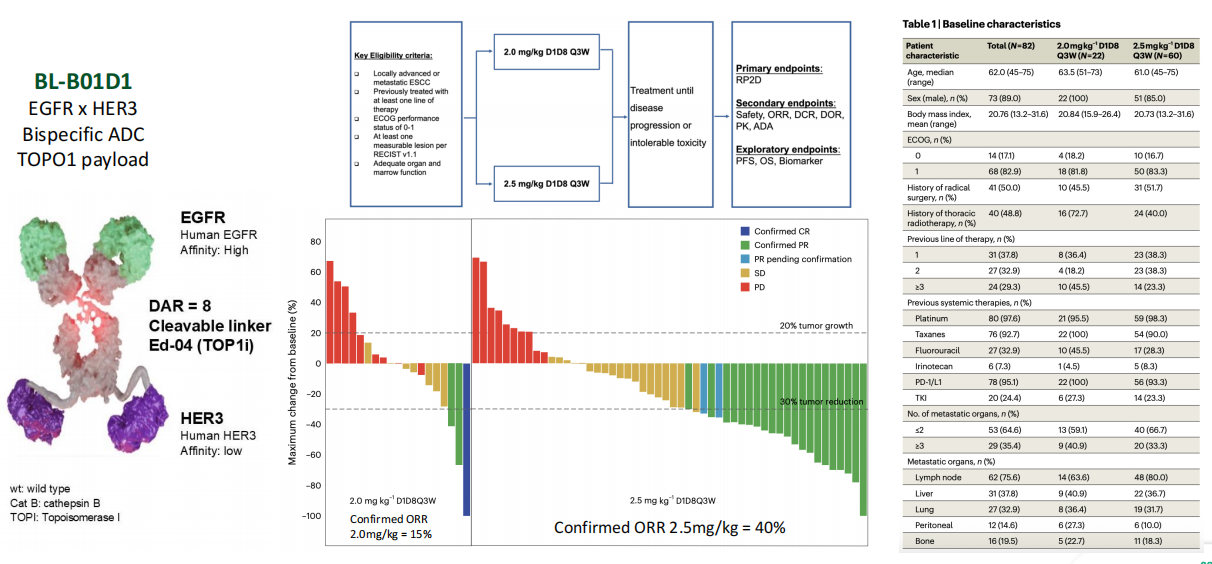
双特异性ADCs:旨在通过“A或B”靶向(扩大患者人群)或“A和B”靶向(增强特异性)来克服耐药。早期数据显示,BL-B01D1(EGFR/HER3双抗ADC,TOPO1)在既往经治的晚期食管鳞癌(ESCC)患者中,2.5 mg/kg剂量组的cORR达到了40%。
双靶位ADCs(Biparatopic ADCs):此类药物可结合同一靶点(如HER2)的两个不同表位,通过增强受体交联和内吞发挥作用。JSKN003(HER2双靶位ADC,TOPO1)在HER2 IHC 3+的GC/GEJ患者中(N=27例),ORR高达63%,mPFS达9.6个月(ASCO 2025)。
“点击化学”ADC(Click Chemistry ADC):TGW101作为一种靶向TAG-72(在胃癌中表达高达93%~97%)的“点击ADC”,采用两步给药策略:先输注靶向剂(diabody),待其在血液中清除、在肿瘤富集后,再输注“触发器”(即MMAE)。这种策略旨在大幅拓宽治疗窗口,实现精准的肿瘤内载荷释放。
双特异性抗体
Rilvegostomig(PD-1/TIGIT)
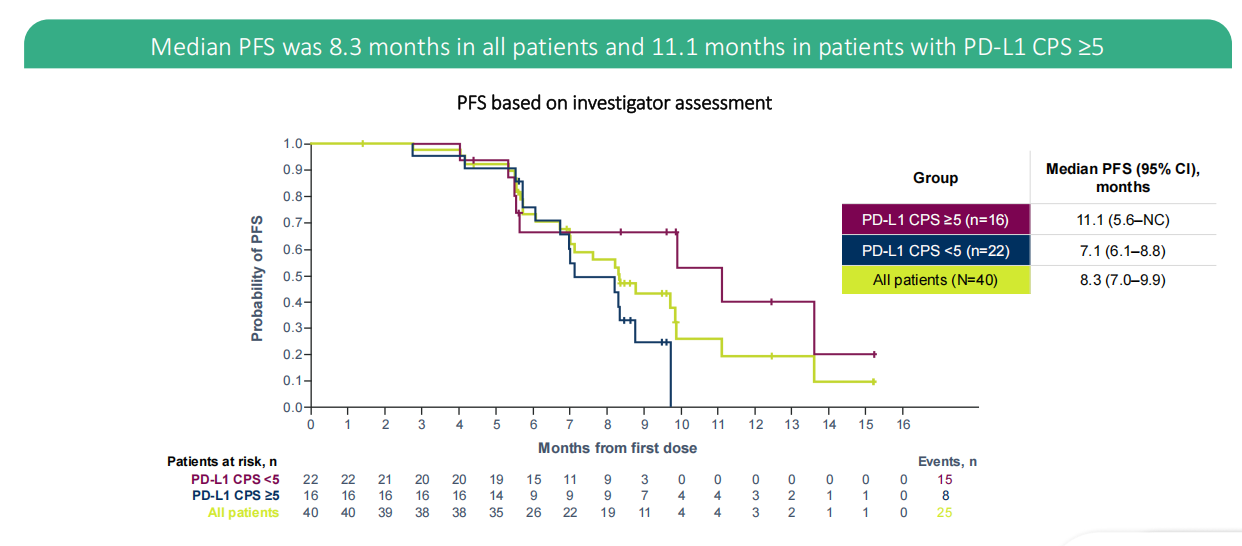
在HER2阴性GC/GEJ患者中评估Rilvegostomig联合化疗1L治疗疗效的II期GEMINI-Gastric研究显示,中位PFS在所有患者(N=40例)中为8.3个月,在PD-L1 CPS ≥5患者(N=16例)中达11.1个月。基于此,III期ARTEMIDE-Gastric 01研究正在1L HER2+/PD-L1 CPS≥1的人群中评估T-DXd联合Rilvegostomig和化疗的疗效。
Givastomig(CLDN18.2/4-1BB)
Givastomig被设计用于实现TME内“空间限制性”的T细胞活化,仅在CLDN18.2阳性肿瘤细胞存在时激活4-1BB,以避免全身毒性。I期研究数据显示(ESMO GI 2025),Givastomig联合FOLFOX和纳武利尤单抗一线治疗GC/GEJ患者(N=17例)的cORR高达71%。
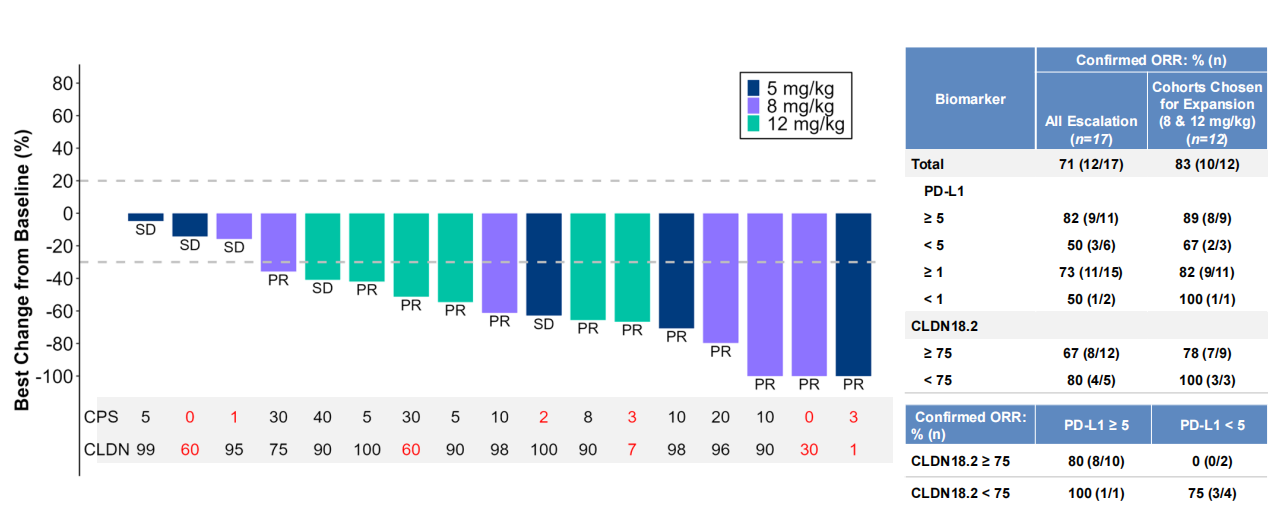
PD-1/VEGF双抗
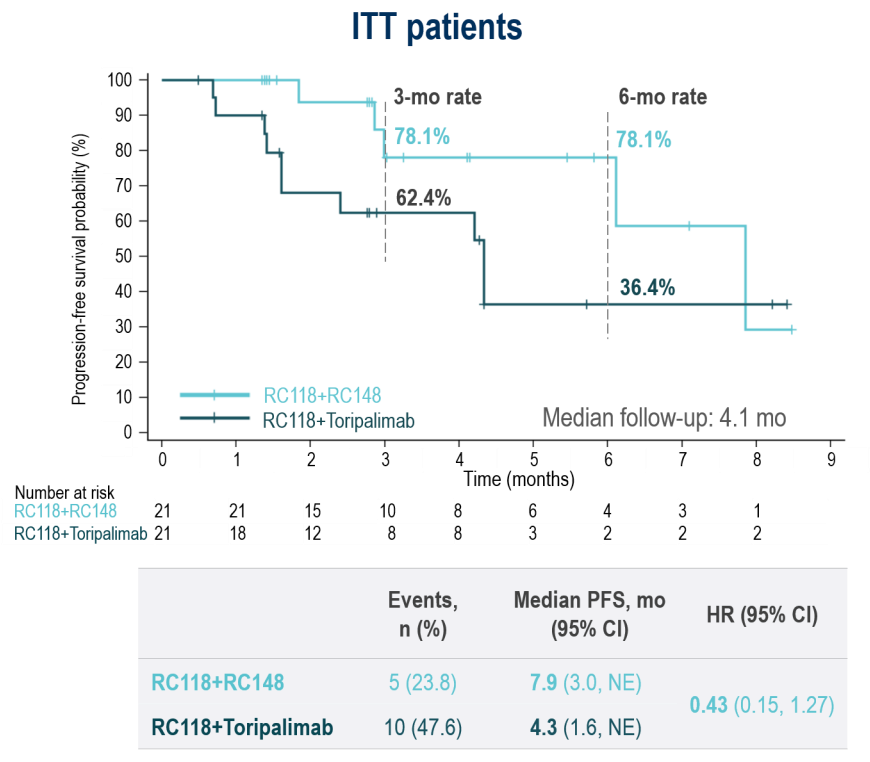
以Ivonescimab(PD-1/VEGF)为例,临床前数据显示VEGF的存在能促进PD-1的结合并增强T细胞活化。Harmoni-2研究数据显示,在肺癌中Ivonescimab一线治疗的mPFS达到11.1个月。同时,摘要号为LBA83(ESMO 2025)的研究公布了RC118(CLDN18.2 ADC)联合RC148(另一款PD-1/VEGF双抗)的数据,意向治疗(ITT)人群的ORR为57.1%,中位PFS为7.9个月。
双特异性T细胞衔接器(BiTEs)
ASP2138(CLDN18.2/CD3):临床前数据显示了强效且CLDN18.2表达依赖性的T细胞活化和肿瘤杀伤。其临床研究正在评估单药及联合方案(1L联合帕博利珠单抗+mFOLFOX6,2L联合雷莫西尤单抗+紫杉醇),并通过皮下(SC)给药探索降低细胞因子释放综合征(CRS)毒性的可能。
AZD5863(CLDN18.2/CD3):临床前数据显示,该分子不仅能特异性杀伤CLDN18.2+细胞,还能在混合细胞群中诱导“旁观者杀伤效应”。
嵌合抗原受体T细胞(CARs)
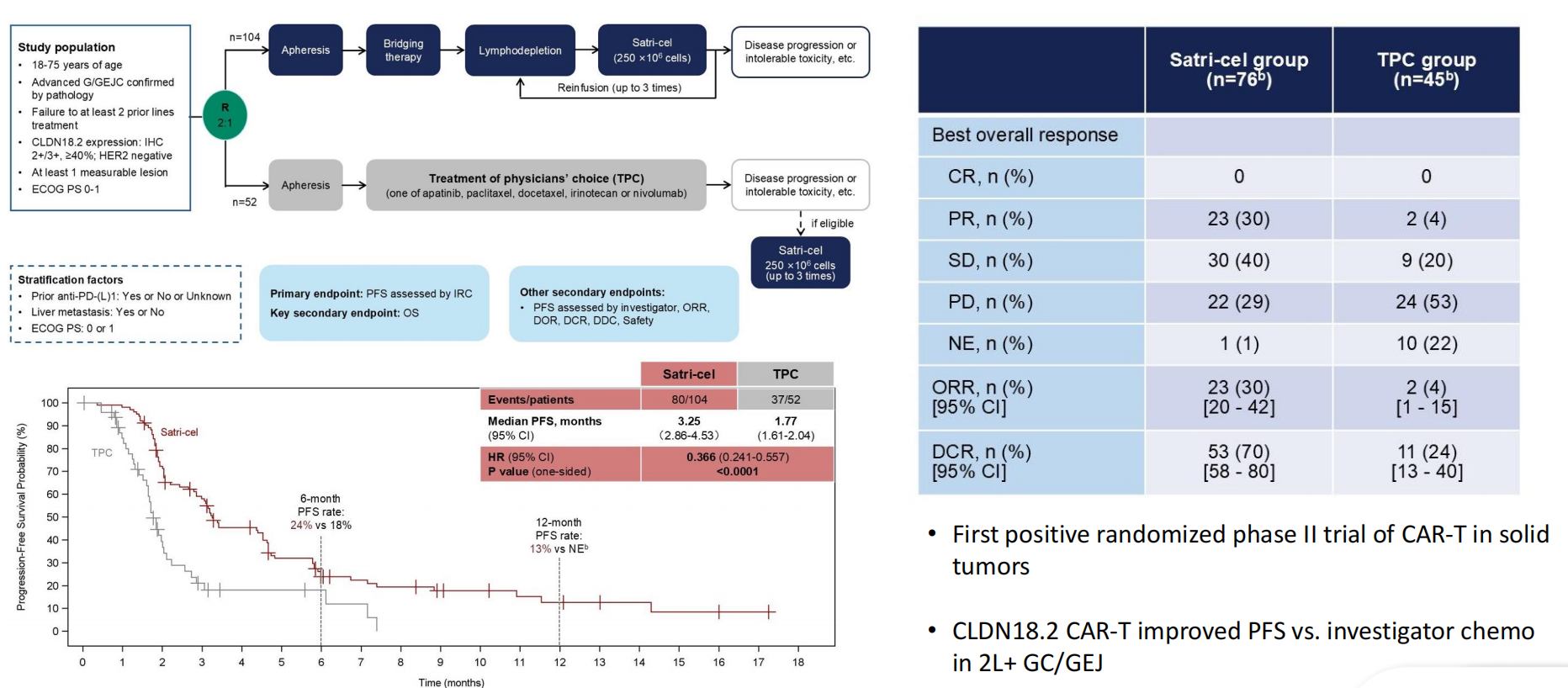
Satri-cel(CLDN18.2 CAR-T)
Klempner博士回顾了首个在实体瘤领域获得阳性结果的随机II期CAR-T试验(ASCO 2025)。Satri-cel(CLDN18.2 CAR-T)对比研究者选择的化疗(TPC)用于2L+ CLDN18.2阳性GC/GEJ患者。结果显示,Satri-cel组显著改善mPFS(3.25个月 vs 1.77 个月;HR=0.366,P<0.0001),ORR(30% vs 4%)和DCR(70% vs 24%)也均明显提高。
排版编辑:肿瘤资讯-Marie











 苏公网安备32059002004080号
苏公网安备32059002004080号


