超过90%的乳腺癌在未发生远处转移的早期阶段即被诊断,Luminal型是其中最常见的分子亚型,占比高达70%。在临床实践中,雌激素受体(ER)免疫组化表达≥1%的乳腺癌被定义为ER阳性。其中,ER低表达(1-10%)的肿瘤在生物学特性上与三阴性乳腺癌都表现出对内分泌治疗(ET)的潜在抵抗,但现有证据仍支持对此类患者应用ET。
近年来,随着Oncotype、MammaPrint等基因组检测工具的应用,辅助治疗格局发生显著变化。这些检测可评估乳腺癌的复发可能性,从而精准识别出从ET治疗中获益的患者。因此,根据患者绝经状态与复发风险制定个体化ET方案,是当前Luminal型早期乳腺癌辅助治疗的核心议题。

绝经前/围绝经期状态
1. 内分泌治疗药物选择
针对绝经前/围绝经期的低危Luminal型早期乳腺癌患者,他莫昔芬单药治疗至少5年是标准方案之一。规律服药可显著降低前10年的复发风险,且在治疗开始后的15年内,将乳腺癌死亡风险降低近1/3;即便在ER低表达的肿瘤中,这一获益依然存在。
卵巢功能抑制(OFS)可通过手术或放疗实现,而服用促黄体生成素释放激素激动剂(LHRHa)近年来逐渐成为常用手段。近年来,OFS联合他莫昔芬或芳香化酶抑制剂(AI)在高危患者中的价值逐渐成为探讨的热门。SOFT、ASTRRA两项关键性试验均显示,加入OFS可带来明确生存优势:
• SOFT研究纳入3,066名绝经前患者,将其随机分为三组,中位随访约8年后结果显示,与单用他莫昔芬相比,他莫昔芬联合OFS显著改善无病生存率(DFS率:83.2%vs78.9%)与总生存率(OS率:93.3%vs91.5%),这种获益在接受过新辅助化疗或辅助化疗、诊断时年龄<35岁的高危亚组中尤为显著。
• ASTRRA研究纳入1,293名接受过化疗的高危绝经前患者,结果同样证实,他莫昔芬联合戈舍瑞林(为期2年)的方案,其DFS与OS均显著更优。
对于高危患者,AI联合OFS是另一种重要治疗选择,SOFT与TEXT研究的联合分析为此提供了最高级别证据。该分析显示,随访8-9年后,与他莫昔芬联合OFS相比,依西美坦联合OFS可进一步改善DFS(86.8%vs82.8%)与无远处复发生存;12-13年随访数据显示,这一生存优势仍存在,且OFS的加入降低了长期死亡风险。
综合来看,高危绝经前患者的最佳治疗选择为AI联合OFS;低危患者可安全接受他莫昔芬单药治疗。决策过程中,需充分考虑治疗相关不良事件及患者个人意愿。
2. 延长治疗的最佳策略:10年他莫昔芬、5年他莫昔芬联合5年AI,还是仅5年他莫昔芬?
对于完成5年他莫昔芬单药治疗的高危患者,延长内分泌治疗至10年是可选策略。ATLAS与aTToM研究均证实,将他莫昔芬疗程从5年延长至10年,可进一步降低乳腺癌复发风险(ATLAS研究RR 0.84;aTToM研究RR 0.85)与死亡率,但同时也观察到子宫内膜癌相关死亡风险增加,且复发风险的降低在治疗第10年后尤为明显。
若患者在5年他莫昔芬治疗期间进入绝经状态,后续可换用AI继续治疗5年。MA.17研究为此提供证据:完成5年他莫昔芬治疗的患者中,继续使用来曲唑5年相较于安慰剂,显著延长DFS;其中淋巴结阳性患者的OS也得到改善,且这一获益在诊断时为绝经前状态的患者中尤为突出。
因此,已完成5年他莫昔芬单药治疗的高危患者(如pT>2cm、pN+、Ki-67≥20%、G3等),应考虑延长治疗;已完成5年联合治疗方案(OFS+内分泌药物)的患者,目前尚无延长OFS的数据,可根据绝经状态考虑继续使用他莫昔芬或AI治疗5年。
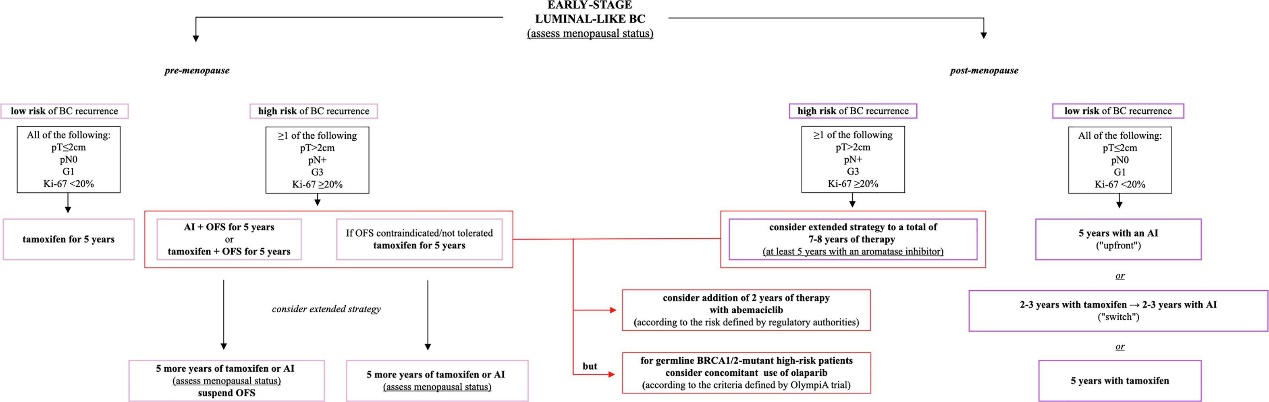
绝经后状态
1. 内分泌治疗药物优选
对于绝经后患者,AI是辅助内分泌治疗的优选方案:与他莫昔芬相比,AI可进一步降低乳腺癌复发与死亡风险。若患者对AI不耐受或存在禁忌症,5年他莫昔芬治疗仍是合理替代选择。
AI的给药方案主要有两种:“初始”策略(连续使用5年)与“转换”策略(先使用2-3年他莫昔芬,再换用AI完成剩余疗程)。2015年EBCTCG荟萃分析及意大利FATA-GIM3研究均表明,两种策略在生存结局上无显著差异:
• EBCTCG荟萃分析显示,与5年他莫昔芬相比,“初始”AI和“转换”策略均能显著降低复发与死亡风险;两种AI策略直接比较时,长期生存结局相当。
• FATA-GIM3研究也得出相似结论,证实两种给药策略疗效等效,且三种AI(阿那曲唑、依西美坦、来曲唑)之间的疗效无差异。
2. 最佳持续时间:5年、7年、10年还是15年?
关于绝经后患者辅助内分泌治疗的最佳疗程,多项研究已展开探索,但尚未有定论:
• 比较5年与7-8年疗程的研究中,GIM4研究结果显示,将总疗程延长至7-8年,不仅显著改善12年DFS(67%vs62%),还首次在该类研究中证实OS的显著获益(88%vs84%);DATA研究也观察到,淋巴结阳性或肿瘤体积较大的高危患者中,延长治疗至7-8年可带来DFS获益。
• 比较5年与10年疗程的研究中,NSABP B-42研究更新结果显示,将AI治疗从5年延长至10年能显著改善DFS(10年DFS率:76%vs72%),但对OS无显著影响。
• 比较7年与10年疗程的研究中,SALSA与IDEAL研究均未发现10年疗程相较于7年疗程能带来额外生存获益,且10年疗程可能增加骨折风险。
• 比较10年与15年疗程的研究中,MA.17R研究显示,已接受约10年内分泌治疗的患者中,再延长5年来曲唑治疗并未在DFS上显示统计学显著差异,反而增加骨相关不良事件风险。
综合现有证据,完成5年辅助内分泌治疗且复发风险较高的绝经后患者,应在评估个体耐受性的前提下推荐延长治疗;其中总疗程7-10年(至少包含5年AI),可能是在生存获益与治疗耐受性之间取得平衡的最佳方案。
间歇性与持续性延长治疗
SOLE研究探索了延长治疗期间“间歇性给药”(服药9个月、停药3个月)与“持续给药”的疗效差异。结果显示,间歇性给药在改善DFS方面并未优于持续给药(7年DFS率:81.4%vs81.5%),但也表明延长治疗阶段采用间歇性方案不会增加远处复发风险。
基因组和临床评分的潜在作用
基因组检测工具在辅助治疗决策中扮演重要角色。除Oncotype、MammaPrint等用于指导化疗决策的工具外,乳腺癌指数(BCI)这一多基因特征可预测患者能否从延长内分泌治疗中获益;临床治疗评分(CTS5)则通过整合肿瘤大小、淋巴结状态、肿瘤分级和患者年龄,评估5年内分泌治疗后的远期复发风险。
对IDEAL研究人群的分析显示,BCI能够预测延长治疗的获益,而CTS5不具备此预测能力。此外,基于液体活检的微小残留病灶检测与超高深度测序技术,有望在未来进一步推动内分泌治疗的个体化升级。
总结与临床启示
本文系统阐述了早期Luminal型乳腺癌辅助内分泌治疗的个体化策略,核心在于依据患者绝经状态与复发风险进行精准决策:
• 绝经前低危患者,5年他莫昔芬仍是标准治疗;中高危患者应考虑OFS联合他莫昔芬或AI,并可视风险考虑延长治疗。
• 绝经后患者,AI是首选方案;高危人群可从7-10年的延长治疗中获益。这一决策过程需综合评估病理特征、基因组信息、治疗耐受性及患者意愿,以实现疗效与生活质量的最佳平衡。
Cucciniello L, Gerratana L, Del Mastro L, Puglisi F. Tailoring adjuvant endocrine therapy in early breast cancer: When, how, and how long?. Cancer Treat Rev. 2022;110:102445. doi:10.1016/j.ctrv.2022.102445
审批编号:CN-171050
过期日期:2026-11-4
声明:本材料由阿斯利康提供支持,仅供医疗卫生专业人士参考
排版编辑:肿瘤资讯-Sally











 苏公网安备32059002004080号
苏公网安备32059002004080号


