甲状腺癌作为全球发病率增长最快的实体瘤之一, 在我国已构成显著的公共卫生挑战。2024年发布的最新流行病学数据显示,甲状腺癌在我国恶性肿瘤发病谱中已高居第三位,其中分化型甲状腺癌(DTC)占据了所有患者的95%以上1 。尽管DTC总体预后良好,然而,一旦疾病进展至放射性碘难治(RAIR)阶段并伴有远处转移,患者的5年生存率将显著下降,形成严峻的临床困局2。
BRAF V600E突变作为DTC中最高频的驱动基因变异,发生率可高达83%3。该突变通过持续激活MAPK信号通路,驱动肿瘤侵袭转移及治疗抵抗4。大量循证研究表明,BRAF V600E突变与甲状腺外侵犯、淋巴结转移、疾病晚期等不良预后因素密切相关,并是导致RAI抵抗的重要原因之一5。现有治疗主要依赖多靶点酪氨酸激酶抑制剂(mTKI),但其作用缺乏特异性,且伴随可高达75.9%的≥3级不良事件(AEs)发生率,严重影响治疗依从性与生活质量6。且mTKI治疗后,治疗方案选择匮乏,临床上迫切需要一种疗效更优、安全性更佳的精准治疗策略来打破这一僵局。
达拉非尼联合曲美替尼(D+T)作为首个获FDA批准用于BRAF V600E突变晚期非小细胞肺癌及甲状腺未分化癌的BRAF/MEK双靶抑制剂组合,已在多个实体瘤中展现出显著疗效。近日于2025年欧洲肿瘤内科学会(ESMO)大会公布的一项III期临床研究数据(摘要号:2987O)7,进一步验证该方案在BRAF V600E突变型DTC中的临床价值。同时,该研究也是首项由中国研究中心主导、涵盖全球多国多中心的甲状腺癌III期临床试验,对我国临床诊疗具有高度借鉴意义。
【肿瘤资讯】在此邀请昆明医科大学第一附属医院程若川教授、中国医学科学院北京协和医院林岩松教授对该研究进行深入剖析解读。邀请本研究牵头单位天津市人民医院(南开大学第一附属医院)高明教授分享该研究对于未来甲状腺癌诊疗的临床意义,并对该治疗方案的未来应用前景进行展望。
研究解读
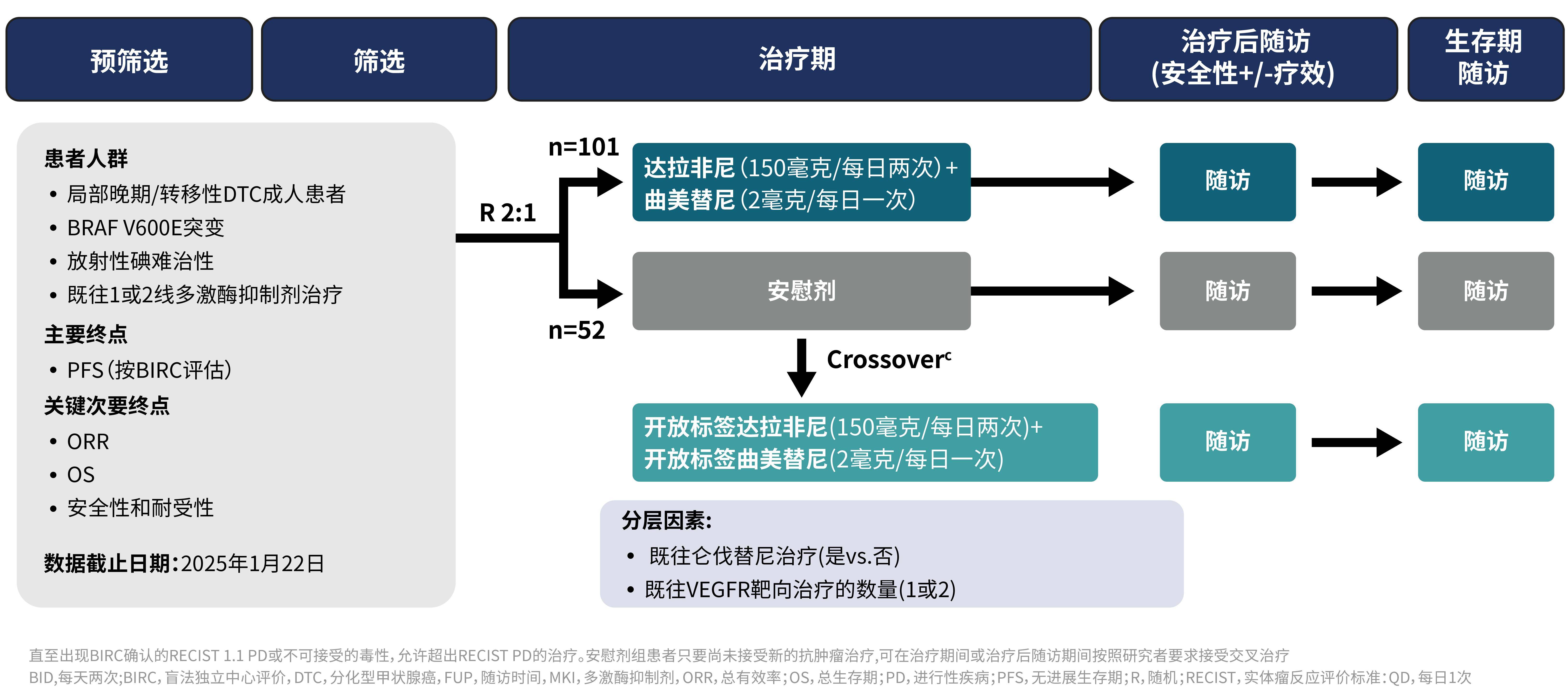
本次2025年ESMO大会公布的III期随机对照研究,是首个专门针对BRAF V600E突变放射性碘难治性分化型甲状腺癌(RR-DTC)开展的大型前瞻性临床试验。研究采用严格的双盲设计,纳入153例经组织学确诊、携带BRAF V600E突变、既往接受过mTKI治疗的局部晚期或转移性DTC患者。受试者按2:1比例随机分配至“达拉非尼150mg BID联合曲美替尼2mg QD治疗组”或安慰剂对照组,分层因素包括既往仑伐替尼治疗史以及既往血管内皮生长因子受体(VEGFR)靶向治疗线数(图1)。
研究的主要终点为由盲态独立影像评估委员会(BIRC)评估的无进展生存期(PFS),关键次要终点包括客观缓解率(ORR)和总生存期(OS)。
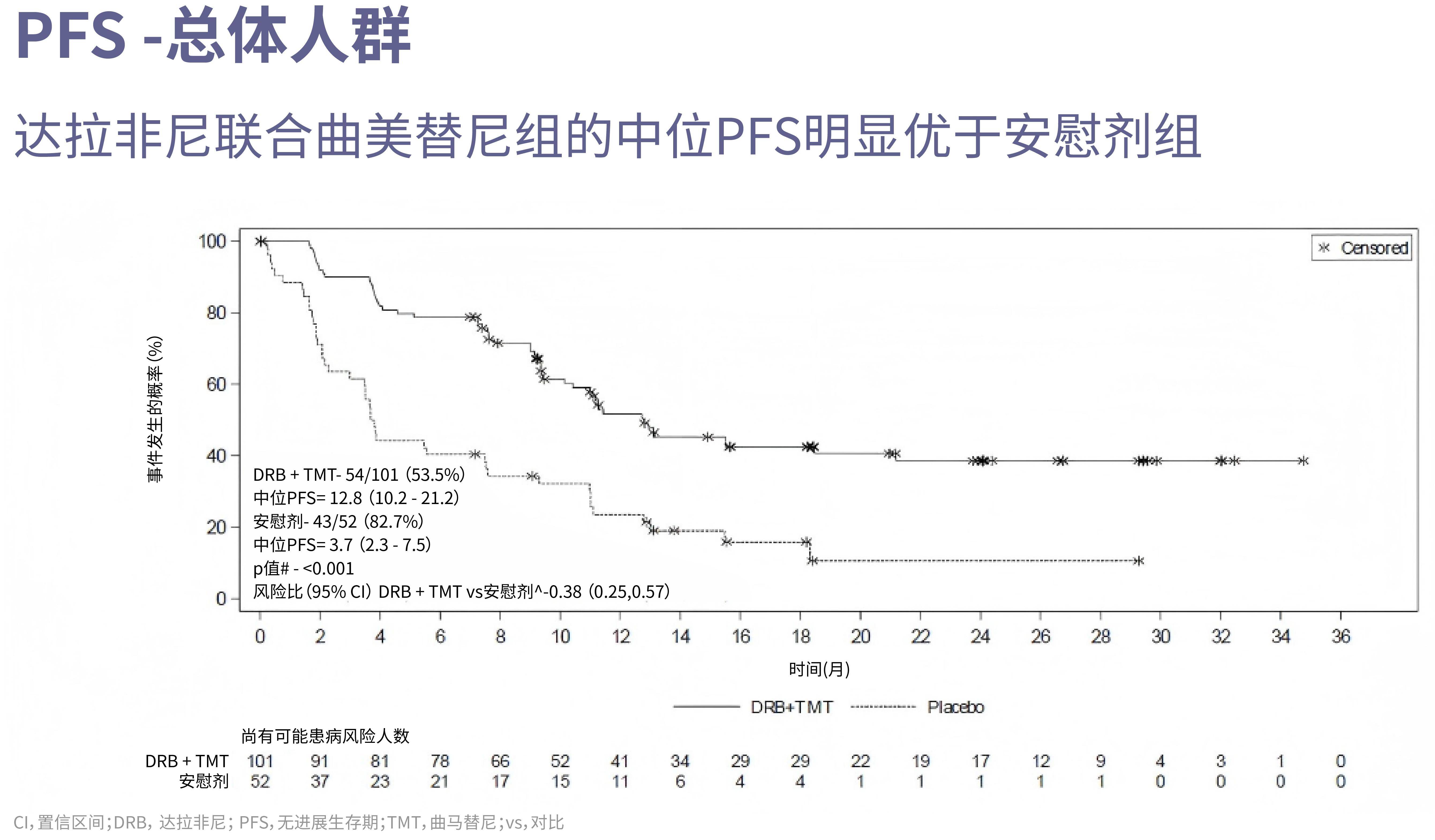
研究结果证实了卓越的临床获益。主要终点、次要终点分析显示(图2、3、4):
·联合治疗组中位PFS达12.8个月,较安慰剂组的3.7个月提高了9.1个月,降低了62%的疾病复发或死亡风险(HR=0.38, P<0.001),实现统计学与临床意义双重突破。
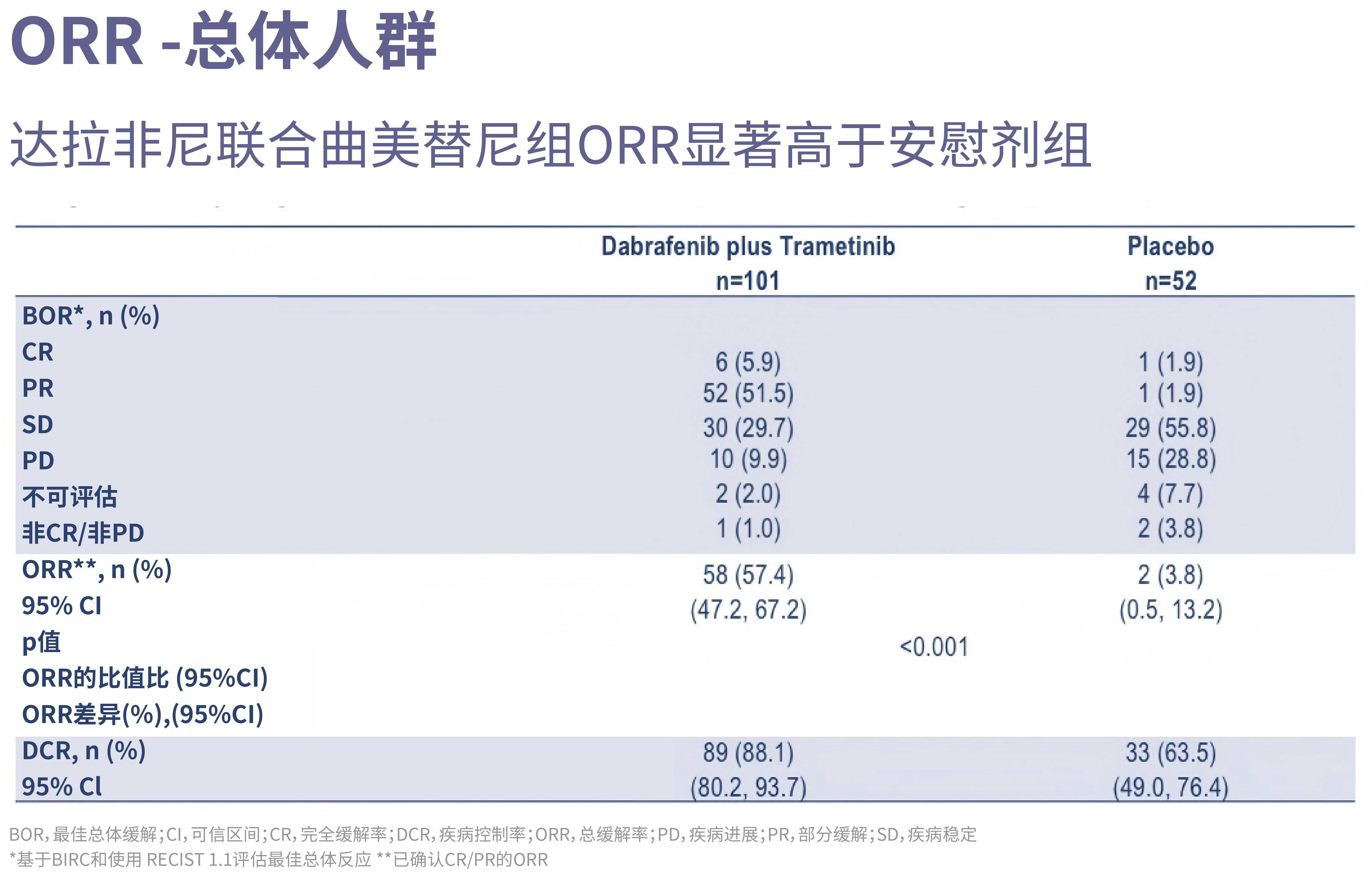
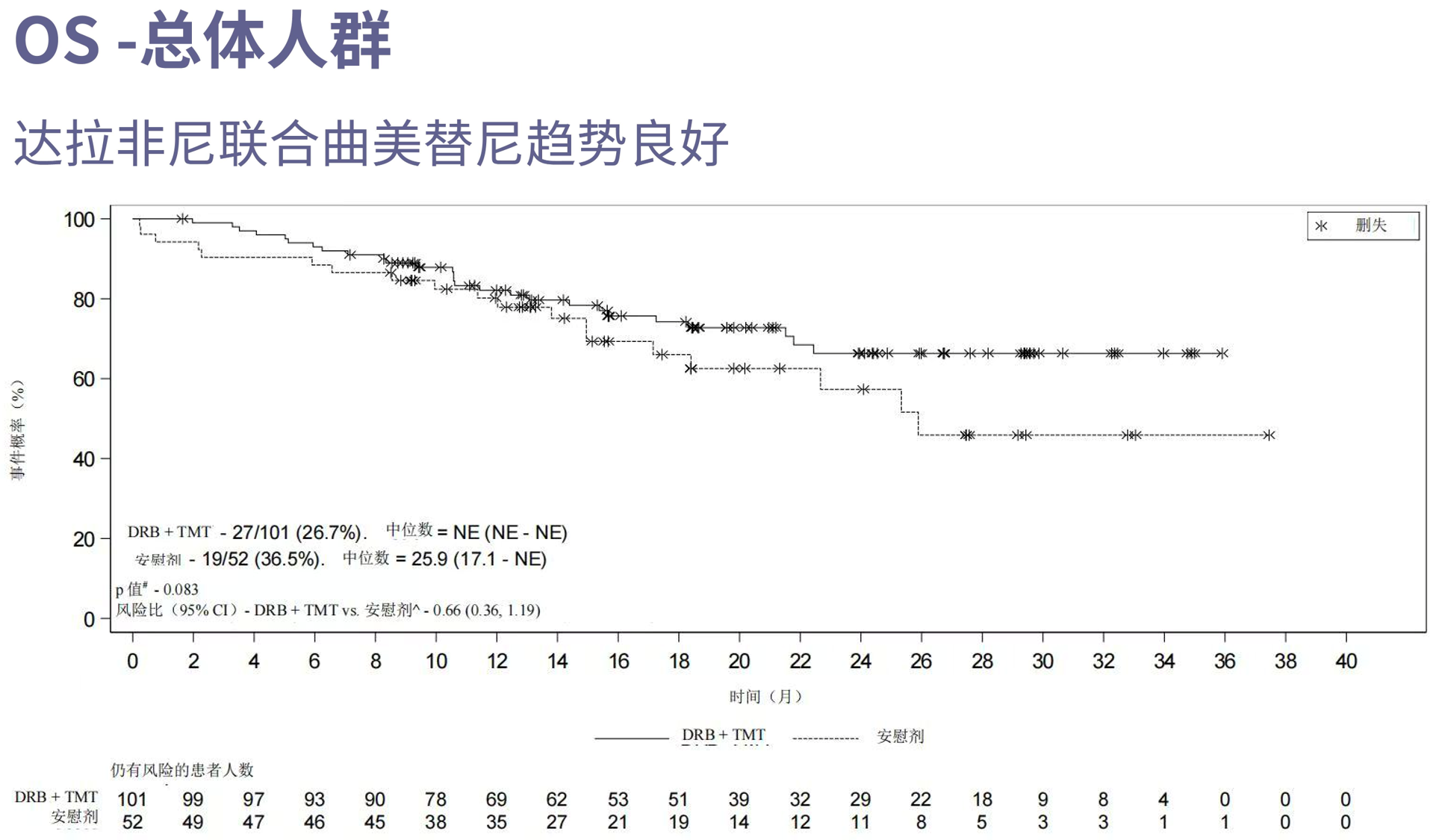
· 联合治疗组ORR高达57.4%,安慰剂组仅为3.8%(P<0.001),显示强大的肿瘤消退能力。得益于客观缓解率的显著阳性结果,OS中期分析得以进行,数据显示尽管尚未完全成熟,但已呈现明确获益趋势,治疗组尚未达到中位OS,对照组为25.9个月。
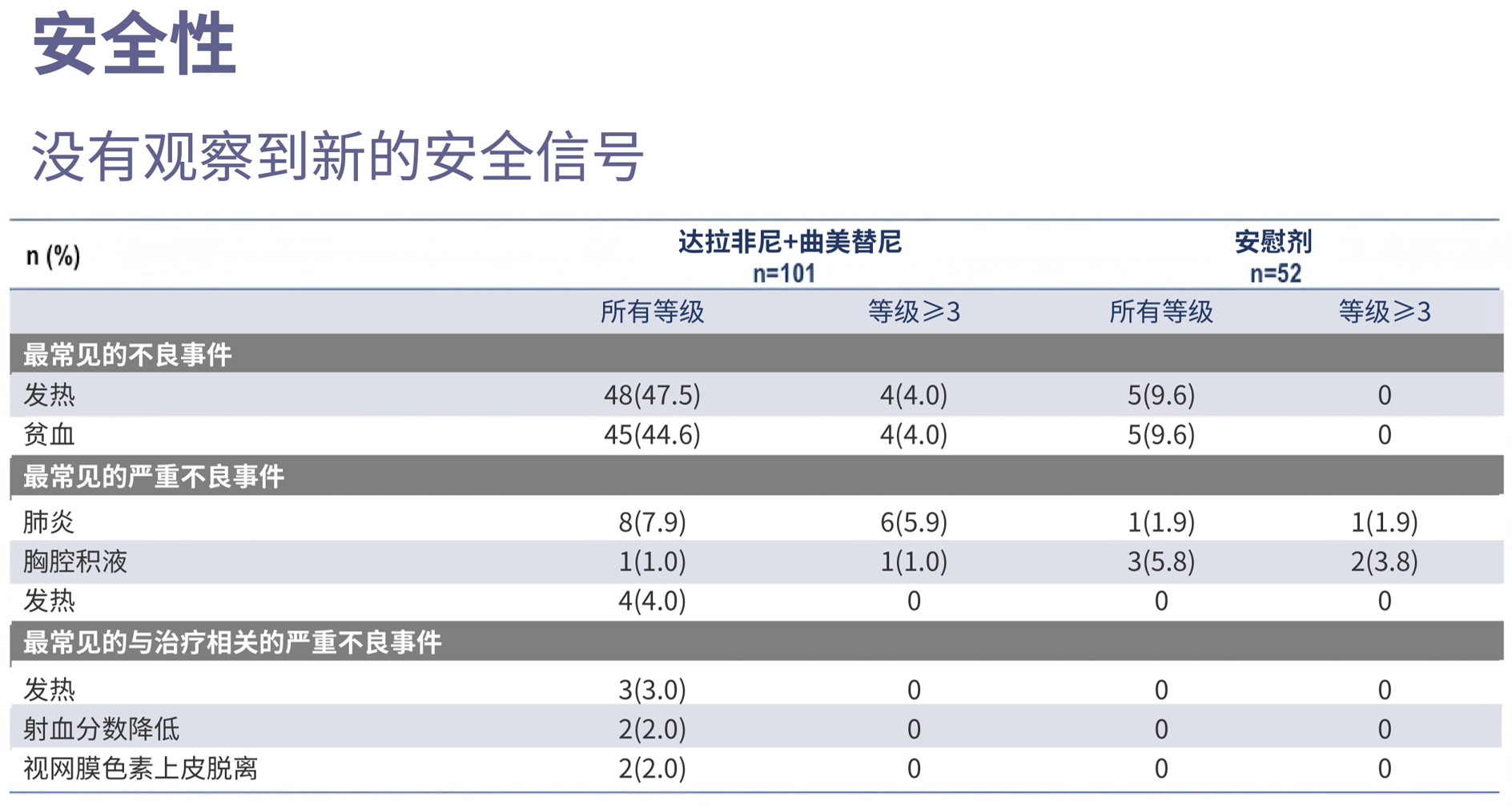
安全性分析显示,达拉非尼联合曲美替尼组的治疗相关不良事件(TRAEs)所有分级发生率为86.1%,高于安慰剂组的57.7%,但这一差异主要由轻度AEs驱动。治疗组最常见的AEs为发热40.6%。值得指出的是,联合治疗组≥3级TRAEs发生率仅为27.7%,远低于mTKIs普遍超过60%的水平,且未出现非预期的严重毒性。这一差异凸显了精准靶向策略在提升治疗耐受性方面的巨大潜力。
专家点评
程若川教授
基于本次ESMO公布的研究内容,您作为甲状腺癌领域重要的手术和学术专家,您如何评价本次研究结果和研究数据?
程若川教授:本次ESMO大会上公布的临床研究证实,D+T在携带BRAF V600E突变的RR-DTC患者中,展现出显著的疗效优势。
RR-DTC患者多处于局部晚期,常因既往I131治疗后复发并进展为碘难治状态,外科干预难度大,亟需有效的系统性靶向治疗手段。既往临床多采用以索拉非尼、仑伐替尼等为代表的mTKI治疗RR-DTC。此类药物虽具有一定疗效,但总体疗效有限,且不良反应管理复杂,部分患者在耐药后面临后续治疗选择匮乏的困境。而此次ESMO公布的III期研究结果显示,D+T在BRAF V600E突变的碘难治性DTC患者中表现出令人鼓舞的疗效,客观缓解率(ORR)高达57.4%,对于经其他mTKI治疗失败或耐药的患者,该ORR率尤为突出,提示其可作为有效的后续治疗选择。
从作用机制上看,D+T是一种双靶点抑制方案:达拉非尼(D)特异性抑制BRAF V600E突变,曲美替尼(T)则作用于下游MEK通路,两者协同阻断MAPK信号通路,从而精准抑制肿瘤增殖。
基于本中心此前参与的临床实践,D+T联合治疗方案在部分陷入治疗困境、无法手术的晚期患者中也显示出显著疗效,并能有效延长生存时间,这一结果增强了研究者对其临床价值的认可。
本研究也存在一定局限,即入组患者均为碘难治人群,且多数曾接受泛靶药物治疗失败。然而临床中存在部分晚期患者,既无I131治疗史,难以界定是否为碘难治,又对既往mTKI耐药且无法手术,此类患者是否适用D+T方案,尚需通过未来专家共识进一步明确。
目前,D+T的卓越疗效已获中美III期研究充分验证,其不良反应发生率低于mTKI药物,且以轻中度为主,易于管理,具备良好的临床应用前景,期待该方案能尽快落地临床。此外,在医保准入、药物可及性与经济性等方面,仍需从国家层面统筹推进,以早日惠及中国患者。
总体而言,研究团队及相关专家对该药的研究结果高度满意,其获益趋势与国际研究一致。后续应致力于扩大其适应症范围,并通过学协会专家与研究组的共同努力,在临床实践中进一步拓展其应用,使更多合适患者获益。
林岩松教授
基于本次ESMO公布的研究内容,您作为重要参与研究单位负责人,您如何评价本研究的科学价值和学术影响?
林岩松教授:本研究由高明教授牵头,北京协和医院作为主要参研单位之一,全程参与了患者筛选、疗效评估等关键环节。研究数据的背后,是中国研究者严谨求实的科学态度,以及国际同行和患者群体对我们的信任。该研究纳入的病例中亚洲人群占比超过85%,其中中国患者贡献了一半以上的病例,且完成度高,这不仅体现了以高明教授团队为代表的中国研究团队在该领域的全球引领作用,也证明了我国开展高质量国际多中心临床试验的能力。
本次在ESMO大会上发布的研究数据,经过了多轮严格的专家评审。本研究的一项重要设计特点是仅纳入前线mTKI治疗耐药的患者,这类患者在临床上处理尤为棘手。在中国,常用的一线TKI药物包括安罗替尼、阿帕替尼、仑伐替尼和索拉非尼等。本研究恰恰回应当前国际关键临床难题:在一线治疗失败后,除卡博替尼外,二线治疗应如何选择?研究结果提示,对于这类经治耐药患者,D+T联合治疗能有效控制疾病进展,且该联合疗法展现了良好安全性。
研究结果显示,D+T方案在此类患者中取得了57%以上的客观缓解率,而安慰剂组仅为不到4%。这一显著的肿瘤缩小效果,为仑伐替尼等药物耐药后的后续治疗提供了有力的新选择,展现出明确的临床价值。
从安全性数据来看,传统mTKI的不良反应发生率接近100%,其中高血压、蛋白尿等不良事件发生率可达60%-80%。而在本研究中,D+T联合治疗方案相关≥3级不良反应发生率低于30%,这一安全性特征,使医生与患者对该方案更具信心。
此外,该方案作为二线治疗仍达到较高的ORR,其用于一线治疗或能带来更为惊艳的疗效数据,值得我们进一步探索。同时,更快更好地缩瘤为不可手术或局部复发患者的新辅助治疗提供了新的探索方向,提示其未来的广阔前景。
高明教授
基于本次ESMO公布的相关研究,您作为本研究全球牵头中心负责人,您如何看待该项研究于临床实践的意义?对于中国甲状腺癌的临床实践有怎样的影响?
高明教授:本研究作为首项由中国研究中心主导、涵盖全球11个国家,42个中心,153例甲状腺癌患者III期临床试验,中国受试者比例超过总人群的50%,其成果对全球及中国甲状腺癌诊疗策略具有重要指导价值。该研究标志着BRAF V600E突变型难治性分化型甲状腺癌的精准靶向治疗取得了决定性突破。研究结论不仅将对国内外临床实践产生深远影响,也将推动相关指南与专家共识的实质性更新与优化。当前指南已日益明确,对于RR-DTC,在识别出特定基因改变后,单靶点抑制剂通常优于mTKI药物,其疗效更高且脱靶不良反应更低。
D+T是目前针对BRAF V600E突变的重要双靶治疗方案:其中D抑制MAPK信号通路上游,T有效阻断下游MEK通路,双重阻断不仅提升了疗效,也降低了单药治疗中常见的耐药风险。本研究以III期随机对照研究的最高级别证据,为这一理念在BRAF V600E突变甲状腺癌患者群体中的应用提供了权威确证,清晰地为达拉非尼联合曲美替尼方案奠定了坚实的治疗基石。
此外,D+T方案还具有恢复肿瘤摄碘能力的潜力,这为后续研究提供了重要方向。
总体而言,这项研究的重大意义远不止于为晚期治疗增添一个优效方案,它更强有力地印证了将分子检测深度整合DTC诊疗全流程患者管理的核心价值。以BRAF检测为代表的分子诊断,其在疾病定性、确定危险分层、治疗策略制定及评估预后中均发挥核心作用。本研究的成功正是这一全流程管理理念的一个优秀典范,它再一次强调了对携带BRAF V600E这一高频核心驱动突变的患者实施“有靶打靶”的个体化治疗具有重要价值,是改善预后的必要途径,对我国未来临床诊疗具有极大借鉴意义。展望未来,基于分子分型的精准治疗正在系统性地重塑难治性甲状腺癌的治疗模式,推动治疗策略向更精细化、个体化方向发展。
在取得现有成果的基础上,进一步探索D+T方案与免疫治疗的联合策略,即“靶免联合”模式也是未来的发展方向。同时,临床实践中应更加强调整合性治疗理念,将精准分子诊断、肿瘤负荷与共病状态评估及动态随访紧密结合,构建以患者为中心的多学科精准诊疗体系。
值得一提的是,国家药品监督管理局药品审评中心已于九月正式受理D+T方案甲状腺癌适应症的上市申请。作为临床工作者,我们热切期待该方案能早日在中国获批,这将推动我国精准治疗成果落地,使更多甲状腺癌患者尽早获益。
小结
作为首项由中国主导的全球多中心甲状腺癌III期试验,本研究成功实现了BRAF V600E突变型难治性分化型甲状腺癌精准治疗的重大突破,对中外临床实践均具重要指导价值。研究成果不仅将深远影响临床决策,也势必推动相关指南与共识的全面更新。
D+T双靶方案不仅展现出优异疗效,且相较于传统mTKI展现出更优的安全性特征。其不仅为晚期治疗增添利器,更凸显分子检测融入诊疗全流程的必要性。展望未来,基于分子分型的精准治疗正引领难治性甲状腺癌进入个体化诊疗新阶段。期待该方案早日在华获批,助力开启我国精准靶向治疗新格局。
天津市人民医院 (南开大学第一附属医院) 党委书记,院长
国家卫健委首批国家杰出医师
中华医学会肿瘤学分会甲状腺肿瘤专业委员会主任委员
中国抗癌协会头颈肿瘤专业委员会前任主任委员
中国抗癌协会甲状腺癌专业委员会第一届及候任主任委员
中华医学会肿瘤学分会副主任委员
中国抗癌协会理事会常务理事
天津市抗癌协会甲状腺肿瘤专业委员会前任主任委员
国际头颈肿瘤联盟委员
亚太甲状腺外科协会委员
享受国务院特殊津贴
天津首批海河医学学者
昆明医科大学第一附属医院
云南省甲状腺外科临床研究中心主任
中华医学会肿瘤学分会第十一届委员会甲状腺肿瘤专业委员会副主任委员
中国抗癌协会甲状腺癌专业委员会主任委员
中国抗癌协会康复会学术指导委员会第一届副主任委员
中国抗癌协会头颈肿瘤专业委员会常委
中国医师协会外科医师分会甲状腺外科医师委员会常务委员
云南省医学会甲状腺外科学分会主任委员
云南省医师协会甲状腺医师分会主任委员
云南省抗癌协会甲状腺癌专业委员会主任委员
获云南省政府特殊津贴专家,获云南省万人计划-名医专项
北京协和医院(PUMCH) 核医学科
IAEA RAS6105项目中国区国家协调员
中国临床肿瘤协会(CSCO)核医学专家委员会 主任委员
中国医疗保健国际交流促进会甲状腺疾病学分会主任委员
国家癌症中心甲状腺癌质控专家委员会 副主任委员
中华医学会核医学分会 治疗学组专家指导委员会主任委员
北京核医学分会常委 治疗学组组长
北京核医学质控中心副主任委员
中国抗癌学会甲状腺癌专委会 常委
1. Han B, Zheng R, Zeng H, et al. Cancer incidence and mortality in China, 2022. J Natl Cancer Cent 2024;4(1):47-53. (In eng). DOI: 10.1016/j.jncc.2024.01.006.
2. Mu ZZ, Zhang X, Lin YS. Identification of Radioactive Iodine Refractory Differentiated Thyroid Cancer. Chonnam Med J 2019;55(3):127-135. (In eng). DOI: 10.4068/cmj.2019.55.3.127.
3. Kure S, Ishino K, Kudo M, et al. Incidence of BRAF V600E mutation in patients with papillary thyroid carcinoma: a single-institution experience. J Int Med Res 2019;47(11):5560-5572. (In eng). DOI: 10.1177/0300060519873481.
4. Schubert L, Mariko ML, Clerc J, Huillard O, Groussin L. MAPK Pathway Inhibitors in Thyroid Cancer: Preclinical and Clinical Data. Cancers (Basel) 2023;15(3) (In eng). DOI: 10.3390/cancers15030710.
5. Lee JH, Lee ES, Kim YS. Clinicopathologic significance of BRAF V600E mutation in papillary carcinomas of the thyroid: a meta-analysis. Cancer 2007;110(1):38-46. (In eng). DOI: 10.1002/cncr.22754.
6. Schlumberger M, Tahara M, Wirth LJ, et al. Lenvatinib versus placebo in radioiodine-refractory thyroid cancer. N Engl J Med 2015;372(7):621-30. (In eng). DOI: 10.1056/NEJMoa1406470.
7. Lori J. Wirth,et al. Efficacy and safety of dabrafenib plus trametinib (D+T) in patients with radioactive iodine (RAI)-refractory BRAF V600-mutant differentiated thyroid cancer (DTC).2025 ESMO,abstract 2987O.
排版编辑:肿瘤资讯-CYX











 苏公网安备32059002004080号
苏公网安备32059002004080号


