
文章题目:International Thymic Malignancy Interest Group Standard Definitions, Policies, and Reporting Measures for Thymic Epithelial Tumors
第一作者: 方文涛教授(上海市东方医院)
共同作者:Frank Detterbeck, Jeanne B. Ackman, Edith Marom, Anja C. Roden, Paolo Mendogni, Mirella Marino, Filippo Lococo, Thierry J. Molina, Andreas Rimner, Nicolas Girard, Luigi Ventura, Sara Ricciardi, Ayten Cangir, Malgorzata Szolkowska, on behalf of International Thymic Malignancy Interest Group Education Committee.
通讯作者: 方文涛教授(上海市东方医院)
影响因子: 20.8
DOI: https://doi.org/10.1016/j.jtho.2025.09.1757
International Thymic Malignancy Interest Group Standard Definitions, Policies, and Reporting Measures for Thymic Epithelial Tumors
国际胸腺恶性肿瘤协作组织关于胸腺上皮肿瘤标准的定义、政策及报告指标
引言
胸腺上皮肿瘤(thymic epithelial tumors, TETs)是血管前纵隔的恶性肿瘤,包括胸腺瘤、胸腺癌(thymic carcinoma, TC)及胸腺神经内分泌肿瘤(thymic neuroendocrine neoplasm, TNEN)。对其病程与治疗效果的研究受多种因素阻碍:据报道,TETs 发病率约0.3%,其罕见性导致相关研究多为单机构小样本研究;且其常呈惰性病程,致使许多研究随访时间不足。此外,总生存期(overall survival , OS)难以较好反映疾病特异性结局,并且与疾病范围及结局相关的术语使用不一致。
2011年,国际胸腺恶性肿瘤协作组织(International Thymic Malignancy Interest Group Standard Definitions , ITMIG)制定了一套报告临床研究结局指标测量的标准,旨在实现不同研究间结果的有效对比,并推动该疾病的合作研究。依托这些标准,基于 ITMIG 全球数据库及其他地区胸腺组织开展的研究已超 10 项。此外,ITMIG 还领导开发了首个官方胸腺 TNM 分类系统(该系统于 2017 年被采纳为全球标准)及胸腺淋巴结图谱,举办了为修订版世界卫生组织(WHO)组织学分类奠定基础的病理研讨会,并制定了国际组织学报告标准。本文根据后续研究进展,对原 ITMIG 标准进行更新, 以 期进一步促进多机构及全球范围的合作。
方法
本文件的制定过程既体现了基础证据,也凝聚了ITMIG成员的广泛共识。组建了一支来自ITMIG 教育委员会的多学科工作组,包括放射科医生、外科医生、病理科医生、肿瘤内科学家、放射肿瘤科医生及神经科医生,负责审查现有文献。各学科的专业小组拟定了初步建议,再由整个工作组对这些建议进行整合与完善。随后,工作组进一步收集了 ITMIG 全体成员的意见。本文中提出的最终建议,已获 ITMIG 成员批准采纳。在本手稿中,胸腺瘤、胸腺癌(TC)及胸腺神经内分泌肿瘤(TNEN)将统称为胸腺上皮肿瘤(TETs) 。
标准定义、政策及报告指标
TNM分期
肿瘤分期是基于切除肿瘤的组织病理学评估(病理分期)和 / 或影像学评估(临床分期),记录恶性肿瘤解剖范围的通用术语。作为标准定义的重要组成部分,这一通用术语对于交流该类肿瘤患者的结局、对比不同临床研究的结果而言至关重要。肿瘤分期建立在肿瘤(T)、淋巴结(N)和转移(M)的解剖学分类基础上,旨在供所有专业及临床医生使用 。
历史上,难以收集到足够数量的病例为胸腺肿瘤分期系统提供可靠依据。此前最常用的 Masaoka-Koga(MK)分期系统仅基于 79 例病例。2017 年, ITMIG与国际肺癌研究协会(International Association for the Study of Lung Cancer , IASLC)合作,依托全球包含超 10,000 例病例的数据库,开发了首个官方胸腺 TNM 分期系统 。该系统已基 于 同类数据库更新为 TNM-9 分期系统,并于 2025 年 1 月起作为全球标准生效。
除无临床影响的方面外,采用 Masaoka 或 Masaoka-Koga(M/MK)分期系统的研究数据,可轻松转换为 TNM-9 分期系统的表述。M/MK Ⅰ 期和 Ⅱ 期完全对应 TNM-9Ⅰ 期大型数据库研究一致发现,M/MK Ⅰ 期与 Ⅱ 期队列的预后无差异;M/MK Ⅲ 期肿瘤大多对应 TNM-9 Ⅱ 期和 Ⅲ 期,且 TNM-9 分期划分更精细,这将有助于开展更具针对性的临床研究并改善临床管理;M/MK ⅣA 期和 ⅣB 期也与 TNM-9 ⅣA 期和 ⅣB 期非常接近,同时 TNM-9 分期对淋巴结受累情况的划分更为细致。因此,应摒弃旧分期系统,转而采用 TNM-9 标准。
在 TNM-9 分期系统中,T1 期定义有或无包膜、有或无侵犯血管前纵隔脂肪,但未侵犯其他纵隔器官的肿瘤。肿瘤大小超过 5cm 是区分 T1a 与 T1b 亚类的依据。肿瘤大小可通过病理学检查和影像学检查轻松评估,且两种检查的测量结果具有良好相关性 。其余 T 分期描述符均与肿瘤局部侵犯范围相关。由于通过影像学和显微镜检查均难以识别纵隔胸膜及其受侵情况,在 TNM-9 分期系统中,“纵隔胸膜侵犯” 已不再作为 T 分期描述符;尽管如此,“纵隔胸膜侵犯”应列为 “附加组织学描述符” 并在可能时记录。ITMIG与国际癌症报告协作组织( Int ernational Collaboration on Cancer Reporting , ICCR)的《胸腺上皮肿瘤组织病理学报告指南》建议外科医生在手术切除时标记纵隔胸膜,以便后续识别和评估其受侵情况。
TNM-9 分期系统进一步细化了 T2 期和 T3 期的定义:将 “侵犯膈神经” 和 “侵犯肺” 下调至 T2 期,使各分期内患者的预后更具同质性,且相邻分期间的差异更显著。ITMIG、法国胸腺肿瘤与癌症网络(RYTHMIC)及 ICCR 建议,组织学层面上,肿瘤穿透脏层胸膜外弹力层是判断 “肺侵犯” 的最低标准;ICCR 建议“膈神经侵犯” 应包括 “神经周侵犯” 和 / 或 “神经侵犯”,而 “大血管侵犯” 则至少需满足肿瘤侵犯至血管中层。具体分期划分如下:侵犯无名静脉、上腔静脉、心包外肺血管或胸壁的肿瘤归为 T3 期;侵犯主动脉、心包内肺血管、心脏、气管或食管的肿瘤归为 T4 期。
2014 年,ITMIG与国际肺癌研究协会(IASLC)联合制定了淋巴结分类标准 — —ITMIG/IASLC 淋巴结图谱。该图谱将淋巴结受侵分为前组(血 管前 / 胸腺周围,N1 期)和深组(深部纵隔或颈部,N2 期)两类;其中,原发肿瘤直接侵犯淋巴结即判定为淋巴结受侵。在 TNM-9 分期系统中,N 分期分类未发生改变;淋巴结图谱也保持不变,但对部分边界进行了明确说明,以促进报告的一致性。
在 TNM 分期系统中,M 分期(转移分期)分为 M1a 期(独立的胸膜或心包肿瘤结节)和 M1b 期(远处器官转移)。肺转移归为 M1b 期,定义为位于肺实质内的肺结节;其与胸膜转移(M1a 期)的区别在于,胸 膜转移可位于任何脏层或 壁层胸膜的表面。记录 N 分期和 M 分期的更多细节(如受侵淋巴结数量、位置及远处转移灶数量、位置),将为 TNM 分期系统的下一次修订提供参考依据。
结局相关定义、政策及报告指标
长期结局指标:
虽然OS是癌症研究中公认的标准结局指标,但在胸腺上皮肿瘤(TETs)研究中,由于肿瘤复发与患者死亡的相关性较低,OS 并非衡量疾病控制情况的理想指标 。因此,建议在研究中,报告接受根治性治疗后的无复发生存期(freedom-from-recurrence, FFR)和接受非根治性治疗后的疾病进展时间( treatment and time-to-progression, TTP)。若有需要,也可额外报 告 无复发生存期(recurrence-free survival, RFS)等其他指标,但与 OS 类似,RFS 会因非疾病相关死亡的干扰而难以准确反映疾病控制情况。
一般而言,胸腺瘤切除术后的平均复发时间为 5-1 0 年,因此需通过 10 年结局指标才能可靠评估治疗效果;而对于胸腺癌(TC)、 胸腺神经内分泌肿瘤(TNEN)及 Ⅳ 期胸腺瘤,5 年结局指标即可满足评估需求。
此外,在罕见惰性疾病中比较生存曲线时,需关注其固有的统计学特征:若队列样本量<50 例,或研究持续时间为 5 年与10 年相比,结果的置信区间会显著变宽。这一现象凸显了 开展合作研究、保证足够随访时长以及报告置信区间的必要性,从而避免对研究结果的误读。
随访方案:
疾病复发或进展时间的判定会受随访频率影响。更新后的ITMIG随访方案(表 1)在 2011 年方案的基础上略有调整,其制定依据如下:TNM-9 分期中 Ⅰ 期胸腺瘤的平均复发时间为 10 年,Ⅱ-Ⅳ 期胸腺瘤、任何分期的胸腺癌(TC)(以及推测任何分期的胸腺神经内分泌肿瘤(TNEN))平均 复发时间约为 3 年。尽管相关数 据有限,但已有文献报道胸腺上皮肿瘤(TETs)在 10 年后仍可能出现晚期复发,这提示延长随访时长具有重要意义。
ITMIG建议,对于接受根治性手术的患者应在术后 3-6 个月,待急性术后变化消退后,通过胸部增强计算机断层扫描(CT)进行术后基线评估。应考虑将磁共振成像(MRI)作为 CT 的替代随访监测手段,尤其适用于年轻患者,以避免电离辐射暴露。对于晚期胸腺瘤高危患者、胸腺癌(TC)患者或胸腺神经内分泌肿瘤(TNEN)患者,由于胸部增强 CT 在检测肺结节方面灵敏度更高,建议分别在术后前 3 年和前 5 年采用该检查进行随访。不推荐将正电 子发射计算机 断层显像(PET)用于常规随访监测,但可作为针对性解决特定问题的工具选择性使用。随访影像学检查(CT 或 MRI)的扫描范围应从锁骨上区覆盖至肾中部水平,以确保完整覆盖整个胸膜表面。
对于未接受手术、仅接受根治性放疗的患者,由于其局部治疗失败风险高于 手术切 除患者,因此建议初期对肿瘤原发病灶区域进行更频繁的影像学随访监测。通过系列影像学检查,还有助于区分肿瘤放疗后改变与肿瘤复发。MRI 具有更高的软组织分辨率,或能更清晰地鉴别复发性肿瘤与放疗后组织改变 。对于接受非根治性姑息治疗的患者,影像学随访频率应根据肿瘤的进展速度(动力学特征)及预期治疗反应持续时间进行调整。
复发或进展的定义:
疾病复发指胸腺上皮肿瘤(TETs)在 R0 切除术后,或在根治性非手术治疗达到影像学完 全缓解后再次出现的情况。当临床确认存在复发可疑迹象(或证实复发)时,即判定复发发 生;即使后续事件(如影像学进展、活检等)在更晚时间使临床诊断更明确,仍需以最初确认复发可疑(或证实)的日期作为复发发生时间。但需注意,不可将复发发生时间追溯至无临床可疑迹象的时间点(例如,影像回顾性审查时发现此前未被怀疑的异常,不可将该异常出现时间定为复发时间)。R0 切除日(或达到完全缓解日)至复发发生日的间隔时间,称为无病间期(disease-free interval, DFI)。
尽管仅凭借影像学证据即可判定疾病复发,但仍建议在可行时通过病理学检查予以证实。国际癌症报告协作组织(ICCR)建议,对切除的复发性或转移性胸腺上皮肿瘤(TETs),应采用与原发性TETs 相同的方式评估并报告其病理特征。目前关于原发与复发性 TETs 配对病理评估的数据仍较为有限;但部分研究显示,在少数患者中,复发性肿瘤的胸腺瘤亚型似乎比原发肿瘤更具侵袭性。然 而, 临床中已明确多数胸腺瘤本身由几种亚型组成,因此尚不明确这种现象是既往治疗后侵袭性更强的亚型占优势所致,还是胸腺瘤亚型发生了转化。
表 2 列出了局部复发、区域复发及远处复发的定义。此处需重点说明其与 2011 年ITMIG标准的部分差异:随着胸腺淋巴结图谱的完善,复发部位的分类标准已明确 —— 侵犯紧邻胸腺淋巴结(即 N1 组淋巴结)的 复发归类为局部复发;侵犯 深部纵隔或颈部淋巴结(即 N2 组淋巴结)的复发归类为区域复发;侵犯上述区域以外淋巴结的复发归类为远处复发。此外,若复发发生于既往已治疗的区域或远处转移部位,仍应将其记录为区域复发或远处复发,并需注明该复发部位为既往已接受根治性治疗的转移部位。
ITMIG建议详细记录复发相关信息(即复发部位与复发灶数量),这有助于更好地明确复发的预后意义,及复发治疗的性质与彻底性。通过此类记录,可更准确地评估局部治疗的 效果,进而优化治疗方案的选择。至少应记录复发灶为单个部位还是多个部位。
非根治性治疗后的疾病进展,其定义与上述复发定义类似。当肿瘤满足本文 “疗效评估” 部分所界定的生长标准时,即判定为疾病进展;通常无需病理学证据。ITMIG建议记录 疾 病进展是否累及原发肿瘤、区域转移灶、远处转移灶,或是出现新的病灶部位。
手术相关定义、政策及报告指标
手术是胸腺上皮肿瘤(TETs)的主要治疗方式,其核心目标是实现肿瘤完全切除。表 3 总结了外科医生需遵循的手术标准措施 。采用微创手术方式(胸腔镜手术和机器人辅助胸腔镜手术)是合理的选择,但需注意避免肿瘤组织破损,且应将切除标本装入专用袋中取出,以防肿瘤细胞播散。在手术分离过程中,对于可能存在切缘阳性风险的区域,需同时在患者体内术区和标本上进行标记。建议术中重点关注淋巴结评估:胸腺癌(TC)和胸腺神经内分泌肿瘤(TNEN)的淋巴结受侵率较高,并且相当一部分Ⅱ-Ⅳ 期胸腺 瘤 似乎也存在淋巴结受侵。术中切除的淋巴结需参照 ITMIG/IASLC 淋巴结图谱进行记录 ,且建议明确标注每个淋巴结的具体部位(按名称或分区记录)。
外科医生与病理科医生之间的沟通至关重要。表 4 列出了病理科医生需遵循的标准政策与报告指标,同时建议使用外科医生给病理科医生的沟通表。需特别注意一个问题:胸腺周围的疏松结缔组织在标本处理过程中有时可能被破坏,此类情况下肿瘤暴露在此类位置不构成阳性手术切缘。此外,纵隔胸膜表面或心包内表面暴露的肿瘤组织也不构成阳性切缘,因为这些表面本身就朝向自然体腔。准确的病理报告对指导辅助治疗具有重要意义。在临床 研 究与治疗决策中,明确区分胸腺瘤、胸腺癌(TC)与胸腺神经内分泌肿瘤(TNEN),及胸腺瘤亚型均是关键环节。关于胸腺上皮肿瘤(TETs)病理检查与报告的 ITMIG 标准详情,将在另一份手稿中阐述。
多模式治疗的定义、政策及报告指标
详细记录治疗目的与治疗场景相关信息,对于跨机构解读研究结果至关重要;遵循ITMIG的报告指标可推动这一目标的实现(表 5)。需明确说明以下关键信息:治疗意图为根治性还是姑息性;治疗属于初始疗程还是针对肿瘤复发或进展 的治疗。对于姑息性治疗,需将每个疗程单独记录。此外,还应记录计划治疗方案(包括治疗方式及实施顺序),以及疗程结束后实际最终执行的方案。
化疗与放疗的疗效评估:
治疗反应应依据ITMIG标准进行评估(表 6)。首先需在治疗前(基线期)明确肿瘤负荷,在接受全身治疗(如化疗)或放疗后,需在相同解剖层面采用相同测量方式重新测量肿瘤大小。治疗反应需使用标准的实体瘤疗效评价标准(RECIST)阈值定义:肿瘤体积缩小 ≥30%定义为部分缓解(partial response, PR);肿瘤完全消失定义为完全缓解(complete response, CR);肿瘤体积增大 ≥20% 或出现新病灶定义为疾病进展(progressive disease, PD);肿瘤体积缩小 <30% 或增大 <20% 定义为疾病稳定(stable disease, SD )。
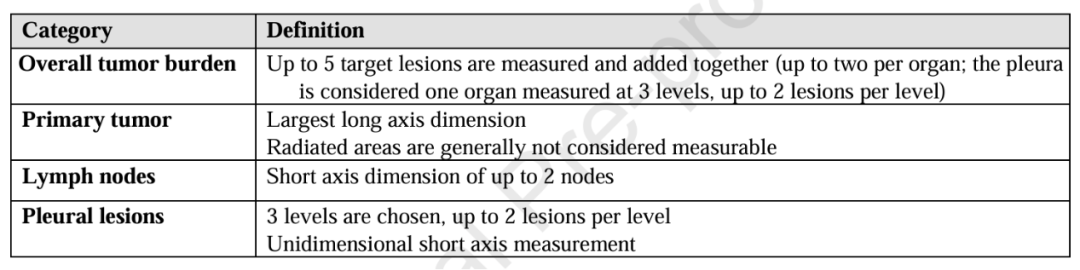
肿瘤负荷的具体测量方法详见表 6 。测量需在轴位计算机断层扫描(CT)图像上进行,建议扫描层厚≤2.5mm,并采用软组织窗设置 ;若测量肺结节,则需使用肺窗评估。淋巴结短轴≥15mm 时视为可测量病灶;在随访扫描中,即使淋巴结短轴缩小至 15mm 以下,仍需继续测量其大小。测量维度遵循以下标准:原发肿瘤 需测量最长轴;淋巴结及胸膜病灶需测量短轴。目前,计算机自动生成的胸腺肿瘤体积测量结果准确性尚不足以满足临床应用需求。
评估治疗反应时需结合潜在干扰因素进行综合判断。富含淋巴细胞的胸腺瘤可能因淋巴细胞耗竭而表现出对激素治疗反应迅速,这种变化需与真实肿瘤退缩区分;使用化疗药物治疗可能引发反跳性胸腺 增生;手术和放疗均可能诱发获得性胸腺囊肿 的形成。胸部磁共振成像(MRI)有助于鉴别胸腺增生、获得性胸腺囊肿与复发性肿瘤。此外需注意,免疫治疗有时会在真实疗效出现前先表现出 “假性进展”(即影像学显示肿瘤暂时增大或出现新病灶,但并非真正的疾病进展),此类情况也需纳入评估考量。
新辅助 治疗后的病理表现不具有特异性,可能包括存活肿瘤细胞数量减少、纤维化、坏死、囊性变、泡沫状组织细胞浸润、钙化及胆固醇裂隙形成。然而,上述部分表现也可能出现在未经治疗的 胸腺上皮肿瘤(TETs)中,可能与肿瘤自身退变和 或梗死相关。因此若病理诊断存在疑问,应优先将这些特征判定 为治疗相关改 变。
讨论
在胸腺上皮肿瘤(TETs)的临床管理与研究中,统一的术语体系是实现精准沟通的核心基础。对于TETs这类罕见肿瘤而言,多机构协作至关重要。这需要各机构和个体研究使用具有一致含义的术语,从而实现多来源数据的整合分析。为达成这一目标,ITMIG教育委员会通过审查文献,更新原有的标准定义。
TNM 分期系统界定了肿瘤的病变范围,目前全球通用的标准是 TNM-9 分期,该分期体系建立在可靠的统计分析基础之上。通过使用 TNM 分期系统及胸腺淋巴结图谱,可促进临床实践与研究的进展,因此ITMIG建议不再使用旧版分期系统。若继续依据 M/MK 分期系统对患者进行亚组划分(已有研究证实该系统划分的亚组无预后价值),将阻碍 TETs 领域的发展,使研究停滞在过往水平。而 TNM 分期系统不仅是全球通用标准,其基于预后差异划分的亚组还具有更高的区分度,采用这一系统有助于推进当前 TETs 的临床诊疗与后续研究。对于 TETs 而言,结局指标的明确界定至关重要,总生存期(OS)、无病生存期、肿瘤特异性生存期与病因特异性生存期之间20%-50% 的差异严重限制了不同 研究的可比性。由于肿瘤复发 / 进展与患者死亡之间的相关性较弱,无复发生存期(FFR)和疾病进展时间(TTP) 是评估治疗效果的最佳指标;若将死亡作为事件纳入结局指标(如无复发生存期 RFS),会因包含无关死亡事件而干扰治疗效果的准确评估。这也凸显了随访策略达成共识的必要性,这些策略需基于肿瘤生物学特征及临床治疗目标制定。目前,影像学随访标准已根据该领域的最新进展完成更新;而对复发、完全切除、治疗目的及治疗反应的一致定义,对提升研究的可比性至关重要。
对于胸腺上皮肿瘤(TETs)这类罕见疾病而言,多机构、多学科协作至关重要。本文所呈现的更新标准促进了国际多学科合作。而这种合作在过去十年间取得了显著进展。落实这些建议将有助于制定更精准的研究设计、规范研究结果报告,并促进跨学科讨论。通过采用并不断完善这些标准化方法,将提升 TETs 患者的诊疗质量,并推进该领域的研究的发展 。
Table 1. Standard Follow-up Protocol after Curative-Intent Treatment of Thymic Epithelial Tumors.

Table 2. Definition of Type of Recurrence.
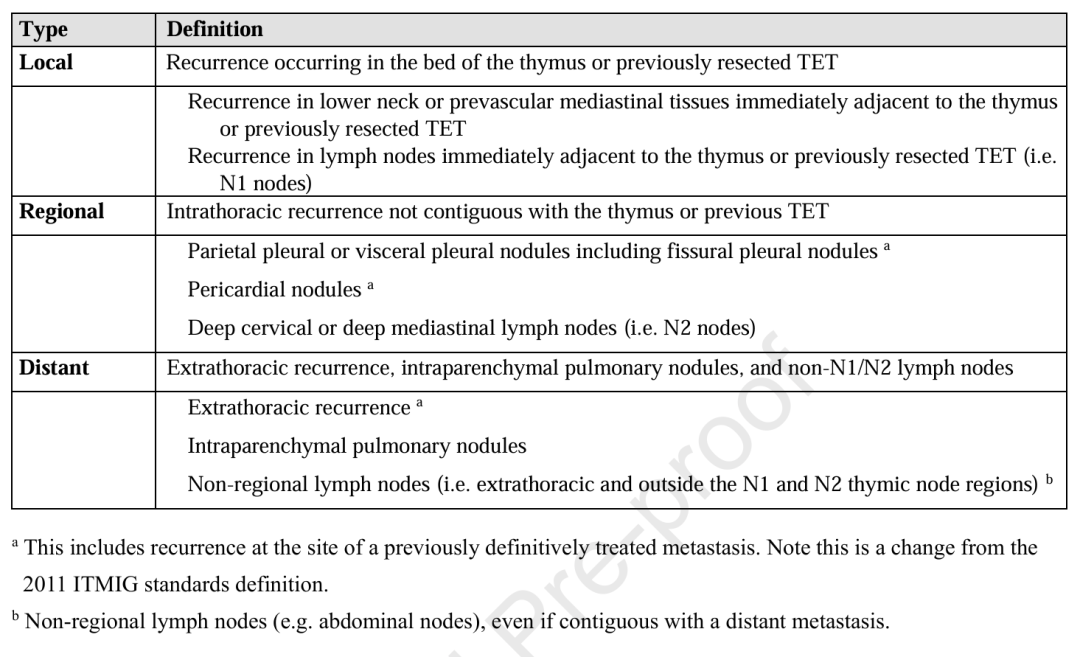
Table 3. Standard Policies and Reporting Measures for Surgeons.
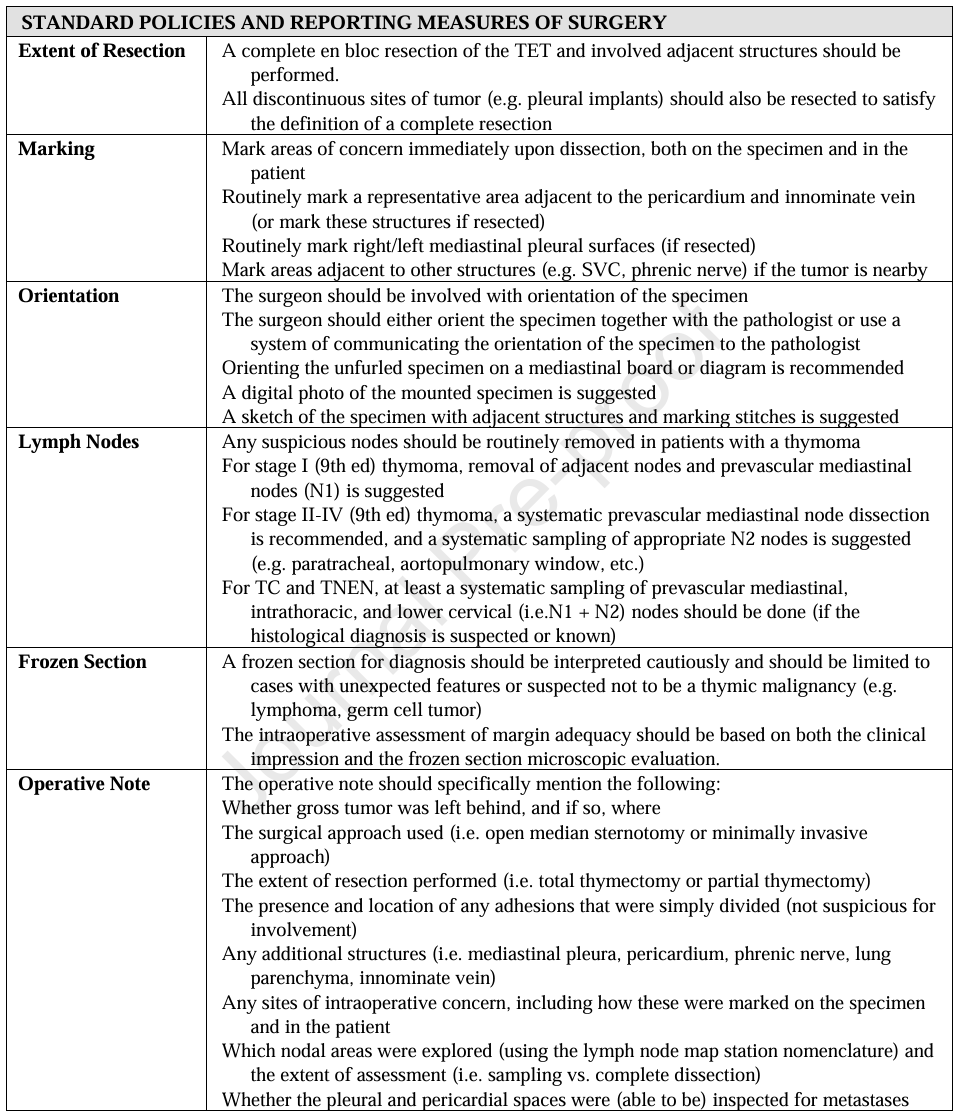
Table 4. Standard Policies and Reporting Measures for Pathologists.
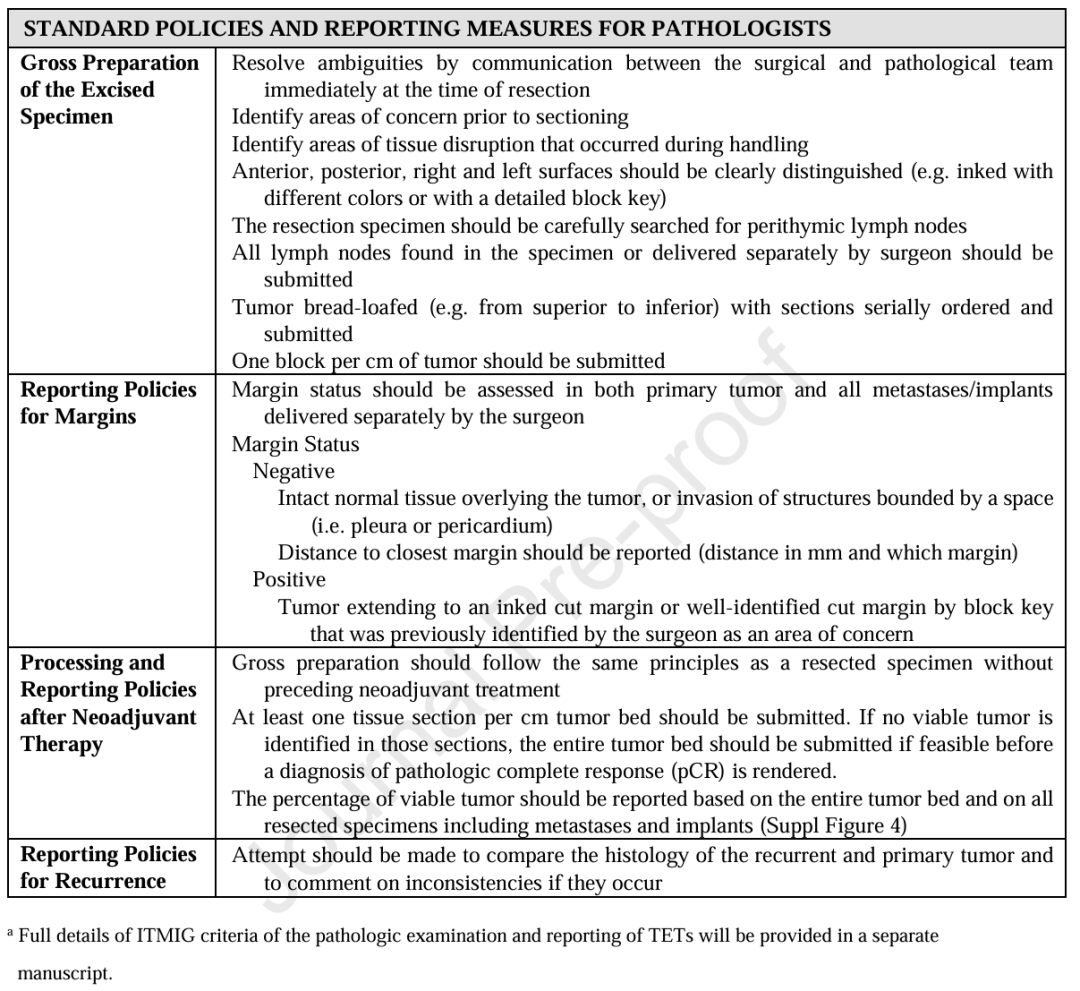
Table 5. Reporting Measures for Multimodality Treatment.
Table 6. ITMIG Criteria for Measuring Thymic Epithelial Tumor Burden by Imaging.











 苏公网安备32059002004080号
苏公网安备32059002004080号


