2025年9月6日至9日,世界肺癌大会(WCLC)在西班牙巴塞罗那盛大召开,众多肺癌领域前沿研究成果悉数亮相。肺癌仍是全球癌症死亡的首位病因,多数患者确诊时已属晚期。最新研究提示,在支气管上皮出现可识别的异型增生之前,分子与免疫层面已发生可逆性改变,形成“场损伤”。借助荧光支气管镜、低剂量CT(LDCT)与分子病理学,可连续追踪鳞癌与腺癌的癌前侵袭全轨迹。
引言:为何要在“癌变前”行动?
传统“早诊”依赖影像学可见的结节,此时病灶至少已具备原位癌特征。分子流行病学显示,吸烟或致癌物暴露后,整个气道黏膜进入“场损伤”状态:
多灶性表观遗传改变(甲基化、组蛋白修饰);
基因突变负荷呈梯度分布(近端>远端);
免疫信号通路同步激活;
若能在“高级别病变”出现前进行拦截,治愈率或可接近 100%。
支气管鳞癌发生模型:从荧光支气管镜到单细胞免疫图谱
形态学连续谱
正常上皮→基底细胞增生→鳞状化生→轻/中/重度异型增生→原位癌(CIS)→侵袭性鳞癌(SCC)。
免疫攻击的“两波”特征
第一波(低级别):
中性粒细胞、M1巨噬细胞、树突状细胞(DC)即刻浸润;
肥大细胞脱颗粒,抗原提呈功能上调。
第二波(高级别):
适应性免疫全面介入:CD4⁺效应T细胞、滤泡辅助T(Tfh)、记忆B细胞、活化NK细胞;
免疫状态由“原始”转为“积极”。
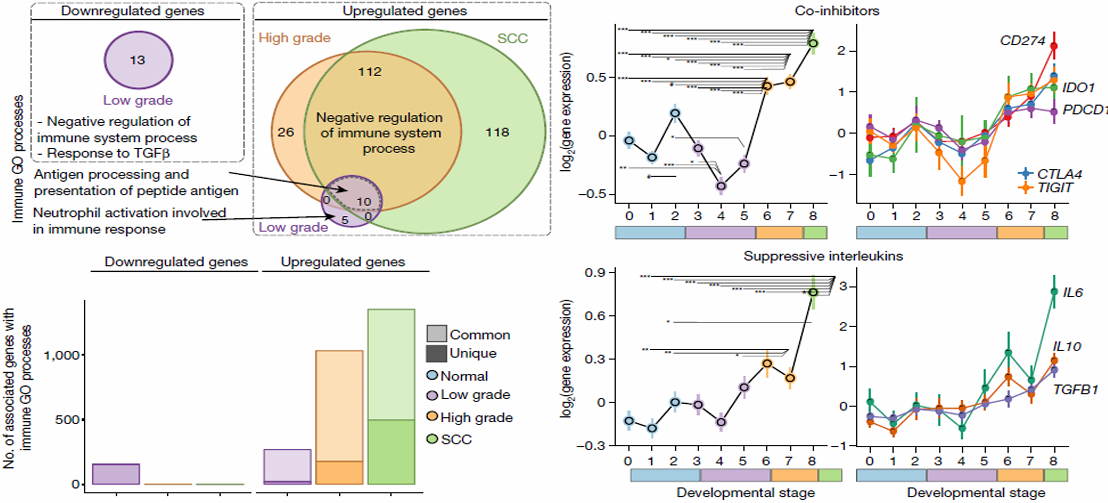
伴随的免疫逃逸开关
共抑制分子:PD-L1(CD274)、CTLA-4、TIGIT、IDO1逐级升高;
TGF-β、IL-10等抑制性细胞因子同步上调;
抗原加工/提呈基因(TAP1/2、HLA-DM)显著下调。
结果:高级别病变虽“热”却“瘫”,免疫细胞丰富但功能耗竭。
外周肺腺癌发生模型:CT-病理-免疫三对照
形态学连续谱
正常肺泡→非典型腺瘤样增生(AAH)→原位腺癌(AIS)→微侵袭腺癌(MIA)→侵袭性腺癌(ADC)。
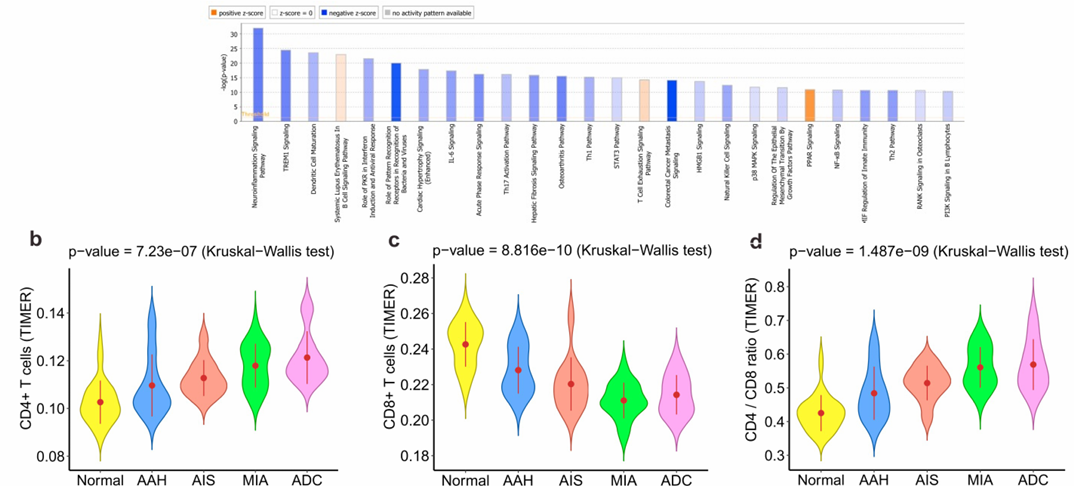
免疫指标“三降一增”
CD8⁺、CD4⁺、DC密度:AAH→AIS达峰后骤降;
TCR多样性:随进展呈指数下降(Kruskal-Wallis p= 1×10⁻⁹);
T细胞扩增分数与染色体不稳定性呈负相关;
整体甲基化水平与免疫浸润呈显著负相关(ρ=–0.43,p= 0.002)。
关键分子事件
染色体杂合性缺失(LOH)频率:AAH 20%→ADC 60%,且LOH(+)组HLA表达降低50%。
全局高甲基化导致:抗原提呈机器沉默;Th1/细胞
毒性基因座封闭;免疫突触形成受阻。
多组学整合:免疫微环境演变的“时间轴”
综合鳞癌与腺癌数据,可绘制通用免疫-癌症互作轴:致癌物暴露→DNA损伤、线粒体应激→释放DAMPs→先天免疫传感→中性粒细胞胞外网(NETs)、M1巨噬细胞清除突变细胞→突变负荷阈值突破→染色体不稳定性↑→免疫编辑压力↑→适应性免疫介入→T/B细胞克隆扩增→免疫平衡期(可长达数年)→多重逃逸机制启动(PD-L1/CTLA-4上调 +HLA-LOH+甲基化沉默)→免疫耗竭→突破基底膜→微血管生成→临床可见癌。
临床转化:如何拦截?
风险分层
影像+AI:LDCT结合放射组学,可提前3–5年发现 AAH/AIS;
气道-血液联合活检:
荧光支气管镜刷取“场损伤”细胞,行靶向甲基化测序;
外周血ctDNA甲基化 panel(如SHOX2/PTGER4/HOXA7)灵敏度>80%。
免疫干预策略
PD-1/PD-L1抑制剂:高级别病变阶段单药已见完全缓解病例(CIN-note研究,NCT04335309)。
低剂量IL-15/IL-2复合物:促进记忆T细胞驻留,延长免疫监视。
去甲基化药物(5-AZA)+免疫检查点抑制剂:恢复抗原加工基因表达;增强TCR克隆多样性(小鼠模型TCR Shannon指数↑2.3倍)。
个性化新抗原疫苗:针对患者特异突变与LOH-保留的HLA 等位基因设计mRNA疫苗,Ⅰ期试验已启动。
监测终点
免疫病理:CD8⁺/FoxP3⁺比值、TCR多样性恢复。
分子影像:⁸⁹Zr-Df-pembrolizumab PET量化PD-L1占位率。
液体活检:ctDNA甲基化负荷下降≥50%与2年无进展生存高度相关。
未来展望与挑战
人群筛查成本:需建立“甲基化-risk+影像”双层模型,减少过度活检。
干预毒性:癌前人群多为吸烟者合并COPD,免疫相关肺炎(irP)风险高,需开发局部递送(吸入式纳米载体)。
耐药机制:即便癌前阶段亦发现STK11/LKB1突变导致免疫冷表型,提示联合代谢-免疫调节。
伦理与监管:长期随访、无症状人群终点定义、适应症拓展均需与监管机构提前对话。
排版编辑:肿瘤资讯-Bear











 苏公网安备32059002004080号
苏公网安备32059002004080号


