2025年9月6日至9日,世界肺癌大会(WCLC)在西班牙巴塞罗那盛大召开,众多肺癌领域前沿研究成果悉数亮相。围绕高可塑性细胞状态(HPCS)的起源、分子特征及干预策略,系统梳理LUAD由正常肺泡II型(AT2)干细胞到耐药HPCS的演化路径,并重点解析KRAS抑制剂诱导的谱系重编程对HPCS扩增的影响,旨在为克服耐药提供理论依据与靶点线索。
肺癌仍是全球癌症死亡的首要病因,肺腺癌(LUAD)占其中半数以上。尽管靶向-免疫治疗显著延长患者生存,绝大多数病例仍因获得性耐药和复发而失败。最小残留病灶(MRD)被认为是复发的“种子”,其核心生物学特征为细胞状态可塑性——即肿瘤细胞在治疗压力下快速切换表型以适应微环境。新近研究提出HPCS概念,指出其兼具干细胞样自我更新与瞬时适应双重能力,是MRD形成和耐药的关键环节。
MRD的生物学内涵与耐药屏障
定义与临床挑战
MRD指根治性治疗(手术±放化疗/靶向/免疫)后影像学无可见病灶,但外周血或组织中仍可检测到肿瘤来源DNA或离散肿瘤细胞。前瞻性队列显示,MRD阳性LUAD患者24个月内复发率高达70%,而阴性人群仅10%。
耐药机制的多层整合
基因层:EGFR、KRAS、ALK等驱动突变克隆清除后,亚克隆TP53、RB1、KEAP1突变富集,导致基因组不稳定性增加。
表观遗传层:H3K4me3/H3K27me3双价染色质结构重塑,使耐药相关基因(AXL、CD133、SLC7A11)处于“蓄势”状态。
微环境层:纤维化生态位、缺氧及TGF-β/IL-6炎症信号维持HPCS去分化状态。
细胞状态层:HPCS通过瞬时休眠、抗氧化应激及DNA损伤应答(DDR)高效激活,实现“药物假期”后快速复发。
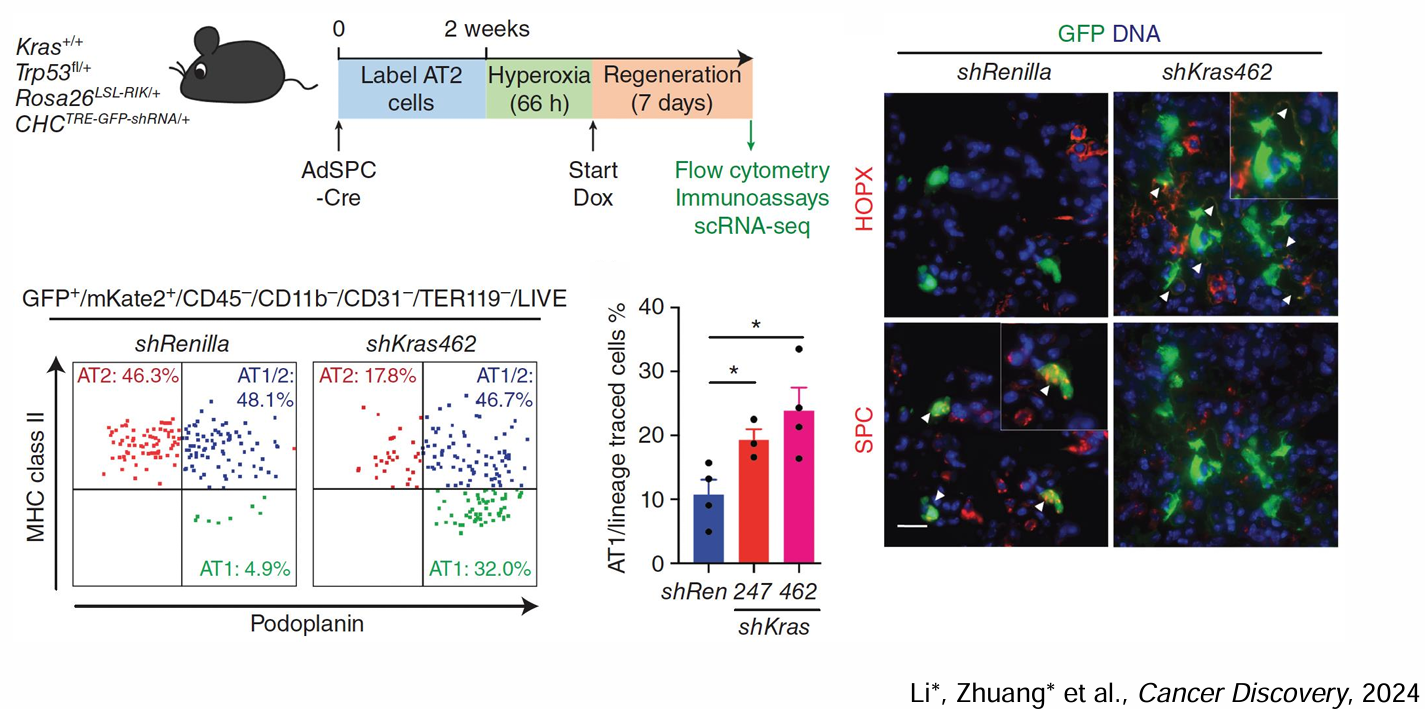
AT2干细胞:LUAD的细胞起源与可塑性储备
AT2的生理特征
AT2细胞位于肺泡上皮,负责表面活性物质合成与肺泡稳态。Lineage-tracing实验表明,在KrasG12D激活联合p53缺失模型中,单个AT2细胞可在8周内形成异质性肿瘤,证实其肿瘤起始潜能。
从AT2到LUAD的演化轨迹
癌前阶段:KrasG12D突变诱导AT2进入“预扩增”状态,转录组呈现Wnt、Notch双通路激活。
恶性转化:附加Tp53或Lkb1缺失驱动AT2向LUAD谱系分化,同时保留部分干细胞程序(Sox2、Id2高表达)。
耐药阶段:治疗压力筛选后,残留AT2样细胞通过YAP/TAZ去分化进入HPCS,表现为E-cadherin⁻/vimentin⁺/Cd44v⁺表型,兼具上皮-间质可逆转换能力。
HPCS的分子画像与耐药功能
转录与表观遗传特征
单细胞RNA-seq联合ATAC-seq显示,HPCS核心特征为:
干性模块:Sox2、Nanog、Klf4上调。
可塑性模块:Foxp1、Zeb1、Snail2染色质开放。
应激模块:Nrf2、ATF4、HIF1α持续激活。
耐药途径的时空协同
药物外排:ABCB1、ABCG2启动子去甲基化,增强紫杉醇、奥希替尼外排。
抗氧化:SLC7A11/xCT高表达维持GSH合成,拮抗铂类-ROS损伤。
DNA修复:BRCA1、RAD51同源重组修复效率提升3–5倍,导致PARP抑制剂耐药。
免疫逃逸:HPCS下调MHC-I、分泌TGF-β与IL-10,诱导Treg扩增与CD8⁺ T细胞耗竭。
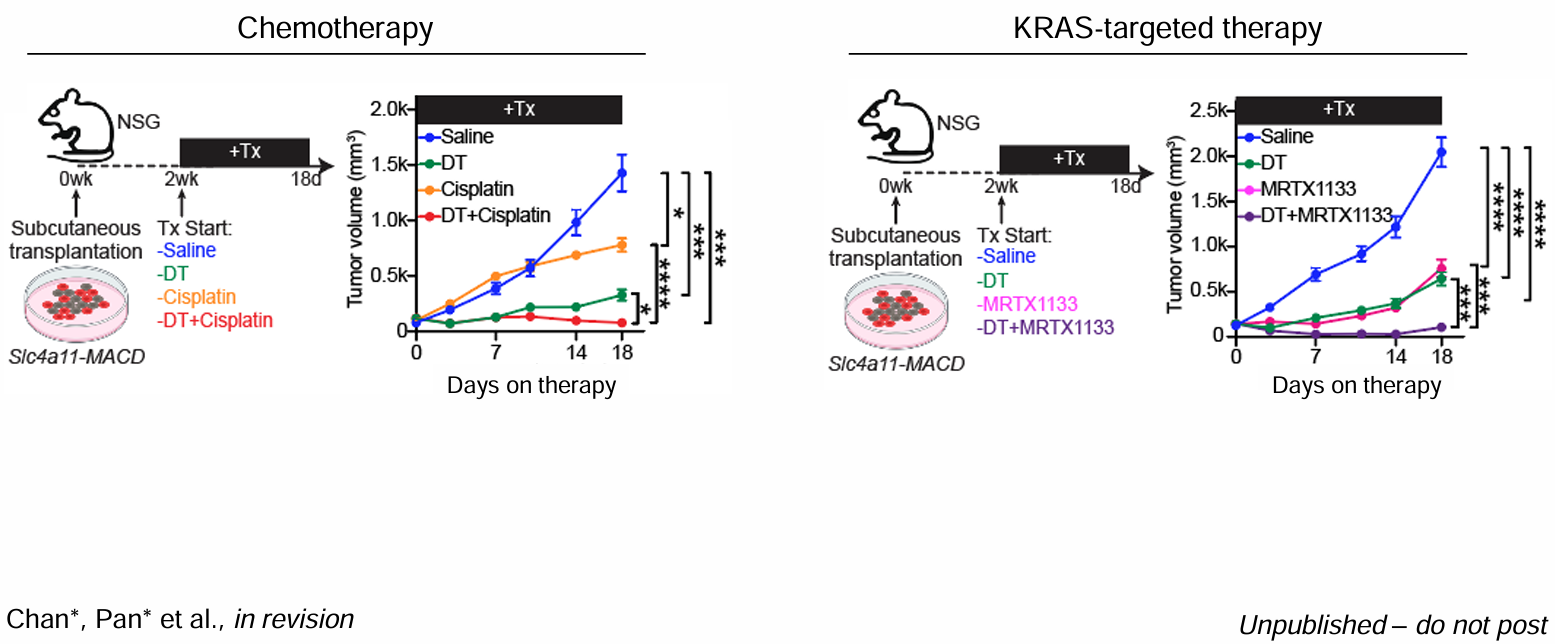
KRAS抑制诱导的谱系重编程:HPCS扩增的双刃剑
KRASG12C抑制剂(KRAS-G12Ci)的临床瓶颈
KRAS-G12Ci(sotorasib、adagrasib)客观缓解率约30–40%,中位无进展生存期6–8个月。单细胞测序提示治疗后肿瘤内出现富集AT2标志(Sftpc、Lyz2)的残留细胞群,其同时表达HPCS模块基因,提示“谱系重编程”而非单纯清除。
KRAS抑制-介导的去分化机制
转录重编程:KRAS抑制解除MAPK对Sox2的抑制,Sox2↑-YAP↑协同驱动AT2-HPCS转换。
代谢重接线:KRAS阻断后糖酵流下降,线粒体氧化磷酸化增强,乙酰-CoA减少导致染色质乙酰化水平降低,促进HPCS相关基因沉默-激活切换。
微环境互作:KRAS-G12Ci诱导的DNA片段释放激活cGAS-STING,招募IL-6⁺巨噬细胞,维持HPCS生态位。
联合干预策略
靶向HPCS核心通路:YAP/TAZ抑制剂、BET抑制剂(JQ1)与KRAS-G12Ci三联,可显著降低Sox2⁺HPCS比例。
表观遗传钳制:DNA甲基转移酶抑制剂联合组蛋白去乙酰化酶抑制剂锁定HPCS向AT1终末分化,阻断可逆转换。
免疫-代谢协同:IDO1抑制剂联合PD-1单抗,恢复CD8⁺ T细胞对HPCS的识别,同时抑制IL-6-STAT3信号,破坏HPCS生态位。
结论与展望
细胞状态可塑性为LUAD耐药研究开辟新维度。HPCS作为连接AT2干细胞与MRD的“桥梁”,其动态转录-表观-代谢网络为干预提供多重抓手。未来研究需:
构建患者来源HPCS类器官与PDX模型,验证靶点可行性。
开发单细胞分辨率下的非侵入式HPCS监测(如ctDNA甲基化-转录组双组学)。
设计适应性临床试验,将HPCS靶向药物整合至KRAS-G12Ci一线或维持治疗,以期实现MRD清除和长期无复发生存。
排版编辑:肿瘤资讯-Bear











 苏公网安备32059002004080号
苏公网安备32059002004080号


