长期以来,放化疗是局晚期不可切除非小细胞肺癌(NSCLC)的标准治疗方案。PACIFIC研究证实了放化疗后度伐利尤单抗巩固治疗对比安慰剂可显著延长患者的无进展生存期(PFS),使得放化疗后序贯免疫巩固治疗成为了新的标准治疗模式。然而,对于免疫巩固治疗停药后的长期安全性及后续治疗相关的报道较少,尽管PACIFIC-R研究报告了PACIFIC 方案在真实世界环境中的长期有效性,但这项回顾性研究仅纳入了参与早期使用计划(EAP)的患者。日本研究者开展了AYAME研究,旨在前瞻性评估PACIFIC方案的安全性和有效性。不久前,该研究的最终分析结果全文发表于《Journal of Thoracic Oncology》,成功在真实世界中验证了PACIFIC模式的有效性和安全性[1]。
研究方法
这项多中心、非干预性队列研究(UMIN000037090;NCT03995875)在日本52个中心开展,从2019年7月至2020年12月期间,招募了计划在接受同步化放疗(cCRT)后用度伐利尤单抗治疗的不可切除III期NSCLC患者。患者接受度伐利尤单抗治疗最长12个月,并前瞻性随访长达3年。2023年12月,患者随访完成,研究者使用电子病例报告表收集了患者的标准人口统计学和临床数据。
研究的安全性终点是在开始度伐利尤单抗治疗后的3年内发生的间质性肺病(ILD)和特殊关注的不良事件(AESIs)的发生率。并在整个研究期间对任何级别的ILD进行评估。本研究中定义的AESIs包括:肝功能障碍、甲状腺功能障碍、肾上腺功能障碍、肾脏疾病、输液反应、结肠炎/严重腹泻、1型糖尿病等。根据研究者判断记录 AESIs 和 ILD 的严重程度,并使用CTCAE 5.0进行分级。包括放射性肺炎在内的ILD和AESIs总计在五个时段进行评估:度伐利尤单抗治疗期间最多12个月,在度伐利尤单抗最后剂量后90天的随访;从开始度伐利尤单抗治疗到开始后续治疗;整个研究期间(从开始度伐利尤单抗治疗起最长3年);从度伐利尤单抗治疗结束到开始后续治疗;从度伐利尤单抗治疗结束到研究结束。
疗效终点方面,主要终点是从度伐利尤单抗治疗开始的真实世界无进展生存期(rwPFS)。次要终点是从度伐利尤单抗治疗开始的总生存期(OS),以及以下患者亚组的 rwPFS:肿瘤细胞中PD-L1表达(<1%、≥1%至<50%、≥50%);不同疾病分(IIIA、IIIB、IIIC、术后复发相当于不可切除III期NSCLC);CRT后开始使用度伐利尤单抗的时间(<14 天和≥14天);V20分类(<25%、≥25%至<30%、≥30%至<35%和≥35%);EGFR突变状态。其他终点包括停止度伐利尤单抗治疗的原因(不良事件和疾病进展 PD)以及后续治疗的详细信息。
研究结果
患者基线特征
研究总计招募了529名患者,最终512名患者使用了度伐利尤单抗治疗,排除掉一名撤回同意的患者后,安全性分析纳入了其中的511名。这部分患者的中位(范围)年龄为 69(31–88)岁,76.9%(n=393)为男性,13.9%(n=71)为仍在吸烟的患者,74.4%(n=380)为既往吸烟患者,51.3%(n=262)在开始度伐利尤单抗治疗前ECOG PS评分为0分(1分,n=239 [46.8%];2分,n=7 [1.4%])。
在基线时的合并疾病方面,11.0%(n=56)的患者有 ILD,17.8%(n=91)患有慢性阻塞性肺病,66.3%(n=339)患有其他疾病。有效性分析人群中纳入了495名患者。
安全性
ILD
在3年研究期间,从开始使用度伐利尤单抗到ILD首次出现/发生的中位时间为45天。在3年研究期间,包括度伐利尤单抗治疗后的时间段,387(75.7%)名患者发生了任意级别的ILD,其中:180名患者(35.2%)为1级,141 名(27.6%)患者为2级,57 名(11.2%)患者为3级,没有4级ILD发生,9名(1.8%)患者为5级。将3年时间分割为每两周一个时段,大多数ILD病例发生在开始度伐利尤单抗治疗后的≥4至<6周(n=75 [14.7%]),其次是≥2至<4周(n=64 [12.5%])和≥6至<8周(n=61 [11.9%])。
在度伐利尤单抗治疗期间,ILD首次出现/发生的中位时间为44.0天。在度伐利尤单抗治疗期间,380名(74.4%)患者发生了任何级别的ILD,其中:1级182名(35.6%),2级143名(28.0%),3级51名(10.0%),4级0名(0.0%),5级4名(0.8%)。
对于在度伐利尤单抗治疗后出现 ILD 的患者,包括后续治疗期间,从末次使用度伐利尤单抗到ILD首次出现/发生的中位时间为204天。43名(9.0%)患者发生了任何级别的 ILD,其中 5名(1.0%)患者发生5级ILD。将度伐利尤单抗治疗结束到研究结束的时段(包括后续治疗期间)分为每两周一个时段,大多数 ILD 病例发生在末次度伐利尤单抗剂量后≥10至<12周(n=5 [1.0%])。在治疗后期间未观察到与度伐利尤单抗治疗相关的 ILD。
AESIs
在度伐利尤单抗治疗期间,任何级别的最常见AESIs是甲状腺功能障碍(n=64 [12.5%])、肝功能障碍(n=37 [7.2%])和结肠炎(n=10 [2.0%])。
在度伐利尤单抗治疗期间观察到甲状腺功能障碍的患者有64名(12.5%),其中大多数为2级或更低,通常在开始度伐利尤单抗治疗后最多26周内发生,不过在治疗后期也观察到一些事件发生。这64名患者中,甲状腺功能障碍首次出现/发生的时间中位数(范围)为 86.5(16–416)天;尽管肝功能障碍的发病在治疗早期(最多12周)有更高的倾向,但发病时间在评估期间分布比较广泛;37发生肝功能障碍的患者首次出现/发生的时间中位数(范围)为43.0(7–348)天。
在3年随访期间,最常见≥3级AESIs是肝功能障碍(n=20 [3.9%])和结肠炎(n=10 [2.0%])。从末次度伐利尤单抗治疗到末次随访日之间(包括后续治疗期间),最常见的≥3级AESIs是肝功能障碍(n=8 [1.7%])和结肠炎(n=3 [0.6%]);未观察到5级 AESIs。在治疗后的随访时间里,未观察到与度伐利尤单抗治疗相关的AESIs。
在22名合并自身免疫性疾病的患者中,7名在开始度伐利尤单抗治疗前正在接受皮质类固醇/免疫抑制剂治疗,22名患者中的2名观察到3级或更高级别的AESIs,包括3级肝功能障碍(4.5%)和3级结肠炎/严重腹泻(4.5%)。相比之下,在489名未合并自身免疫性疾病的患者中,最常见的3级或更高级别的AESIs是肝功能障碍(n=14[2.9%])和结肠炎/严重腹泻(n=6名,[1.2%]),两种AESIs均有1例5级事件发生。在度伐利尤单抗治疗期间,82名(16.0%)患者出现多种AESIs(≥2 AESIs + ILD),333名(65.2%)患者仅发生一种AESI,96名(18.8%)患者未发生AESI。
有效性
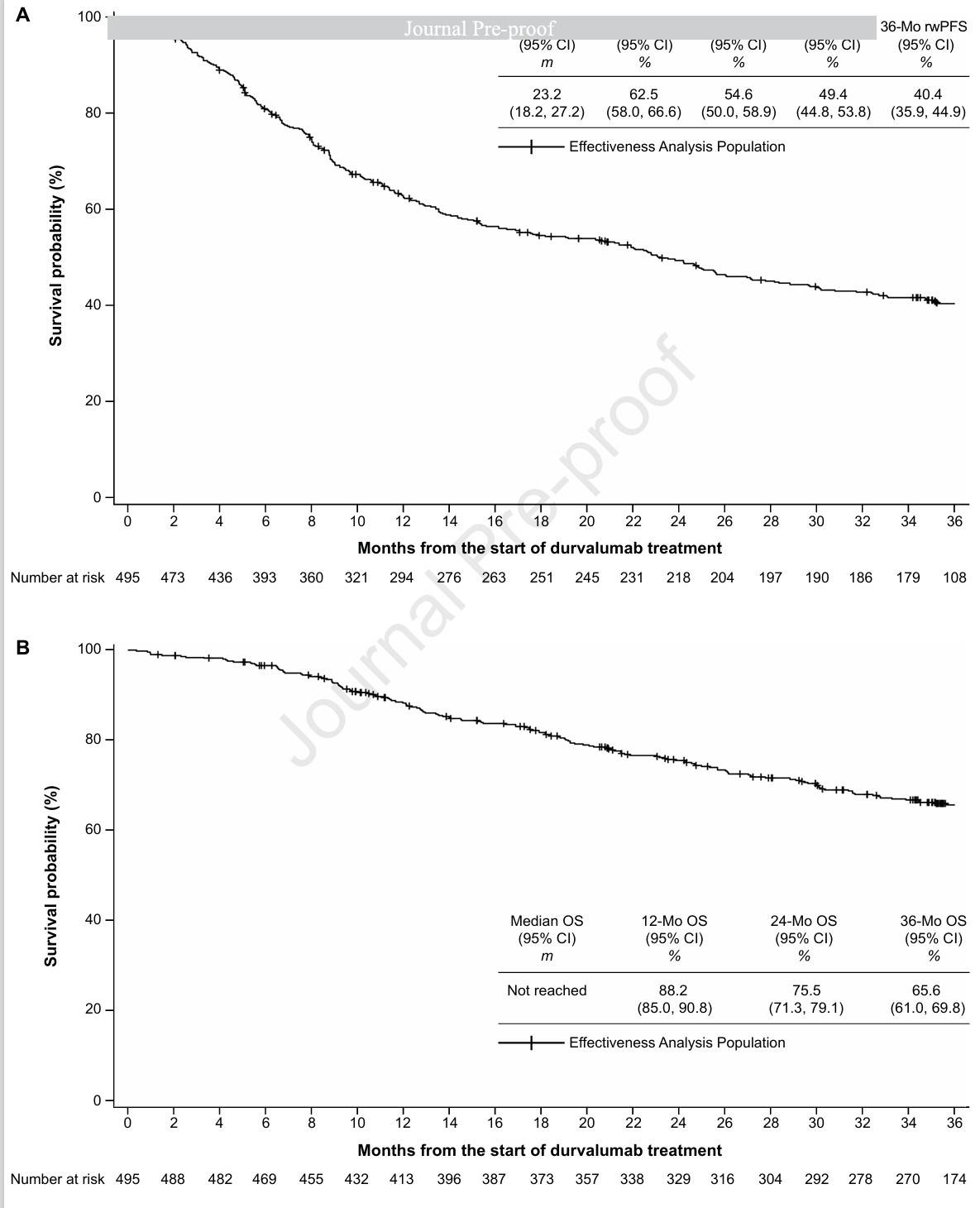
有效性分析人群的中位随访时间为 1069 天,中位rwPFS为23.2个月(95% CI 18.2-27.2),12个月、18个月、24个月和36个月的rwPFS 率分别为62.5%、54.6%、49.4%和 40.4%。中位OS尚未达到,24个月和36个月的OS率分别为75.5%和65.6%。
亚组分析中,按CRT前PD-L1 TPS评分划分,PD-L1 TPS≥50%患者的中位rwPFS尚未达到,PD-L1 TPS <1%患者的中位rwPFS为21.4个月,PD-L1 TPS ≥1%至<50%患者的中位rwPFS为13.5个月。
按CRT前疾病分期进行划分,IIIA期患者的rwPFS为22.8个月,IIIB期为22.8个月,IIIC期为19.1个月,总体表现相似。不过术后复发患者的rwPFS尚未达到,其12个月、18个月和24个月rwPFS率均优于IIIA、IIIB及IIIC期患者。
按CRT完成到开始度伐利尤单抗治疗的时间间隔划分,CRT后<14天开始度伐利尤单抗治疗的患者,中位rwPFS为26.0个月,≥14天开始的患者的中位rwPFS为22.6个月,两者总体数值上相当。
301例患者停止使用了度伐利尤单抗,停止治疗的原因包括疾病进展(PD,n=112)、不良事件(AEs,n=157)、撤回同意/自愿停止治疗(n=21)和其他原因(n=11)。
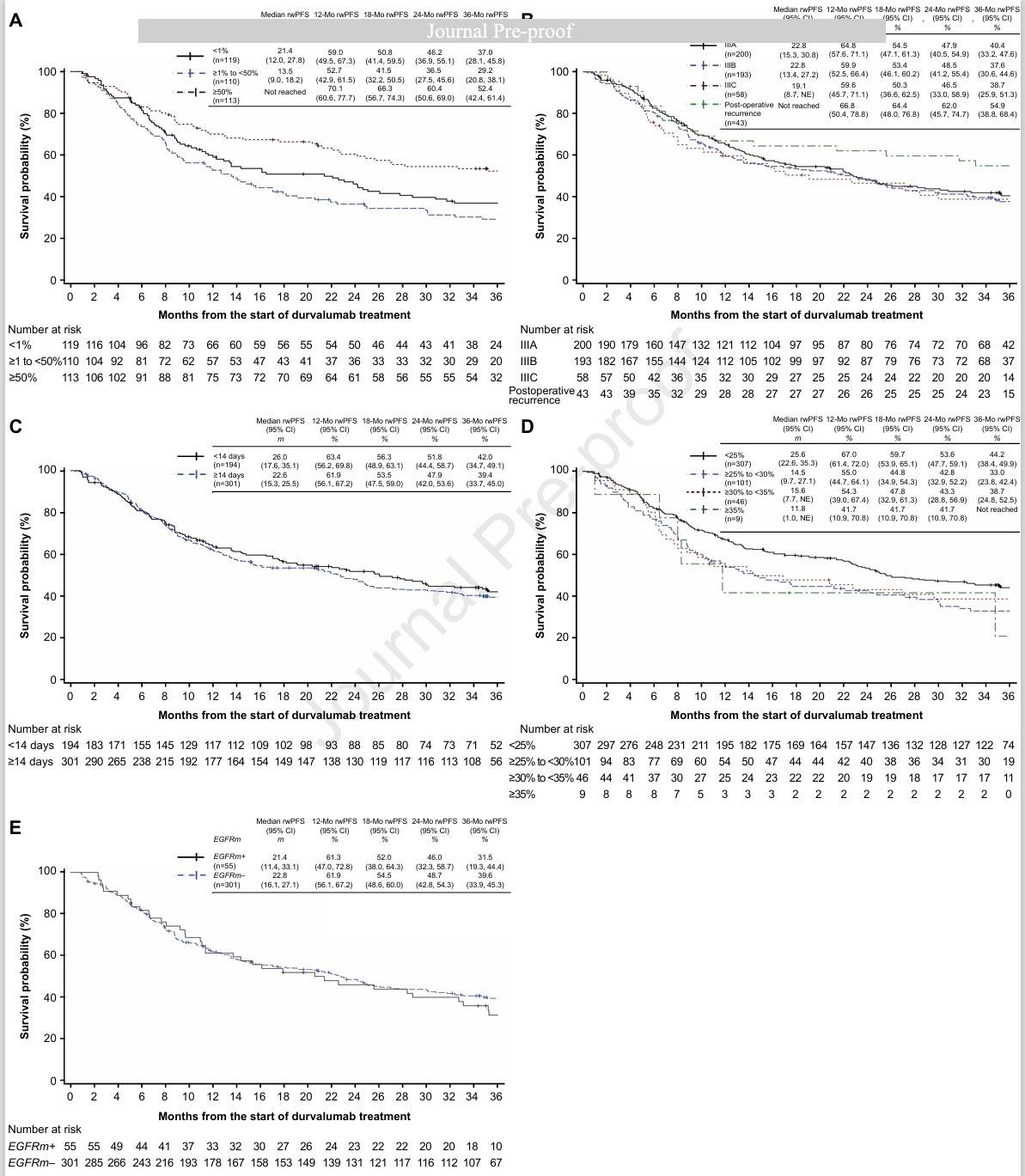
(A)CRT前PD-L1表达;(B)CRT前疾病分期;(C)CRT后开始使用度伐利尤单抗的时间;(D)V20(%);(E)EGFR突变状态
研究结论
这项真实世界、大型队列研究的结果前瞻性地展示并夯实了CRT后度伐利尤单抗巩固治疗的有效性和安全性。研究结果提示,PACIFIC方案在临床实践中未发现新的安全性问题,并在各亚组患者中均一致有效。
小编点评
本次报告的AYAME研究是迄今为止最大规模的前瞻性评估PACIFIC方案长期安全性和有效性的队列研究,研究结果证实了PACIFIC模式为患者带来的获益,以及可控的安全性特征,未发现新的安全性信号。研究的亚组分析结果也提示了一些值得参考的结论,例如发生AESI的患者对比未发生AESI的患者,显示出rwPFS的改善,这与此前NSCLC免疫治疗的一些研究结论类似,即一些免疫相关不良反应的发生可能作为提示了更好的疗效。当然,作为一项观察性研究,该研究存在一定局限性,对于rwPFS、ILD和AESI的评估可能存在一定差异。但其结果依然支持了在III期不可切除NSCLC中,对于CRT后未进展的患者进行度伐利尤单抗的巩固治疗。
[1] Kenmotsu H, et al. Long-Term Safety and Effectiveness of Durvalumab in Unresectable Stage III non-small cell lung cancer in Japan: A Multicenter Prospective Study (AYAME). J Thorac Oncol. 2025 Aug 18:S1556-0864(25)01014-7.
审批编号:CN-168823
过期日期:2025-12-24
排版编辑:肿瘤资讯-邓文普











 苏公网安备32059002004080号
苏公网安备32059002004080号


