胃癌作为全球高发的恶性肿瘤,尤其在东亚地区呈现高发态势,其治疗始终面临巨大挑战。近年来,随着新药研发和治疗理念的革新,胃癌的围手术期治疗格局发生了深刻变化。在2025 CSCO年会的胃肠肿瘤继教专场上,北京大学肿瘤医院张小田教授带来题为“胃癌围手术期治疗的共识与争议”的报告,系统梳理了当前治疗领域的最新共识,并深入剖析了七大悬而未决的临床争议,为胃癌的围术治疗提供了临床决策与研究探索的指导与参考。
北京大学肿瘤医院 副院长
北京大学肿瘤医院内蒙古医院 执行院长
主任医师、教授、博士生导师
科研方向:消化系统肿瘤(胃癌)防诊治一体化的临床与基础研究
首届国家杰出医师
北京市“登峰”人才培养计划团队负责人
消化系肿瘤整合防治全国重点实验室PI
中国临床肿瘤学会 理事、胃癌专家委员会 副主任委员等
中国抗癌协会 理事、肿瘤信息化管理专业委员会 主任委员等
中国女医师协会临床肿瘤学专家委员会 秘书长
北京癌症防治学会胃癌防治专家委员会 主任委员
致力于推动我国胃癌等消化系统恶性肿瘤精准诊疗水平走向国际前沿,牵头临床研究推动10种药物/方案进入临床实践,获批专利10项;近5年以第一或通讯作者(含共同)在JAMA、Nature、Lancet、JCO等主刊/子刊发表文章33篇,总影响因子447分,单篇最高引用371次;撰写指南27项, 24项研究改写33项国内外指南。
新思考:围手术期概念的扩展与治疗体系的重塑
在新的治疗时代下,“围手术期”的内涵已不再局限于传统的可切除局部进展期胃癌。随着转化治疗的成功,部分原本不具备手术机会的晚期或存在特殊转移的患者,如单一的肝转移、单一的卵巢转移患者,通过有效的药物治疗也可能获得根治性手术的机会。同时,新型化疗药物、靶向药物、抗体偶联药物(ADC)及免疫检查点抑制剂的涌现,打破了传统治疗类型的界限。这些变化共同呼唤着一个能够整合不同分期、治疗阶段和分子分型的新型临床分期体系,以更精准地指导治疗决策。
新共识:2025 CSCO指南更新要点解读
张小田教授详细解读了2025年CSCO胃癌指南在围手术期治疗方面的重要更新,这些更新反映了当前业界的普遍共识。
可手术切除胃癌整体治疗策略:指南将IVA期胃癌划定为不可切除范畴,更强调其系统治疗的重要性。将新辅助放化疗+胃切除术D2+术后化疗从I级推荐调整为II级推荐。
新辅助治疗方案的优化:新辅助化疗DOS和FLOT4方案的推荐级别由II级提升至I级(1B类)。同时,SOX方案被新增为食管胃结合部癌的I级推荐(1A类)。新辅助放化疗由I级推荐调整为II级。
免疫治疗地位确立:针对dMMR/MSI-H这一特殊亚型,指南新增了新辅助免疫治疗的推荐。其中,PD-1单抗联合CTLA-4单抗作为II级推荐(2B类),PD-1单抗联合化疗则作为III级推荐(2B类)。这一更新基于GERCOR NEONIPIGA、INFINITY等多项研究的阳性结果,研究显示双免方案在新辅助治疗中可带来病理完全缓解(pCR)率的提升。
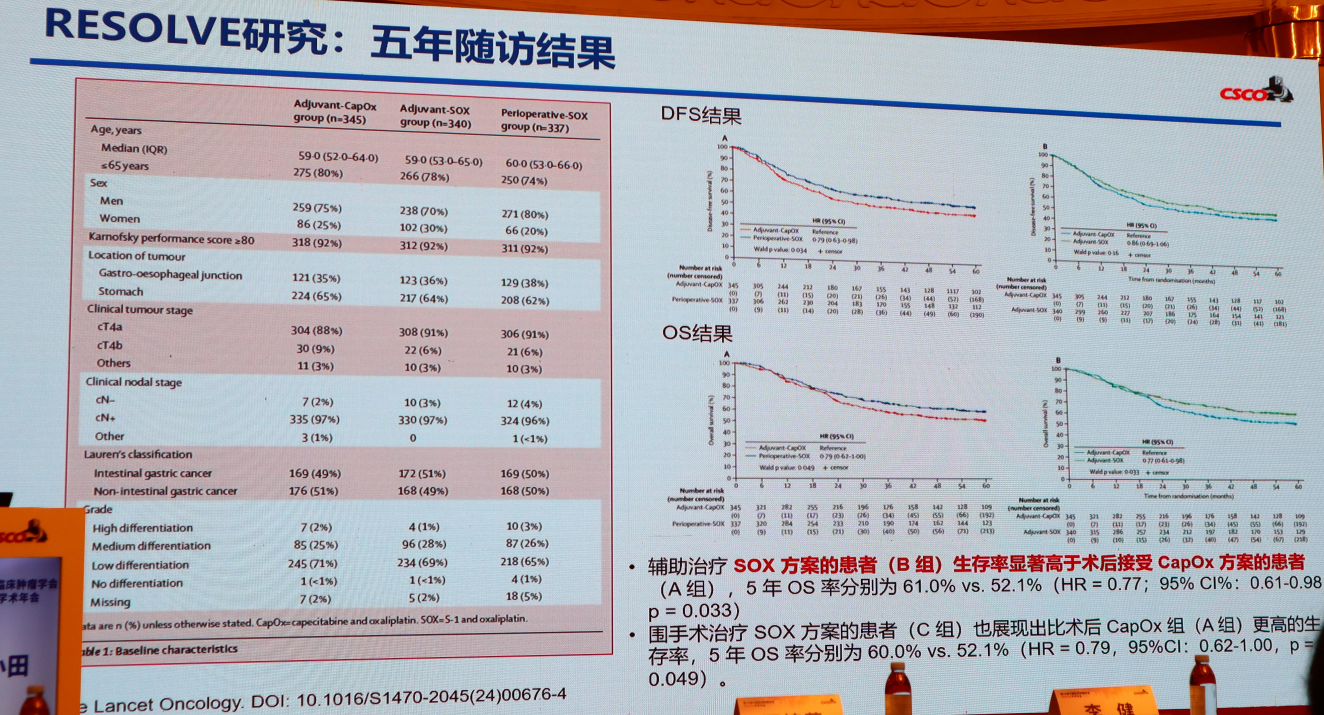
辅助治疗标准的变更:术后辅助SOX方案的推荐级别由II级调整为I级(1A类),RESOLVE研究的五年随访数据显示,其生存获益显著优于术后接受CapOx方案的患者(5年OS率:61.0% vs. 52.1%)。而围手术期SOX方案也展现出比术后CapOx组更高的生存率(5年OS率:60.0% vs. 52.1%)。相应地,XELOX方案则从I级推荐降为II级推荐。
新争议:七大悬而未决的临床问题
尽管共识日益增多,但围手术期治疗领域仍面临诸多争议与挑战,需要通过更多临床研究来解答。
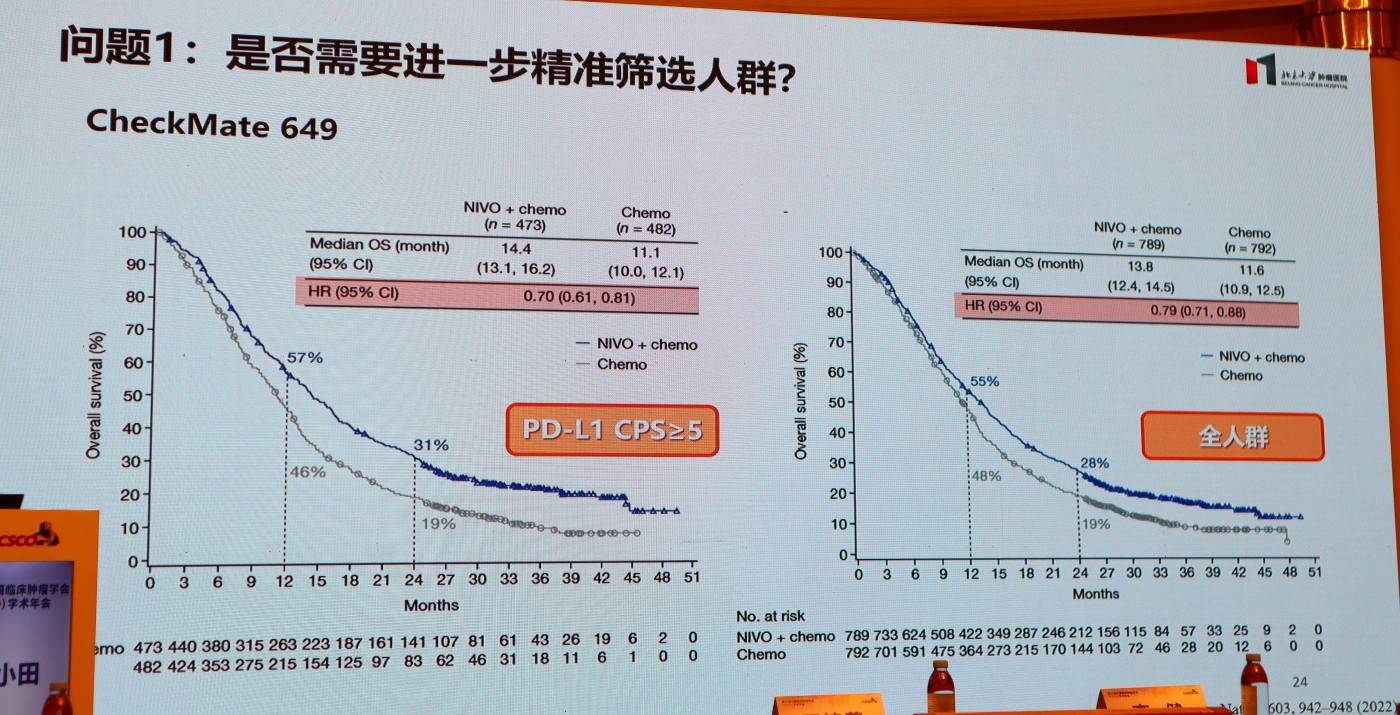
1.人群筛选是否需要更精准?
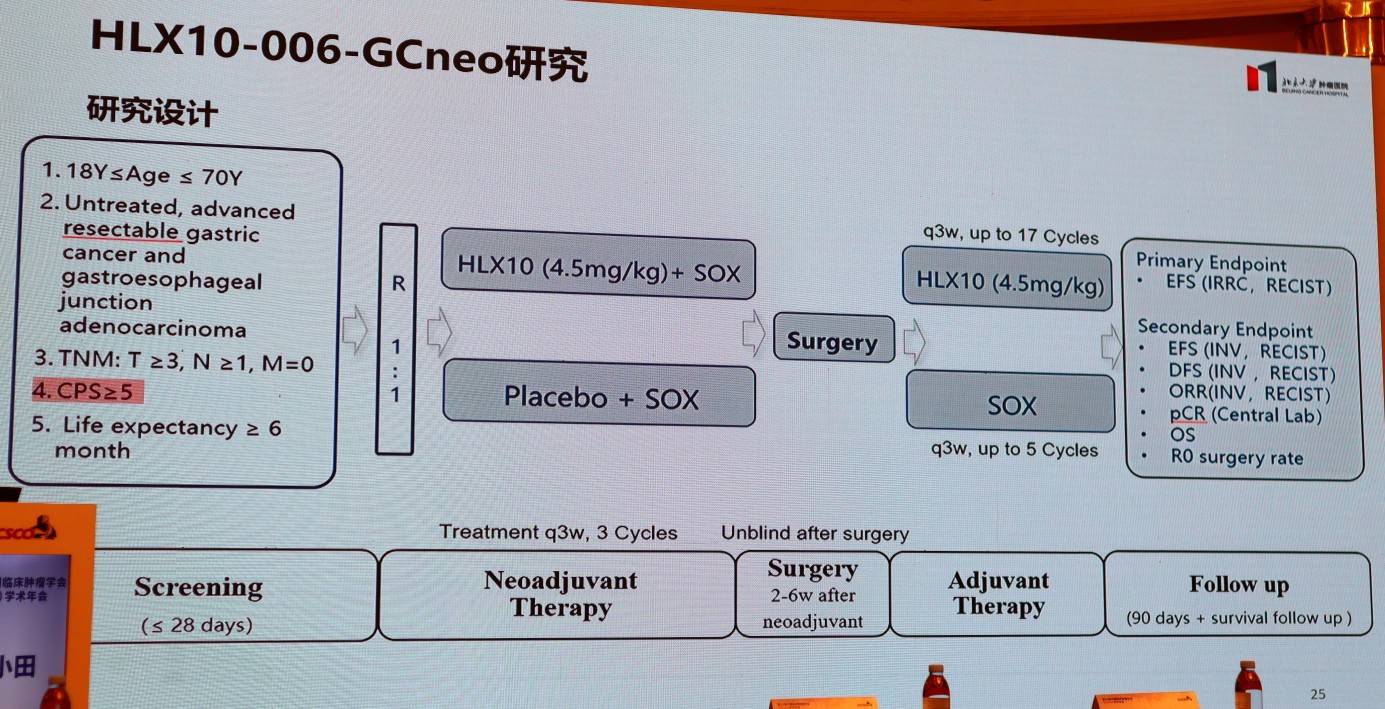
这依然是当前免疫治疗时代面临的核心争议之一。一方面,以CheckMate 649研究为代表的国际大型试验,证实了“化疗+免疫”方案在全人群中的生存获益,且PD-L1 CPS≥5的亚组获益更为明显;另一方面,国内多项关键临床研究在设计上将CPS≥5作为重要的入组或分层依据。对此,张小田教授分析指出,虽然全人群普适的治疗策略有其数据支持,但她个人更倾向于进行精准筛选。其考量在于,对于CPS<5的患者,可能存在其他更适合、更高效的治疗选择。因此,如何在确保广泛人群获益与实现个体化最优选择之间取得平衡,仍是未来临床研究需要重点解答的难题。
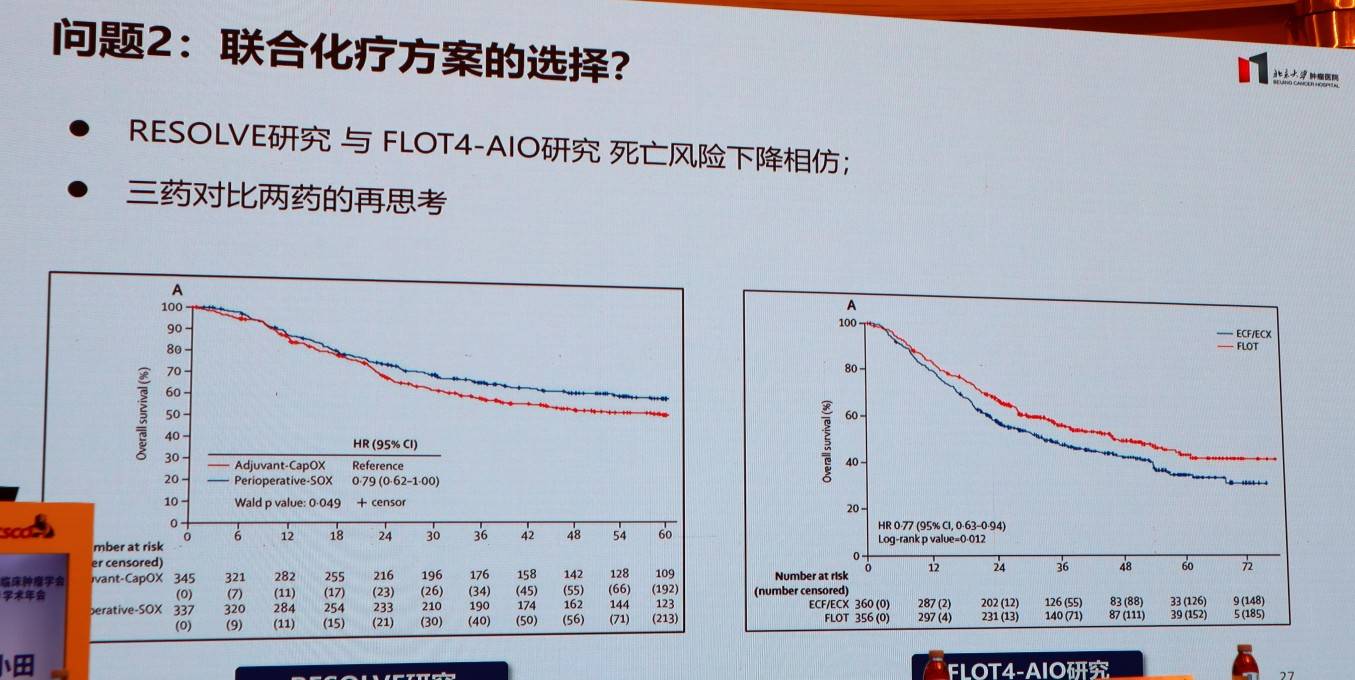
2.联合化疗方案如何选择?
RESOLVE研究中的两药方案(SOX)与FLOT4-AIO研究中的三药方案(FLOT)相比,死亡风险下降程度相仿。这引发了对两药与三药方案疗效与毒性平衡的再思考。转移性结直肠癌(mCRC)治疗中三药化疗较两药更为有效,北肿团队也进行了胃癌围术期三药对比两药的RESOLVE-2研究,基于初步数据而言,三药较两药并未提高pCR率,但明显提高了主要病理缓解(MPR)率。
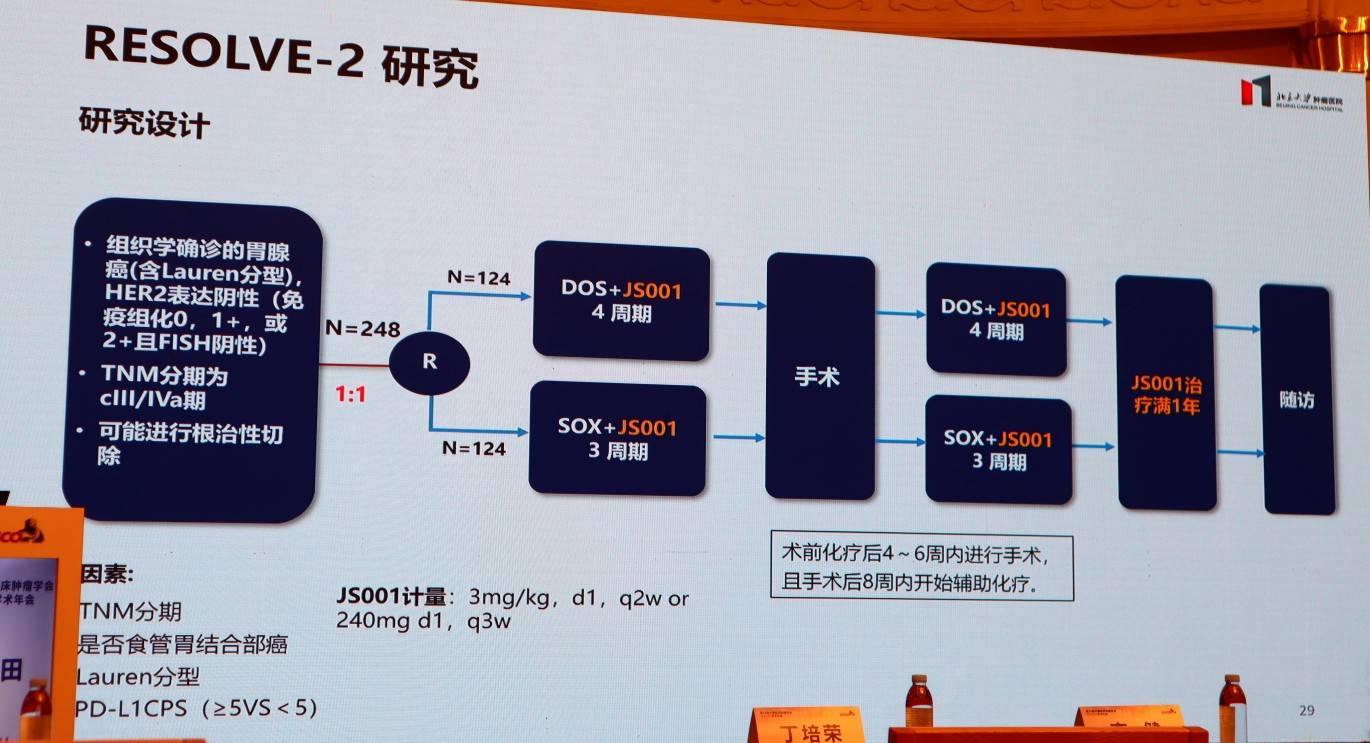
3.新策略与新药物的前景如何?
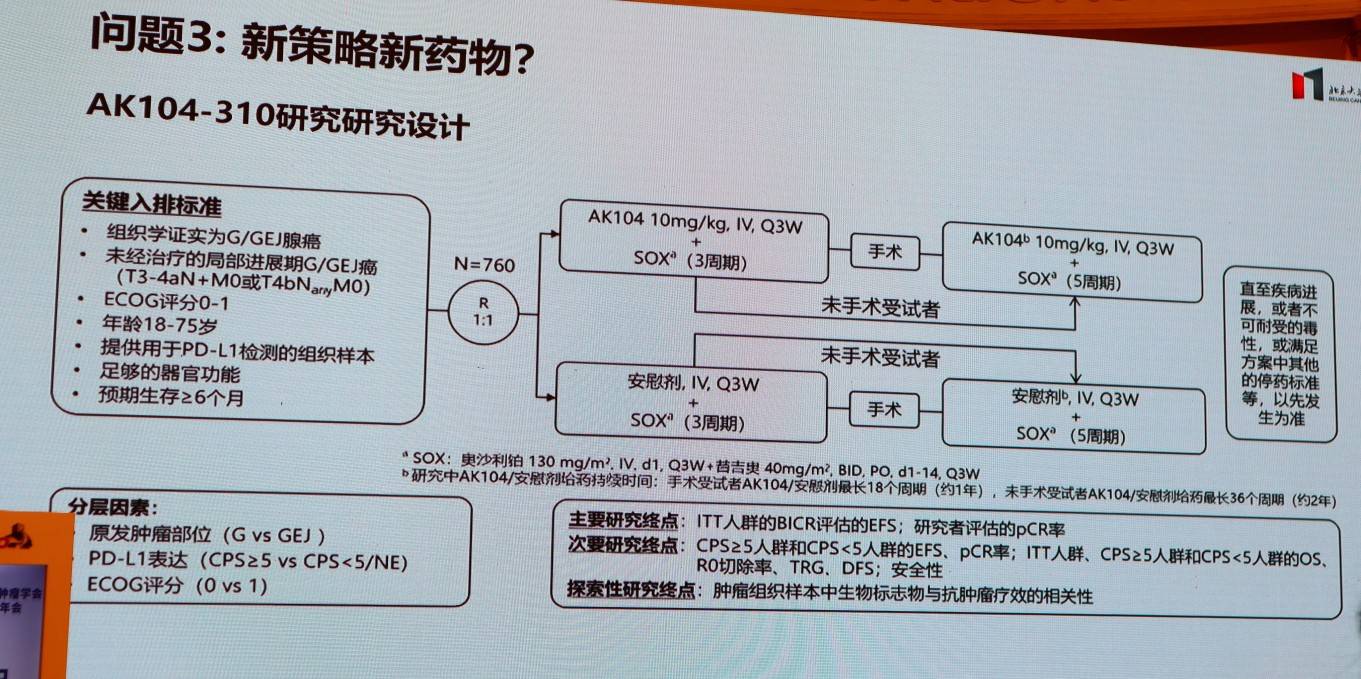
针对CPS<5的胃癌患者新策略或新药物的探索也备受关注。康方生物的卡度尼利单抗在晚期胃癌CPS<5患者中取得获益之后,其当前也在开展围术期治疗领域的探索——AK104-310研究,旨在评估PD-1/CTLA-4双抗联合化疗的疗效。这些新策略能否转化为生存获益,仍需长期数据验证。
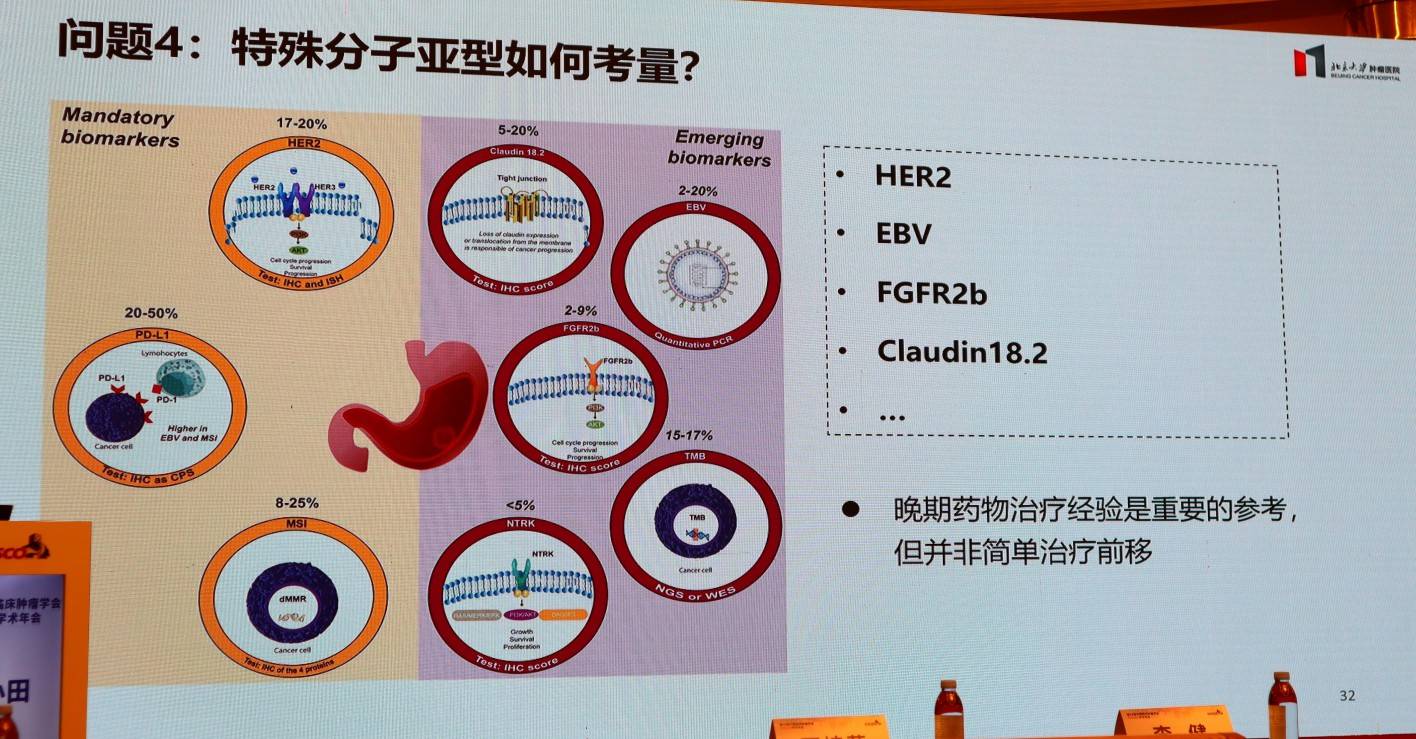
4.特殊分子亚型如何考量?
针对HER2阳性胃癌,RESOLVE-HER2研究证实,靶免化围术期治疗可将pCR率显著提升至38.1% 。KN026+KN046等研究正在探索更为强效的双抗联合双免新辅助方案,以期获得更优的疗效。
dMMR/MSI-H作为对免疫治疗高度敏感的“热肿瘤”,该亚型在新辅助免疫治疗中展现出巨大潜力。GERCOR NEONIPIGA和INFINITY研究均显示,双免新辅助方案可使pCR率达到近60%。RESOLVE-dMMR等研究则在进一步探索此类患者的治疗策略。
EBV阳性是另一类对免疫治疗反应良好的亚型。NICE研究的EBV阳性队列数据显示,经过术前免疫治疗,患者的pCR率达到了25.0%,MPR率为37.5% 。目前,RESOLVE-EBV等研究正在对此类患者进行更深入的探索。
除了上述相对成熟的标志物,针对FGFR2b(如BEMAFLOT研究) 和Claudin18.2(如NEO-CLAUD研究) 等新靶点的围手术期研究也已起步,虽然尚处早期,但前景可期。
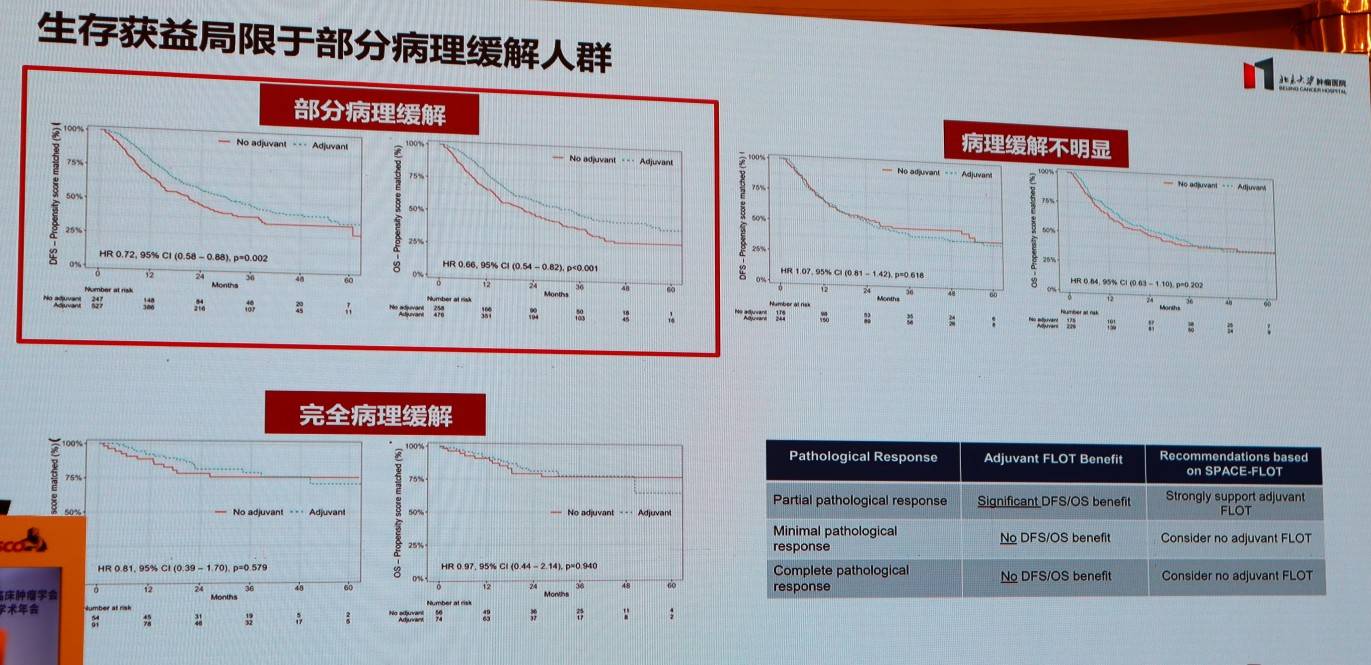
5.术后不同病理学反应的患者,治疗策略的选择?
SPACE-FLOT研究的真实世界数据显示,术前FLOT治疗后仅部分病理缓解(Partial Pathological Response)的患者能从术后辅助FLOT治疗中获益,而病理缓解不明显或已达pCR的患者则获益有限。如何根据术后病理评估结果,为患者“量体裁衣”制定辅助治疗策略(治疗强化、降级或豁免),是实现精准管理的重要方向。

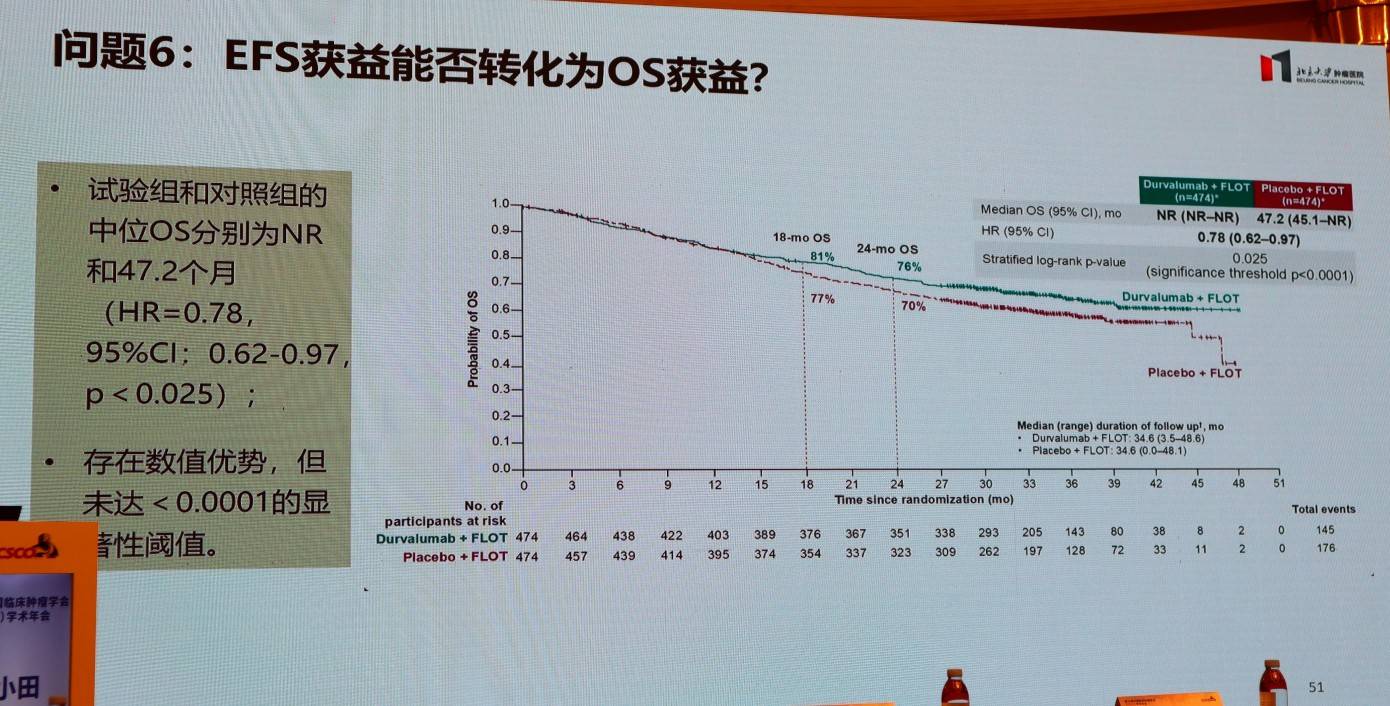
6.EFS获益能否转化为OS获益?
在MATTERHORN研究中,度伐利尤单抗联合FLOT方案显著改善了EFS,但在OS方面仅观察到数值优势,尚未达到统计学显著性阈值。在精准治疗时代,EFS是否仍可作为OS的可靠替代终点?是否可能结合近期指标和远期指标形成综合指标作为新辅助治疗策略的替代性研究终点?以上问题仍值得深入探讨。
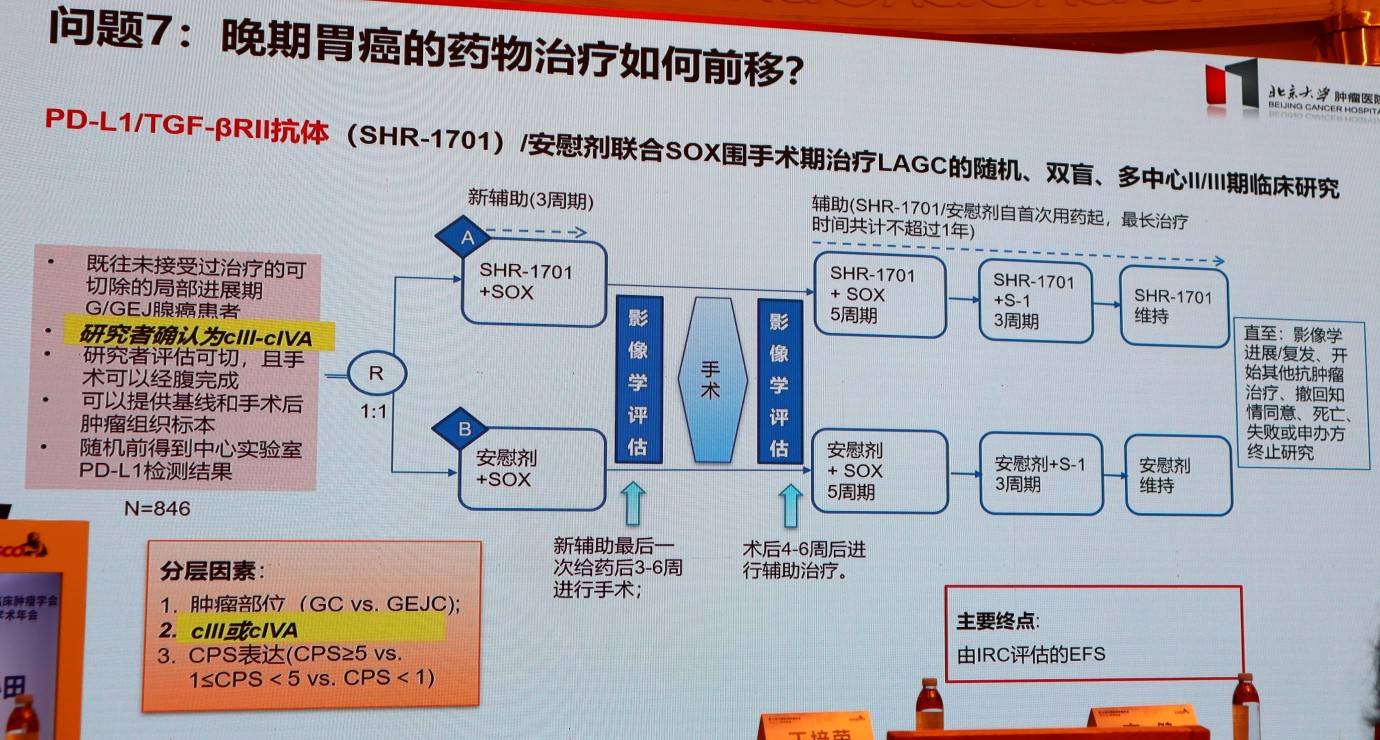
7.晚期胃癌的药物治疗如何前移?
一个关键的临床问题是:在晚期胃癌治疗中取得成功的药物,其疗效是否一定能“前移”到围手术期治疗中 ?以一款在晚期一线治疗获得阳性结果的PD-L1/TGF-β双特异性抗体(SHR-1701)为例,一项同期开展的用于新辅助治疗的临床研究,因在II期阶段未能观察到联合方案优于单纯化疗的pCR率或局部控制效果而未进入III期研究。深入的生物学分析提示,TGF-β在肿瘤疾病进展的早期和晚期阶段的作用不同。该案例提示,晚期胃癌的治疗经验不能简单地照搬到围手术期,这也对未来临床研究的科学设计提出了更高的要求。
总结与展望
胃癌围手术期治疗正迈向“个体化”的精准决策时代。未来的核心在于“精准预测与决策”。这要求临床医生在治疗的全流程中,从治疗前的精准分型和疗效预测,到术前治疗中的密切监测(如MRD、影像学),再到根据术后病理反应制定个体化的辅助治疗方案,为每一位患者找到最优的治疗路径,从而最大程度地改善预后。
排版编辑:肿瘤资讯-AS











 苏公网安备32059002004080号
苏公网安备32059002004080号


