前天一位工业界朋友问到我 如今肿瘤领域的痛点和机会点在哪里
?我回答他:
痛点:1. 缺乏新的突破性的治疗方式;但说实话靶向和免疫出来之前咱也都么想到,所以有时候突破就在一瞬间;2. 下一代KOL的成长,是否有上一代那样的领军人物;3. 同质化、竞争激烈、速度快;对于MNC来讲,相比国内biotech很难看到研发优势。
机会和痛点一起:1. 就像后来的IO要不要,如同鸡肋?但若价格合适也是增长点,比如ADC、双抗,若找到好的;2. 与年轻一代高潜KOL伴随成长,共同成长,共同引领:3. 那就是如今的合作和BD了,也是大家都在做的。
此外,如今 AI用于研发也开始了下一代的探索,应该是会大大提升速度,过阵子老王我也总结一篇一起学习一下。
而肿瘤免疫治疗领域是这些年来的最热治疗方法与研发话题,近期发表于《Journal for Immuno Therapy of Cancer》的一篇文章,聚焦癌症免疫治疗领域,梳理了免疫肿瘤学(IO)的发展历程、当前疗法、新兴疗法构建、技术应用、存在挑战及未来展望,旨在推动安全、持久且可及的免疫疗法发展。
正好也给大家一些思路和方向上的参考。
免疫肿瘤学的发展历程
免疫肿瘤学(IO)并非近年突发突破,而是历经长期演进:
在早期探索阶段,19世纪90年代,William Coley首次尝试用
细菌毒素治疗癌症;20世纪80年代,
白细胞介素-2(IL-2)疗法应用,美国国立卫生研究院(NIH)的Steven Rosenberg开展
早期肿瘤浸润淋巴细胞(TIL)治疗方案,为后续研究奠定基础。
自2010年代进入了快速发展阶段,
免疫检查点抑制剂疗法兴起,改变癌症治疗格局;近年来,
嵌合抗原受体(CAR)T细胞、双特异性抗体、新抗原疫苗、抗体药物偶联物(ADCs
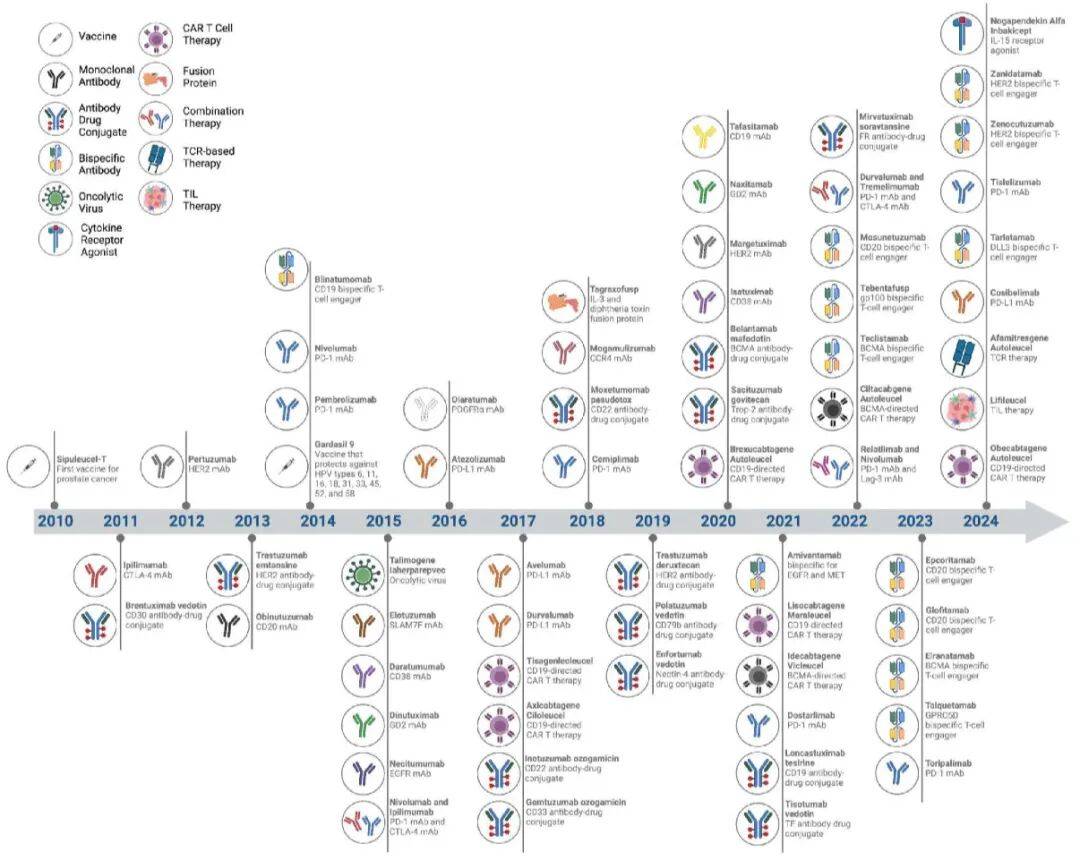
)等疗法持续迭代。过去15年,IO疗法获美国食品药品监督管理局(FDA)多次批准,且在全球范围内应用逐步扩大,成为多种肿瘤的标准治疗手段之一。
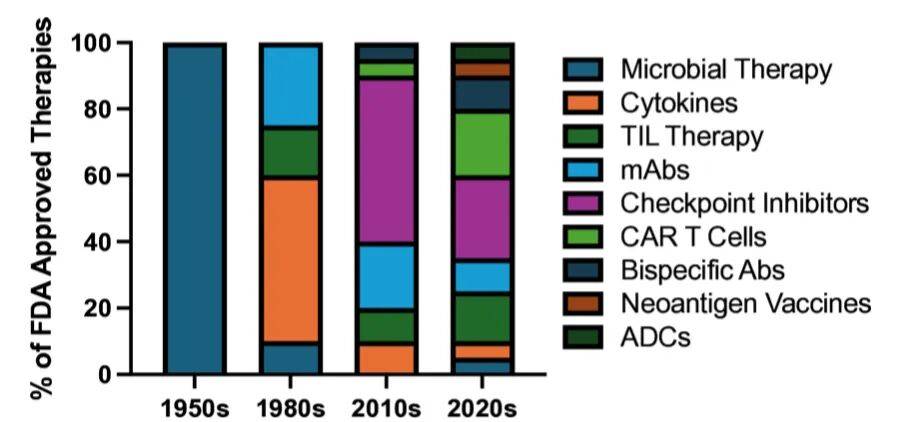
过去到如今的免疫疗法及局限
利用免疫系统清除癌症的理念可追溯至数百年前,约公元前1550年的《 Ebers Papyrus 》记载了早期癌症治疗方法,这些方法可能通过诱发感染来促使肿瘤消退。在中世纪,Saint Peregrine Laziosi在细菌感染后出现了肿瘤自发性消退,提示机体对感染的免疫应答也可对抗癌症。这些早期观察为刻意利用病原体刺激抗肿瘤免疫奠定了基础。
19世纪末,William B Coley博士开创了使用细菌毒素治疗癌症的先河,证实感染诱导的免疫应答可介导肿瘤消。这一理念逐渐发展为现代溶瘤病毒疗法(OV)——该疗法利用基因工程改造或天然存在的病毒,选择性感染并破坏癌细胞。如今,H101、Imlygic和Delytact这三种溶瘤病毒已在全球范围内获批,标志着该领域取得了进展。尽管溶瘤病毒在转移性疾病治疗中的疗效有限,但下一代溶瘤病毒在合理联合使用时,或许能带来更显著的全身性治疗获益。
微生物与溶瘤病毒疗法:从早期利用细菌感染诱导肿瘤消退,发展为现代溶瘤病毒疗法(OV),目前全球已批准H101、Imlygic、Delytact三种溶瘤病毒,但在转移性疾病治疗中疗效有限。
肿瘤疫苗:预防性疫苗(如人乳头瘤病毒(HPV)疫苗、乙型肝炎病毒疫苗)显著降低相关癌症发病率;治疗性疫苗(如Sipuleucel-T)因肿瘤异质性和免疫逃逸问题,疗效受限,新抗原疫苗和RNA平台疫苗在早期临床试验中显示出潜力。
细胞因子疗法:高剂量IL-2和I型干扰素是较早获批的IO药物,当前研究聚焦于工程化细胞因子(如IL-15超激动剂N-803)及细胞因子与抗体/免疫受体的融合构建体,以提升疗效并降低毒性。
过继细胞移植(ACT)疗法:受异基因造血干细胞移植(allo-HSCT)启发,包括TIL疗法、T细胞受体(TCR)工程细胞疗法、CAR T细胞疗法。其中,CAR T细胞疗法在血液系统恶性肿瘤中疗效显著,但在实体瘤中面临抗原异质性、免疫抑制、肿瘤浸润困难等问题。
过去的经验带来了免疫治疗的未来之路,以上的疗法因缺乏肿瘤特异性,常导致难以承受的全身性毒性反应。此外,早期方法仅专注于激活免疫系统的手段,却未考虑肿瘤为逃避攻击而利用的次级免疫调节机制。而“肿瘤会利用免疫抑制通路,
PD-1/PD-L1通路”这一关键发现,推动了检查点阻断疗法的变革,并重新定义了免疫治疗(IO)的设计思路。如今的策略强调对肿瘤微环境(TME)内存在的促免疫原性通路和抗免疫原性通路进行精准靶向与调控。
现在也观察到,
不同类型的肿瘤对不同免疫治疗平台的反应存在差异。例如,免疫检查点抑制剂(ICIs)在黑色素瘤和非小细胞肺癌治疗中占据主导地位,或许得益于这两类肿瘤较高的肿瘤突变负荷和预先存在的免疫浸润。嵌合抗原受体T细胞(
CAR-T细胞)疗法为血液系统恶性肿瘤带来了革命性突破,尤其在B细胞淋巴瘤和急性淋巴细胞白血病(ALL)的治疗中。肿瘤浸润淋巴细胞(
TIL)疗法在黑色素瘤治疗中展现出疗效,目前正逐步应用于人乳头瘤病毒阳性(HPV+)肿瘤。
双特异性T细胞衔接器在多发性骨髓瘤和急性髓系白血病(AML)的治疗中越来越受关注。这些具有治疗方式特异性的成功案例,凸显了使免疫治疗策略与每种肿瘤类型独特免疫特征相匹配的重要性。
新兴免疫疗法技术
免疫检查点抑制剂(ICIs)的优化
针对细胞毒性T淋巴细胞相关蛋白4(CTLA-4)、程序性死亡蛋白1(PD-1)/程序性死亡配体1(PD-L1)的ICIs已革新癌症治疗,但单药耐药普遍。当前研究转向联合策略:
1. 靶向其他检查点(如LAG-3、TIM-3、TIGIT)或激活共刺激受体(如CD27、4-1BB、OX40);
2. 与化疗、放疗联合使用,改善治疗响应;
3. 开发双特异性抗体和Fc增强抗体,提升在“冷肿瘤”(如微卫星稳定转移性结直肠癌)中的疗效。
双特异性抗体的发展
双特异性抗体可同时结合肿瘤相关抗原(TAA)和免疫效应细胞,已获10余种FDA批准(如针对CD19/CD3的blinatumomab),目前向多方向拓展:

1. 靶点拓展:从血液瘤靶点(CD19)转向实体瘤靶点(如HER2/HER3、Delta样配体3(DLL3));
2. 功能升级:研发三特异性抗体,增强免疫突触形成和细胞因子递送功能;
3. 机制优化:除激活T细胞(通过CD3)外,还可靶向抑制性受体(PD-1、CTLA-4)、共刺激受体(4-1BB)及髓系细胞检查点(CD47、CD40),改善肿瘤微环境。
抗体偶联物的创新
1. 抗体药物偶联物(ADCs):将小分子药物与单克隆抗体连接,实现精准递药,减少脱靶效应和全身毒性,是当前肿瘤治疗领域增长较快的技术方向之一。
2. 免疫刺激抗体偶联物(ISACs):向肿瘤微环境递送免疫激活分子(如Toll样受体(TLR)激动剂、干扰素基因刺激因子(STING)激动剂)。TLR基ISACs(如NJH395、SBT6050)因毒性问题进展受阻,STING基ISACs(如XMT-2056、TAK-500)已进入临床试验阶段。
过继免疫疗法的新突破
(Armored T cell therapies)
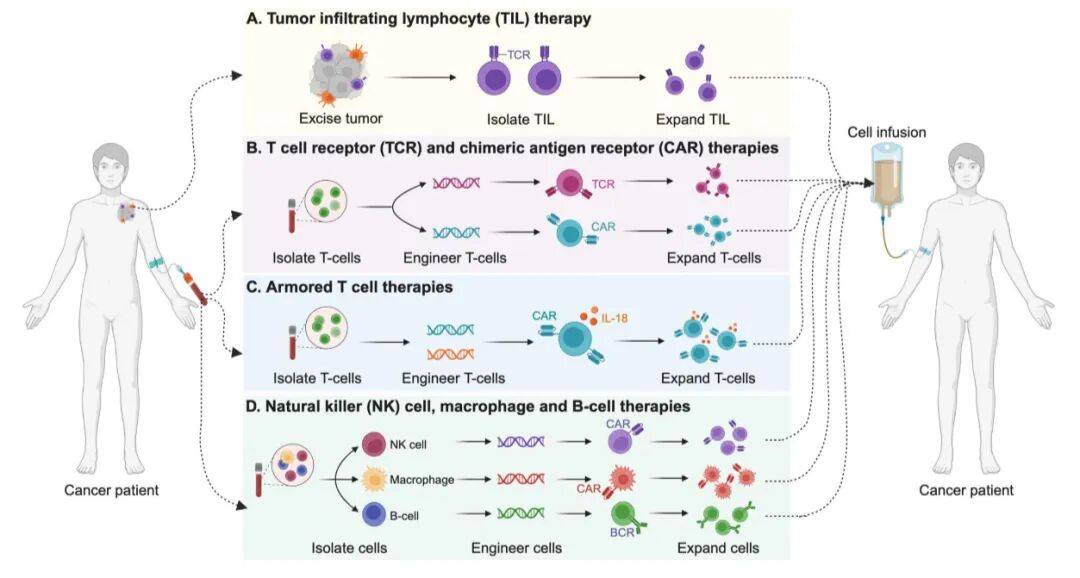
1. TIL疗法 :2024年2月,FDA批准首个TIL疗法lifileucel用于晚期黑色素瘤。当前研究通过添加膜结合IL-15、联合 pembrolizumab、优化扩增方案等,解决T细胞终末分化、制造周期长等问题。
2. TCR工程疗法 :从外周血生成肿瘤特异性T细胞,但受HLA限制(如HLA-A*02:01在不同人群中分布差异大),且存在脱靶毒性风险,目前正优化抗原预测算法、探索非HLA限制TCR。
3. CAR工程疗法 :四代CAR T细胞持续迭代,四代“装甲”CAR T细胞通过添加细胞因子(IL-15、IL-18)、诱饵受体(如显性负性TGF-βRII)、抗体样蛋白(如抗PD-1单链可变片段),增强抗肿瘤活性和肿瘤微环境适应能力,同时探索与ICIs、溶瘤病毒的联合治疗。
4. 非T细胞疗法 :CAR-NK细胞、CAR-巨噬细胞、工程化B细胞疗法逐步发展。CAR-NK细胞毒性低且可“现成使用”,但存续期短;CAR-巨噬细胞可增强吞噬功能,已在HER2+实体瘤中开展早期试验;工程化B细胞疗法聚焦抗原呈递和免疫调节,目前临床数据有限。
溶瘤病毒疗法的升级
1. 基因修饰 :为溶瘤病毒添加转基因(如GM-CSF、IL-12)或整合免疫检查点抑制剂,提升免疫激活效果;
2. 给药方式 :探索全身给药技术,如改造病毒靶向肿瘤抗原、利用“特洛伊木马”微生物递送病毒基因组;
3. 联合治疗 :与放疗、化疗、ICIs、过继细胞疗法联合,发挥协同作用。
新抗原疗法的探索
新抗原源自肿瘤体细胞突变,具有肿瘤特异性,是精准治疗的理想靶点:
1. 发现技术 :通过全外显子测序、生物信息学预测、质谱分析鉴定新抗原;
2. 治疗形式 :以mRNA疫苗、DNA疫苗、细胞疫苗(树突状细胞疫苗、肿瘤细胞疫苗)为主,目前面临新抗原鉴定难、个性化制造成本高的问题,多与ICIs联合开展试验。
技术助力免疫疗法发展
人工智能(AI)与机器学习(ML)
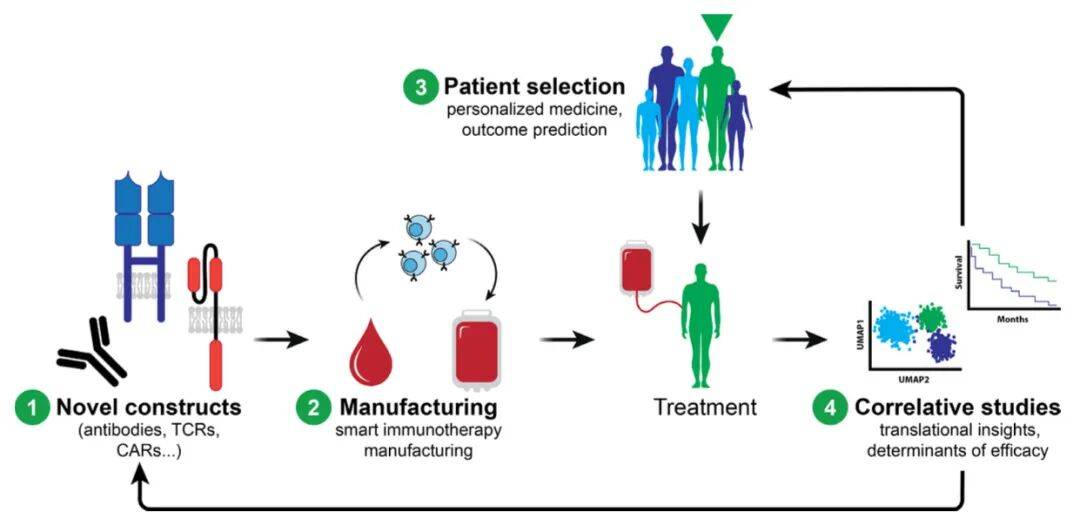
1. 靶点发现 :预测新抗原、分析TCR与抗原的结合特异性,优化CAR和抗体设计;
2. 患者分层 :预测患者对免疫疗法的响应和耐药机制,提升治疗精准度;
3. 生产优化 :自动化细胞疗法制造中的质量控制、生物反应器监控和扩增方案,降低成本并提升 scalability。
这一块过阵子我也来学习总结一篇。
多组学与合成生物学
1. 多组学技术(如单细胞测序) :解析肿瘤与免疫系统的相互作用,为疗法设计提供分子机制依据;
2. 合成生物学 :构建具备逻辑门控电路、肿瘤特异性启动子的工程化细胞,提升疗法特异性和安全性,减少全身毒性。有点医工交叉的意思。
核心挑战与解决方向
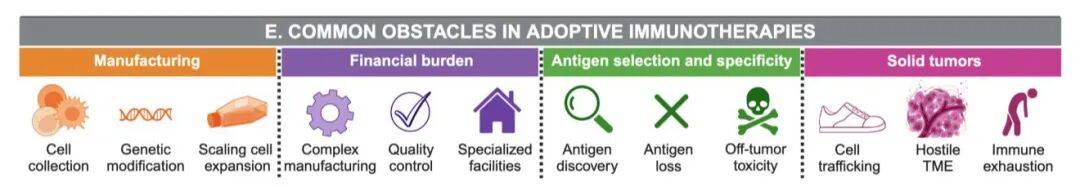
主要挑战
1. 治疗效果层面 :实体瘤的抗原逃逸、异质性、免疫抑制性TME;疗法相关毒性(如细胞因子释放综合征(CRS));CAR T细胞等疗法制造复杂、成本高、依赖自体细胞,难以规模化。
2 . 公平性与可及性层面 :少数族裔、经济弱势群体在临床试验中代表性不足,导致疗法适用性数据不全面;全球医疗资源分布不均,非洲、拉丁美洲等地区临床试验站点少,疗法可及性低。
文章对挑战的总结显然比文章开头老王我的要站在了更高格局。
解决方向
1. 技术突破 :开发“现成可用”的异基因细胞产品、体内基因编辑技术、诱导多能干细胞衍生免疫细胞;利用AI优化疗法设计和制造流程;探索IO与化疗、放疗的联合策略,攻克实体瘤难题。
2. 政策与实践优化 :制定政策激励临床试验纳入多样化患者群体;在全球多地区增设临床试验站点;改革医疗报销模式(如基于疗效的定价),降低疗法成本,推动全球范围内的可及性。
未来展望
未来,免疫疗法将向更精准、更安全、更普惠方向发展:
1. 疗法迭代:下一代ICIs、个性化新抗原疫苗、装甲CAR T细胞等技术将持续升级,扩大治疗适应证;
2. 技术融合:AI、单细胞测序、合成生物学将深度整合,加速疗法研发和个性化治疗落地;
3. 目标推进:研究者、临床医生、行业及政策制定者将协同努力,推动实现“未来10年获批100种新IO疗法”的目标,为全球癌症患者提供更优质的治疗选择。
来源: Journal for Immuno Therapy of Cancer











 苏公网安备32059002004080号
苏公网安备32059002004080号


