结直肠癌(Colorectal Cancer,CRC)中,BRAFV600E突变约占8–10%【1-2】,通常标志预后不良【3】。这类肿瘤多为MSS/pMMR型(约占80%),对单一免疫治疗(如抗PD-1)不敏感【4】。对这一类肿瘤,此前标准治疗为encorafenib + cetuximab(E+C),但BEACON III期试验结果提示疗效有限(其ORR仅为20%,mPFS为4.2个月,mOS为9.4个月)【5】。研究发现MSS BRAF突变型CRC相比野生型具有更高的免疫激活背景,提示其可能对免疫联合靶向治疗更敏感【6】。
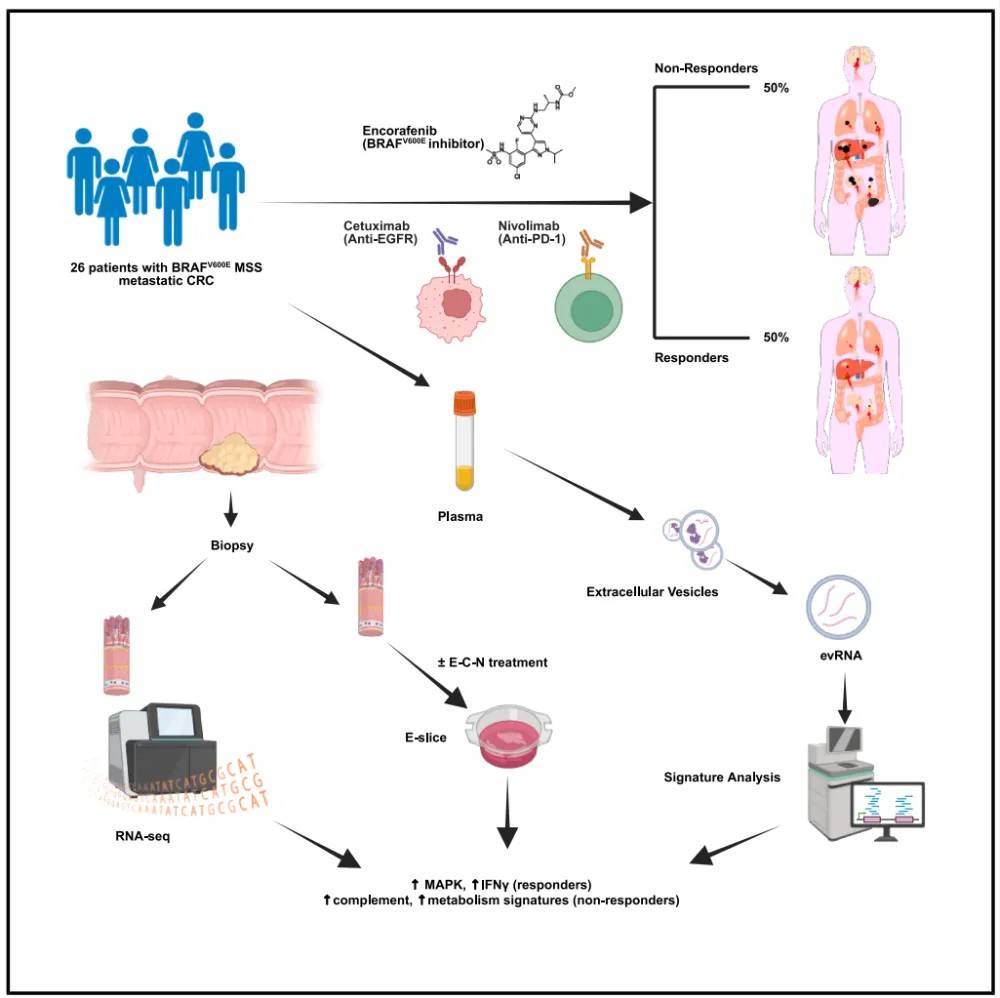
近日,来自来自德克萨斯大学安德森癌症中心的Van K. Morris团队在Cancer Cell上发表了题为Phase 1/2 trial of encorafenib, cetuximab, and nivolumab in microsatellite stable BRAFV600E metastatic colorectal cancer的文章。基于E+C可增强肿瘤对nivolumab的敏感性,进而提高疗效的假设,该研究旨在评估encorafenib(E)、cetuximab(C)和nivolumab(N)三联疗法在MSS BRAF V600E突变型mCRC患者中的疗效。

本研究纳入了26例经治的MSS BRAFV600E突变型转移性结直肠癌(mCRC) 患者。关键基线特征如下:1)中位年龄:59岁(范围32-85)。2)既往治疗线数:大多数患者(62%)仅接受过一线系统性化疗,这与BEACON试验中对照组人群特征相似。3)原发肿瘤部位:多数(58%)为右半结肠癌。4)转移部位:常见转移器官包括肝脏(58%)和腹膜(58%)。5)共突变:未发现伴随的MAPK通路激活突变(如KRAS, NRAS)。常见的CRC驱动基因突变包括:TP53(63%)、APC(33%)和PIK3CA(21%)。
安全性上,三联疗法显示可控,未观察到非预期毒性信号。在初始剂量探索阶段和整个研究中,未观察到任何剂量限制性毒性事件。6名患者(23%)报告了与治疗相关的3-4级不良事件。最常见的为无症状的血清脂肪酶升高(12%)和淀粉酶升高(8%),均归因于nivolumab。常见不良事件包括头痛(58%)、恶心(42%)、关节痛(39%)、贫血(31%)和痤疮样皮疹(31%)。有效性上,在24例可进行影像学评估的患者中,观察到了显著且持久的抗肿瘤活性。总体缓解率50%,疾病控制率96%,中位无进展生存期7.4个月,中位总生存期22个月。
接下来作者对疗效相关特征进行分析。临床病理方面,左半结肠癌患者对治疗的应答率显著更高,而肿瘤突变负荷或特定基因(如RNF43)的突变状态与治疗响应无显著关联。基因表达上,应答群体显示出更高的PD-1信号和EGFR信号通路富集,以及更高的p38 MAPK通路靶基因表达,而非应答群体显示出更高的经典RAF通路激活,以及更高的免疫抑制相关基因表达。提取患者治疗前的组织进行转录组测序,结果显示,应答群体显著富集免疫激活相关特征,包括NK细胞、B细胞、T细胞、中性粒细胞和巨噬细胞相关的炎症反应通路,而非应答群体显著富集代谢相关特征,包括脂肪酸、氨基酸和药物代谢通路。特别是补体和凝血 cascade通路在非应答者中高度富集。进一步的分析发现,应答群体的肿瘤微环境中具有更高比例的细胞毒性T细胞和活化T细胞。
那么,能否在体外建立模型,以预测疗效呢?作者分别使用离体E-slice模型对一名应答者和一名非应答者的新鲜肿瘤组织进行药效验证,发现对于应答者组织,在体外对E+C和E+C+N处理均表现出显著的细胞活力降低。添加nivolumab后,细胞活力下降更明显。而在非应答者组织中未观察到明显的细胞活力下降。以上结果验证了模型的可预测性。那么血浆是否也和组织一样,能够作为疗效预测的样本呢?作者分析了血浆细胞外囊泡RNA(evRNA),发现从evRNA中检测到的通路富集模式与组织活检结果高度一致。提示evRNA测序可以作为一种可靠的液体活检工具,无需反复进行组织活检即可预测疗效。进一步对治疗前后配对血浆样本的evRNA进行动态分析,作者发现能够监测到治疗后的免疫激活现象及基因通路的动态表达变化,且变化的程度与缓解持续时间相关,提示evRNA动态监测有望成为评估治疗反应和耐药性的实时、无创工具。
随后作者想知道以上基因特征是否具有普适性。他们在一个独立的临床试验数据集上进行了分析。该试验使用另一种三联方案(dabrafenib + trametinib + spartalizumab)治疗同类患者。结果与本研究发现一致:应答群体富集炎症反应特征,而非应答群体富集胆汁酸代谢和外源性代谢特征。提示其发现的生物标志物并非本研究特定方案独有,而可能适用于BRAF抑制剂+免疫治疗的联合策略。
总的来说,该研究针对MSS BRAFV600E突变型转移性结直肠癌这一预后极差的亚型,取得了突破性进展。不仅揭示了靶向-免疫联合治疗的协同作用机制,还发现了预测疗效和耐药的关键生物标志物。为过去治疗方案有限、预后极差的患者群体提供了一个高效且可能带来长期生存的新选择。
原文链接:https://doi.org/10.1016/j.ccell.2025.08.002
1. Davies, H., Bignell, G.R., Cox, C., Stephens, P., Edkins, S., Clegg, S.,Teague, J., Woffendin, H., Garnett, M.J., Bottomley, W., et al. (2002).Mutations of the BRAF gene in human cancer. Nature 417, 949–954.https://doi.org/10.1038/nature00766.2. Cancer Genome Atlas Network (2012). Comprehensive molecular characterization of human colon and rectal cancer. Nature 487, 330–337. https://doi.org/10.1038/nature11252.3. De Roock, W., Claes, B., Bernasconi, D., De Schutter, J., Biesmans, B.,Fountzilas, G., Kalogeras, K.T., Kotoula, V., Papamichael, D., LaurentPuig, P., et al. (2010). Effects of KRAS, BRAF, NRAS, and PIK3CAmutations on the efficacy of cetuximab plus chemotherapy in chemotherapy-refractory metastatic colorectal cancer: a retrospective consortium analysis. Lancet Oncol. 11, 753–762. https://doi.org/10.1016/S1470-2045(10)70130-3.4. Samowitz, W.S., Sweeney, C., Herrick, J., Albertsen, H., Levin, T.R.,Murtaugh, M.A., Wolff, R.K., and Slattery, M.L. (2005). Poor survivalassociated with the BRAF V600E mutation in microsatellite-stable coloncancers. Cancer Res. 65, 6063–6069. https://doi.org/10.1158/0008-5472.CAN-05-0404.5. Kopetz, S., Grothey, A., Yaeger, R., Van Cutsem, E., Desai, J., Yoshino, T.,Wasan, H., Ciardiello, F., Loupakis, F., Hong, Y.S., et al. (2019).Encorafenib, Binimetinib, and Cetuximab in BRAF V600E–MutatedColorectal Cancer. N. Engl. J. Med. 381, 1632–1643. https://doi.org/10.1056/NEJMoa1908075.6. Guinney, J., Dienstmann, R., Wang, X., de Reynie` s, A., Schlicker, A.,Soneson, C., Marisa, L., Roepman, P., Nyamundanda, G., Angelino, P.,et al. (2015). The consensus molecular subtypes of colorectal cancer.Nat. Med. 21, 1350–1356. https://doi.org/10.1038/nm.3967.
排版编辑:肿瘤资讯-AS











 苏公网安备32059002004080号
苏公网安备32059002004080号


