乳腺癌是我国女性最常见的恶性肿瘤之一。激素受体阳性(HR+)作为乳腺癌中最常见的分子亚型,约占所有乳腺癌的70%1,而在绝经前患者群体中这一比例达 80%2 。在绝经前HR+中高危乳腺癌患者的辅助治疗中,卵巢功能抑制(OFS)联合内分泌治疗已成为标准方案。其中,戈舍瑞林因其较强的循证基础与广泛的真实世界使用经验,已成为临床优选,但传统植入剂在稳定血药浓度、绝经状态维持率和注射体验等方面仍存在改善空间。而戈舍瑞林微球剂型具有更强的治疗效果、更高的稳定性及更低的失败率。基于这些显著优势,戈舍瑞林微球已获批为我国2.2类新药,为广大绝经前乳腺癌患者带来了新的选择。本期邀请到邯郸市中心医院张鲁医生分享一例绝经前HR+/HER2-局部晚期乳腺癌的诊疗经过,从新辅助化疗到辅助内分泌治疗,临床实践中如何为患者实现长期生存的同时,提高生活质量。本期内容也特别邀请到邯郸市中心医院张迎舟教授分享绝经前HR+/HER2-乳腺癌的诊疗经验和戈舍瑞林微球的临床价值。
河北省邯郸市中心医院乳腺外二科主任硕士研究生导师
中华医学会肿瘤学分会乳腺肿瘤学组青年委员
河北省预防医学会乳腺癌防治专业委员会 副主任委员
河北省健康服务业协会乳腺疾病专委会 副主任委员
北京乳腺病防治学会青年学术专业委员会第二届 常委
河北省预防医学会妇科及乳腺肿瘤多学科诊疗与预防专业委员会 常委
河北省肿瘤防治联合会肿瘤科普专委会 常委
河北省抗癌协会乳腺癌专业委员会青年委员
河北省肿瘤防治联合会乳房整形重建专委会委员
河北省邯郸市抗癌协会乳腺癌专业委员会副主任委员
河北省预防医学会乳腺癌防治专业委员会保乳治疗学组副组长
河北省邯郸市中心医院,乳腺外二科
医师
毕业于河北医科大学
病例分享
基本情况
患者,女性,46岁,未绝经,ECOG评分:0分。
主因发现左乳肿块2个月于2022-07-29首次入院。
查体:双乳对称,未见皮肤红肿及浅表静脉曲张,未见橘皮样变,左乳内侧象限可见酒窝征,左侧乳腺上方12点方向距乳头约3.0cm处可及一大小约8.0*6.0cm肿块,质硬,界限不清,活动度差,与皮肤及胸肌无粘连,左侧腋窝可及一大小约2.0*1.5cm肿大淋巴结,质韧,活动,右侧乳腺未触及明显肿物,右腋下及双侧锁骨上窝未及明显肿大淋巴结。
辅助检查
乳腺+腋窝超声:左侧乳腺11-2点钟方向,可见范围约6.6*3.8*2.7cm回声杂乱,局部呈低回声结节改变,范围约4.4*2.0cm,CDFI:可见血流信号。右侧腋下未见明显肿大淋巴结回声。左侧腋下可见多个低回声结节,较大的为1.6*1.1cm,皮质增厚,边界清,形态规则,CDFI:内可见血流信号。超声诊断:左侧乳腺异常所见,考虑:BI-RADS 4c类;左侧腋下多发低回声结节,考虑:肿大淋巴结。
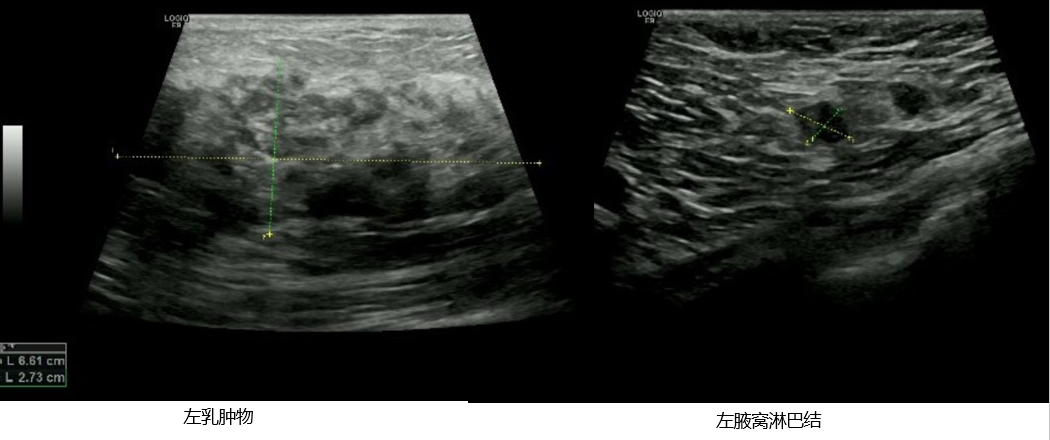
双锁骨上、下淋巴结超声:未探及明显肿大淋巴结。
乳腺钼靶:左乳密度增高,外上见不对称致密影,左乳头内后方见多形钙化,左腋下见肿大淋巴结影。诊断:左乳密度增高,外上见不对称致密,钙化 考虑 BI-RADS 4B类。

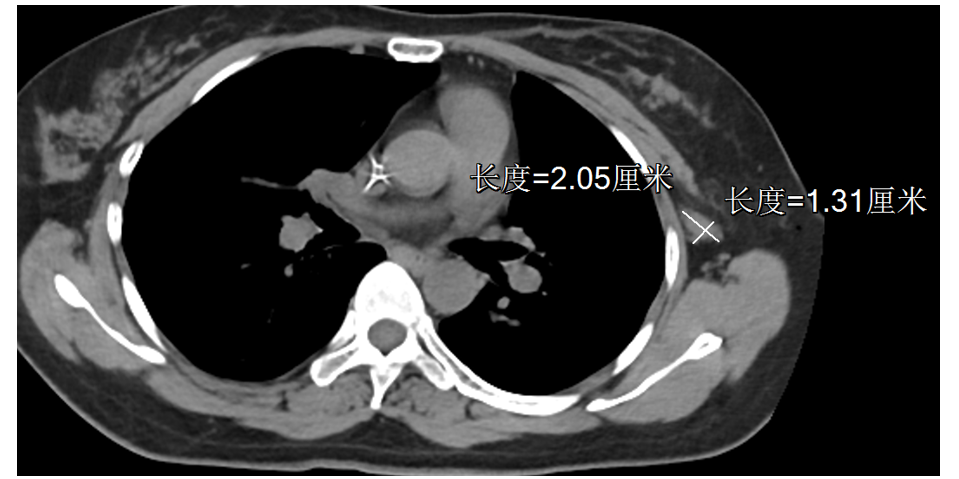
胸部CT:左乳团块,左侧腋窝肿大淋巴结。余(-)。
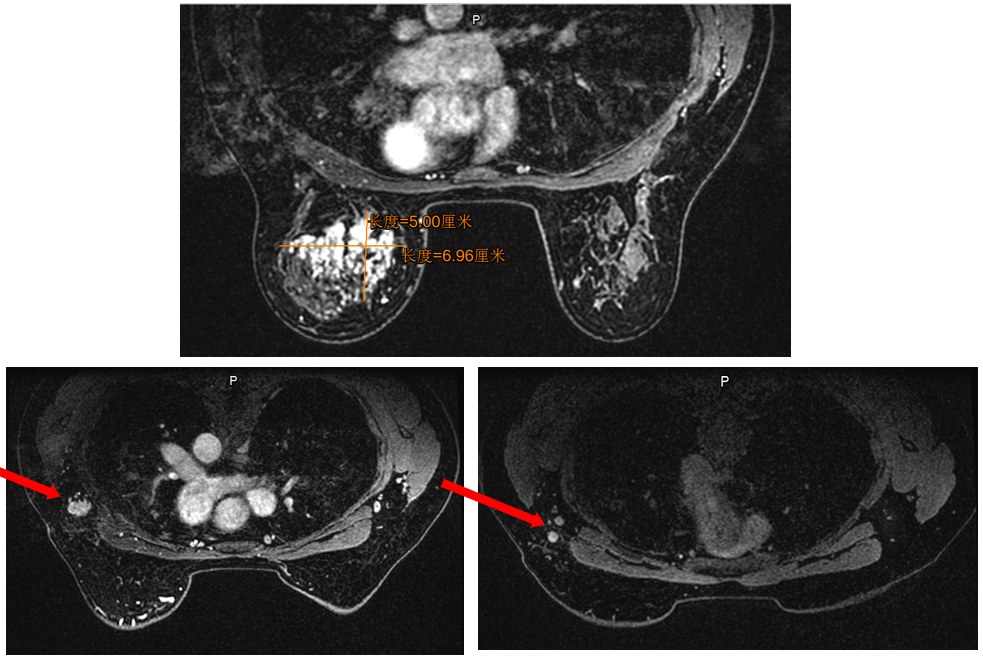
乳腺增强核磁:左乳外上-内上-中上象限见斑片状强化影,边界欠清,范围约6.9*6.1*5.0cm,多点测量时间-信号强度曲线呈流出型;平扫呈等T1、混杂T2稍高信号影,DWI呈稍高信号;左侧腋窝可见肿大淋巴结,较大约1.9*1.5cm。影像诊断:左乳占位 BI-RADS 5类;左腋下肿大淋巴结,考虑转移。
全身骨显像:未见明显异常骨盐代谢活性灶
余检验检查未见转移征象
乳房肿物穿刺病理(2022-07-21):左乳浸润性癌,淋巴管内见癌栓。免疫组化结果:HER-2(1+),Ki-67(+约30%),EMA(+),CD34(-),D2-40(淋巴管内见癌栓)。
腋窝淋巴结穿刺病理:乳腺浸润性癌。免疫组化结果:P53(+约70%),Ki-67(+约40%),ER(+约70%),PR(+约60%),HER-2(1+),EGFR(+),E-cadherin(+),AR(+约40%),GATA-3(部分弱+),CK7(+),CK5/6(-)。
临床诊断:左乳癌III A期,cT3N1M0(Luminal B型) 。
治疗经过
新辅助治疗
由于患者为HR+/HER2-局部晚期乳腺癌,新辅助治疗选择ddAC-T方案。新辅助化疗后,术前超声评估,患者乳房肿块缩小至2.8*2.1cm,腋窝淋巴结缩小至1.6*1.1cm。钼靶影像提示,肿块密度明显降低,可见广泛弥散钙化。乳腺MRI提示,左乳内上象限见斑片状强化影,边界欠清,强化范围较前缩小,强化程度较轻减轻。左侧腋窝未见肿大淋巴结。
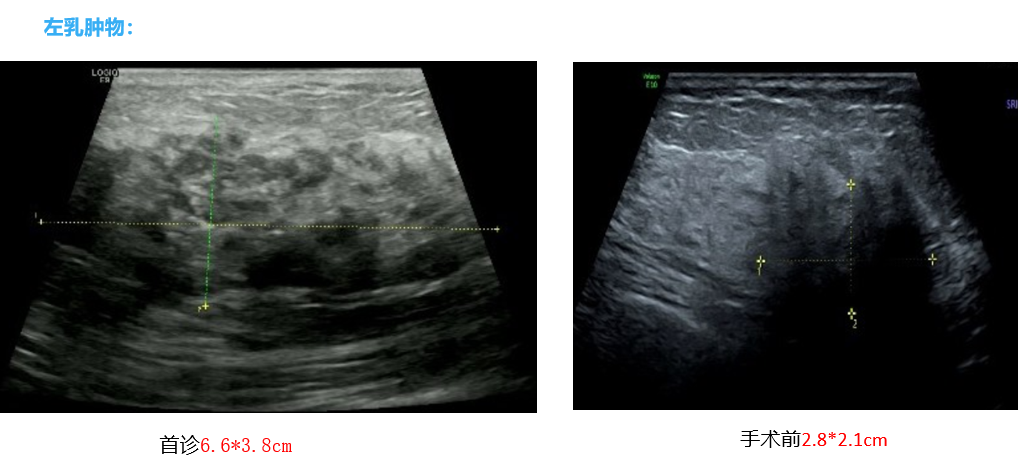
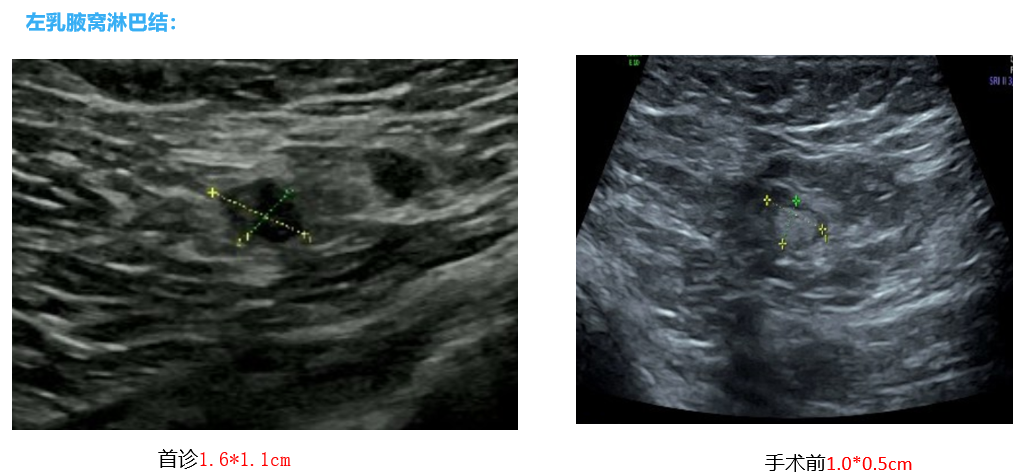
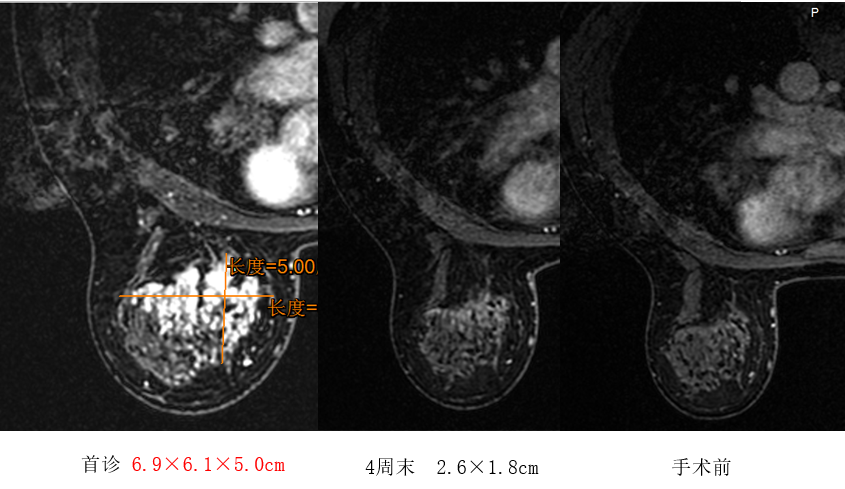
基于影像学检查结果,患者新辅助疗效评估为部分缓解(PR)。
手术
患者于2023-02-09行左乳癌改良根治术,术后病理提示,乳腺肿瘤组织标本内见少量散在小簇状癌细胞,呈微乳头状癌形态。淋巴结:腋窝0/16未见转移癌。新辅助化疗后病理学评估:MP分级为G4。免疫组化结果:P53(+约40%),Ki-67(+约20%),ER(+约80%),PR(+约10%),HER-2(1+),VEGF(-),E-cadherin(+),P120(膜+),AR(+约5%),CK5/6(-),EMA(+)。
诊断:左乳癌ⅠA期,ypT1miN0M0 (Luminal B型)。
辅助治疗
患者于2023-03开始辅助放疗:放疗剂量为50GY/25F。同时,规律行内分泌治疗: OFS+AI(戈舍瑞林植入剂 3.60mg+来曲唑 2.5mg)。期间患者规律每3月返院复查随访,未见疾病进展。该患者于2025-04 更换戈舍瑞林植入剂为戈舍瑞林微球并应用至今。
病例小结
这是一例46岁绝经前HR+/HER2-乳腺癌患者,初诊时为III A期(cT3N1M0)。考虑到患者肿瘤体积较大,且伴有腋窝淋巴结转移,根据CBCS及CSCO指南,符合新辅助治疗指证,推荐进行ddAC-T方案的新辅助化疗。新辅助化疗后肿瘤和腋窝淋巴结均退缩明显,但未达到病理完全缓解(non-pCR),后续辅助治疗方案给予放疗和内分泌治疗(OFS+AI)。目前,整体生存状态良好,未出现复发。
专家点评
目前,新辅助、辅助治疗在HR+/HER2-早期乳腺癌中的应用已显示出较好前景,并且临床上针对一些具有高危临床病理特征的患者,往往给予CDK4/6抑制剂等药物辅助强化或延长辅助内分泌治疗时长的策略来做加法强化治疗,以更进一步提升患者生存获益。根据指南推荐3,本例患者选择了ddAC-T的新辅助化疗方案。新辅助化疗后,患者肿瘤体积和腋窝淋巴结均有明显的退缩,术前患者腋窝淋巴结存在转移,且无保乳及乳房再造意愿,因此行左乳癌改良根治术,术后诊断为左乳癌ⅠA期 ypT1miN0M0 (Luminal B型)。
HR+/HER2-早期乳腺癌术后辅助治疗主要依赖内分泌治疗,如TAM、AI和OFS。既往ADAPT和ADAPTcycle研究的更新数据4表明:对于年龄≤50岁(绝经前)人群,在TAM或AI中添加OFS显著提高绝经前患者的ET应答率,与Al治疗的绝经后患者相当。针对年龄≤50岁人群,AI+OFS效果较TAM+OFS可获得更高缓解率。因此,考虑到OFS辅助强化内分泌治疗可为绝经前HR+/HER2-早期乳腺癌患者带来更大生存获益,本例患者选择AI+OFS作为辅助治疗方案。此外,对于本例绝经前的中高危人群,随着近年来monarchE研究和NATALEE研究的数据公布,CDK4/6抑制剂+AI+OFS的强化辅助治疗方案也为这部分患者提供了更多的治疗机会。
值得注意的是,对于类似本案例中处于围绝经期的患者,国内外权威指南并不推荐轻率地停止OFS治疗,或等待患者卵巢功能明确后再启动OFS治疗,以防止延误了OFS应用时机,导致疾病的进展5。在OFS药物的选择方面,相对于戈舍瑞林植入剂,戈舍瑞林微球通过三大技术突破实现了“0”级释放。突破一:戈舍瑞林微球采用了星型结构的聚合物材料PLGA,相对于传统的线性结构,星型结构在药物递送方面具有许多线性聚合物不存在优异的性能,显著提升了药物载体的稳定性和均一性,为药物的有效传递打下坚实基础6;突破二:戈舍瑞林微球采用第二代微球技术(水包油包固S/O/W)乳化挥发工艺进行剂型创新,确保药物能够恒定、均匀且缓慢地释放,接近零级释放标准7;突破三:戈舍瑞林微球水包油包固(S/O/W)专利技术拥有完善的生产体系,保证了缓释制剂质量的均一性,批间差异小,符合FDA/NMPA标准7。此外,临床前研究显示,戈舍瑞林微球具有在体内释放更平稳、28天内持续释放的特点,从而有助于维持持续、稳定的卵巢功能抑制8。而且相较于亮丙瑞林微球、曲普瑞林微球,戈舍瑞林微球外观饱满,突释效应少,血药浓度更平稳9-11。在Ⅲ期、随机对照、开放、非劣效设计的303研究9中,戈舍瑞林微球组和戈舍瑞林植入剂组患者第29天至第85天维持雌二醇(E2)在绝经后水平(≤30pg/ml)的比例分别为93.1%和86.3%,两组累计概率的差值为6.8%(95% CI:-2.3%~15.9%),达到了非劣效标准,且戈舍瑞林微球组患者E2突破绝经后水平的比例更低。同时,由于戈舍瑞林微球可实现细针肌肉注射,相较于植入剂的皮下注射,大大减轻了注射疼痛和焦虑感,并提供了更多注射部位选择,从而改善患者注射体验提升患者依从性。戈舍瑞林微球制剂目前已经获批并纳入医保,本例患者为追求更平稳的血药浓度、稳定维持绝经状态,以及良好的注射体验,更换为戈舍瑞林微球。
总而言之,本例绝经前、HR+/HER2-局部晚期乳腺癌患者经新辅助治疗、手术治疗、辅助放疗和内分泌治疗后,疾病实现了稳定的控制。同时,随着创新药物的不断发展,这一类患者也迎来了更多有效的药物选择,包括CDK4/6抑制剂的强化辅助治疗、更创新的戈舍瑞林微球。未来,随着慢病化管理理念的不断深入人心和创新药物的不断发展,这类乳腺癌患者也将实现高质量的长期生存甚至治愈。
[1]. Tang J, Cui Q, Zhang D, Liao X, Zhu J, Wu G. An estrogen receptor (ER)-related signature in predicting prognosis of ER-positive breast cancer following endocrine treatment. J Cell Mol Med 2019; 23(8): 4980-90.4.
[2]. Bui KT, Willson ML, Goel S, Beith J, Goodwin A. Ovarian suppression for adjuvant treatment of hormone receptor-positive early breast cancer. Cochrane Database Syst Rev 2020; 3(3): Cd013538.
[3]. 中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)乳腺癌诊疗指南2025[M].北京:人民卫生出版社, 2025.
[4]. Oleg Gluz, et al. Analysis of ADAPT and ADAPTcycle trials – Endocrine therapy response in breast cancer. 2022 ESMO. LBA14.
[5]. 中国早期乳腺癌卵巢功能抑制临床应用专家共识(2024年版)
[6]. 王锐,等.高分子材料载体在天然抗肿瘤药物中的研究进展 [J]. 中草药, 2021, 52(10): 3133-3141.
[7]. 戈舍瑞林缓释微球发明专利. https://www.pharmcube.com/index/news/article/6847
[8]. Yutong M, Liang Y, Chunjie S, et al. Pharmacological and toxicological studies of a novel goserelin acetate extended-release microspheres in rats. Front Pharmacol 2023; 14: 1125255.
[9]. 邵喜英,张清媛,牛钊峰,等. LY01005和诺雷得 ®治疗绝经前乳腺癌的多中心随机对照Ⅲ期临床研究 [J]. 中华肿瘤杂志,2025,47(4):340-348.
[10]. 注射用醋酸亮丙瑞林微球说明书(2021年12月20日)
[11]. 张成乾,寸冬梅,陶安进,唐星,杨明世.不同封端的PLGA/PLA-醋酸曲普瑞林微球的制备及体内外评价[J].沈阳药科大学学报,2021,38(1):1-7
排版编辑:肿瘤资讯-IRIS











 苏公网安备32059002004080号
苏公网安备32059002004080号


