福建省抗癌协会癌痛专业委员会和福建省抗癌协会中西医整合肿瘤专委会青年委员会主办的【十邑论坛】开播啦!论坛于每周二推出,带您用中文听原汁原味的2025年美国临床肿瘤学会(ASCO)研究。本期论坛将聚焦Gianni Bonadona 乳腺癌奖获得者——耶鲁大学癌症中心的 Ian Krop 博士所带来的主题为“在乳腺癌靶向治疗时代重新定义化疗的角色”的演讲,【肿瘤资讯】特邀三明市第二医院杨兰芳教授围绕该精彩报告进行深度解读,为临床实践提供宝贵洞见。
三明市第二医院 肿瘤科 主治医师

在肿瘤药物研发领域,发展趋势已从传统的细胞毒性化疗逐渐转向精准靶向治疗。事实上,在过去25年中,获得监管机构批准的肿瘤新药中,细胞毒性化疗药物所占比例已不足5%。以乳腺癌为例,上一个获批的化疗药物至今已逾15年,这充分证明了该领域的治疗模式转变。
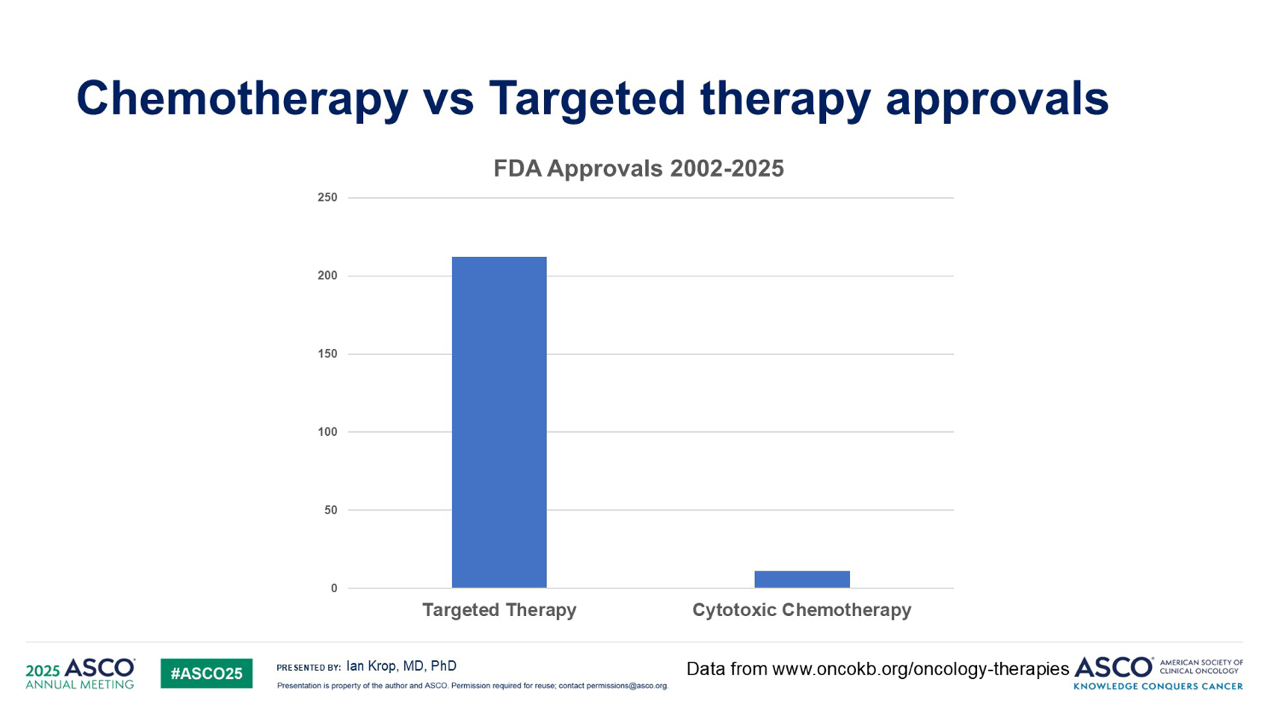
然而,在我们这个靶向治疗的新时代,我们仍然需要细胞毒性药物。这是因为我们许多靶向疗法作为乳腺癌的单药治疗,其疗效相当有限。像免疫检查点抑制剂、抗HER2治疗药物和激酶抑制剂,它们确实需要化疗,化疗能够引发细胞凋亡和免疫原性细胞死亡。因此,我认为目前这个阶段我们仍然离不开细胞毒药物。但问题是,我们能否在获得这些细胞毒性药物益处的同时,最大限度地减少其毒性?

幸运的是,乳腺癌领域一直是靶向递送化疗药物的先驱,具体表现为抗体药物偶联物(ADC)的研发。ADC 由针对细胞表面肿瘤选择性抗原的抗体连接细胞毒性有效载荷构成。其理念是抗体能够选择性地将靶向的有效载荷递送到癌细胞中,从而避免对正常组织的毒性。

设计和研发 抗体药物偶联物(ADC) 的理念已存在数十年,但早期的大多数药物都以失败告终,主要原因在于毒性过高或偶联物稳定性差。因此,当时人们对 T-DM1 寄予了厚望,因为它采用了当时新颖的 不可裂解连接子,该设计被认为非常稳定,并且其有效载荷是高效的 微管蛋白抑制剂,有望彻底改变这一领域。

因此,当研究人员开始参与 T-DM1 的首次人体I期试验时,我们满怀希望,期待它能带来积极的改变。实验结果也证实了这一点。即使是在这项研究中入组的、经过多线治疗的 HER2阳性转移性乳腺癌 患者,T-DM1 也展现出显著的疗效,缓解率超过40%,且大多数患者的缓解持续时间较长。
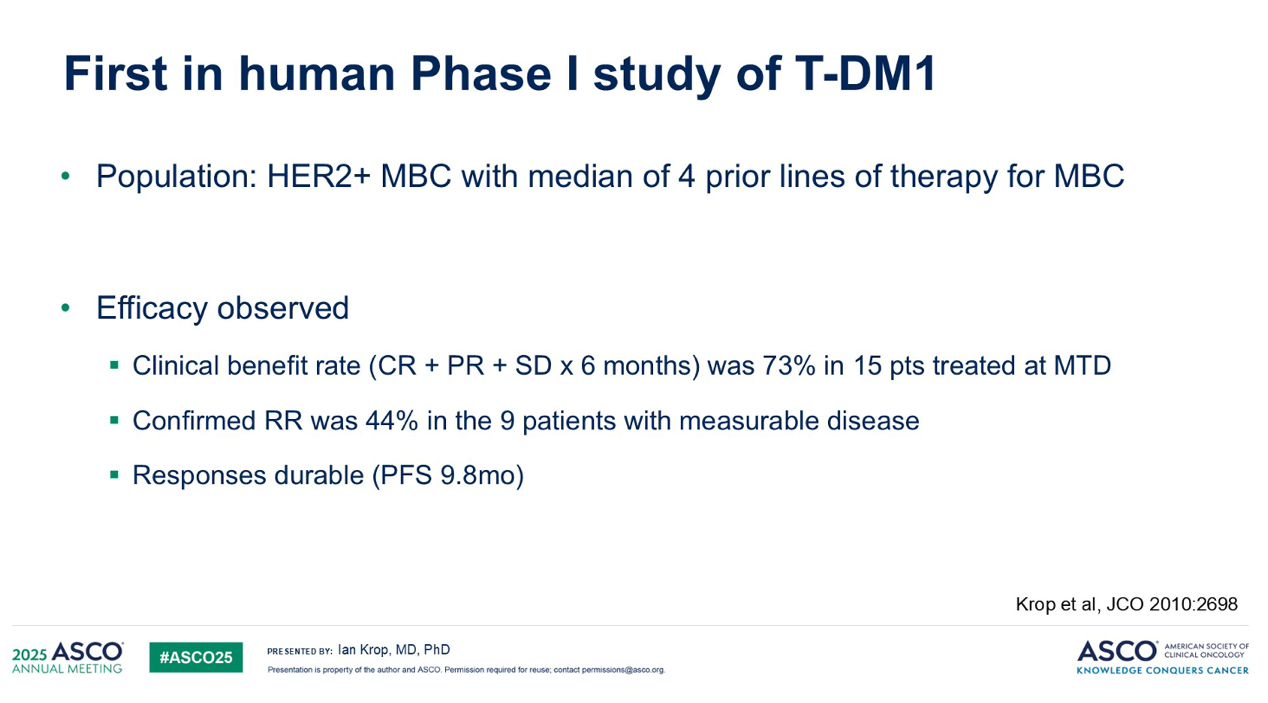
更令人欣慰的是,T-DM1 的毒性特征表现优异。我们并未观察到化疗药物常见的副作用,例如恶心、腹泻、中性粒细胞减少、神经病变,甚至脱发。尽管出现了一些实验室指标异常,例如血小板减少症,但这些大多是无症状的。因此,从患者体验的角度来看,T-DM1 似乎真正实现了 抗体药物偶联物(ADC) 的理想目标:既能高效杀伤肿瘤,又能将毒副作用降至最低。

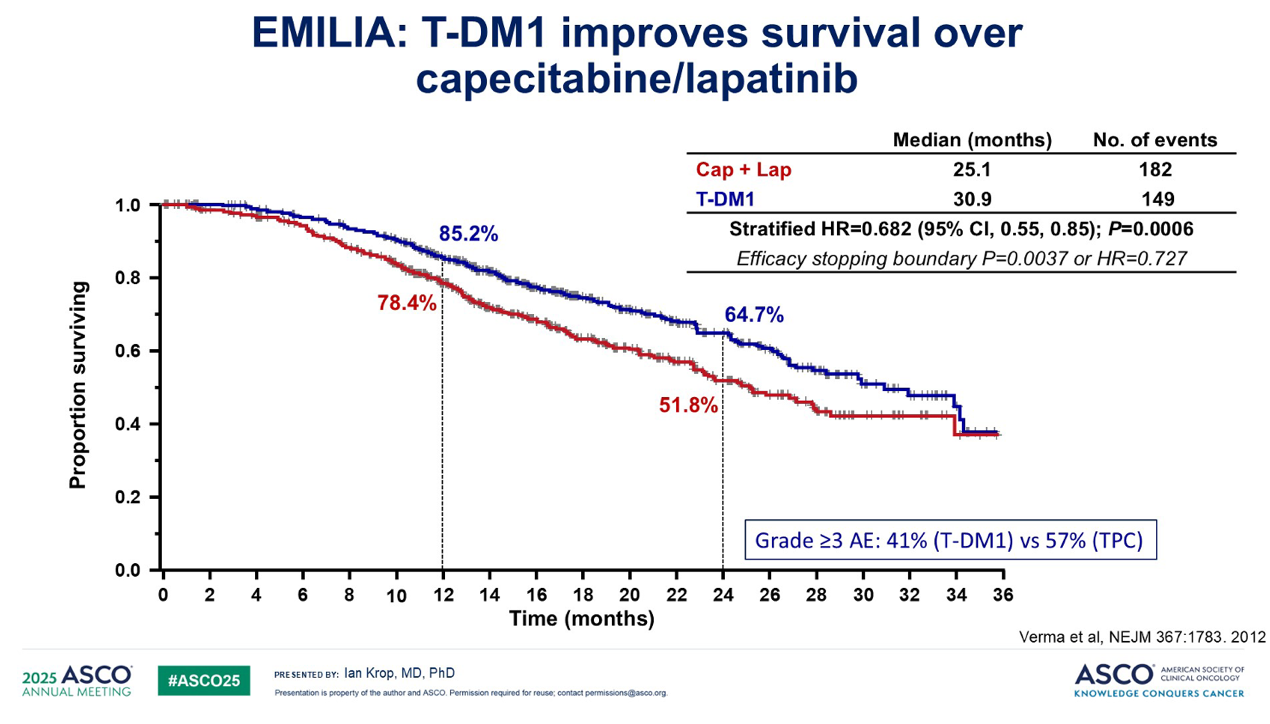
这些特性随后在两项大型III期试验中得到了证实:一个是在经过重度预处理的患者中进行的 TH3RESA 试验,另一个主要是在二线患者中进行的 EMILIA 试验。在这两项试验中,与当时的标准治疗相比,T-DM1 在无进展生存期(PFS)和总生存期(OS)方面都远胜一筹。并且在这两项试验中,T-DM1 的毒性都低于对照组。
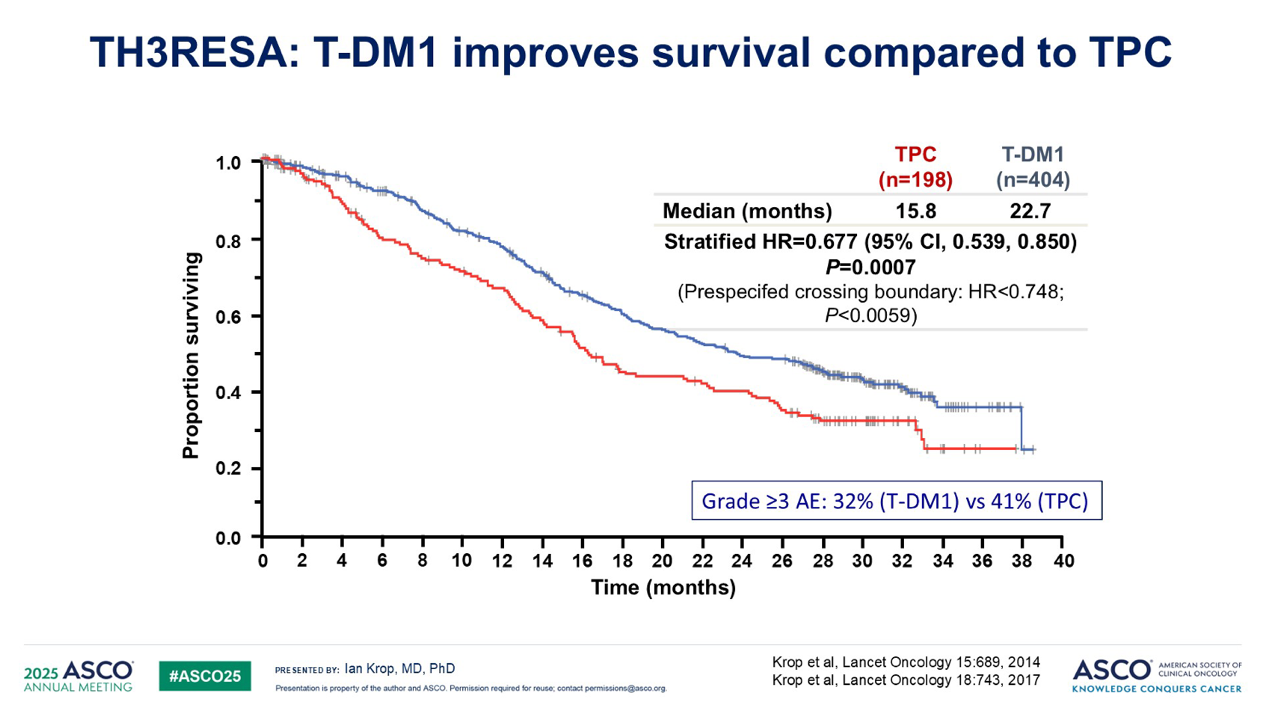
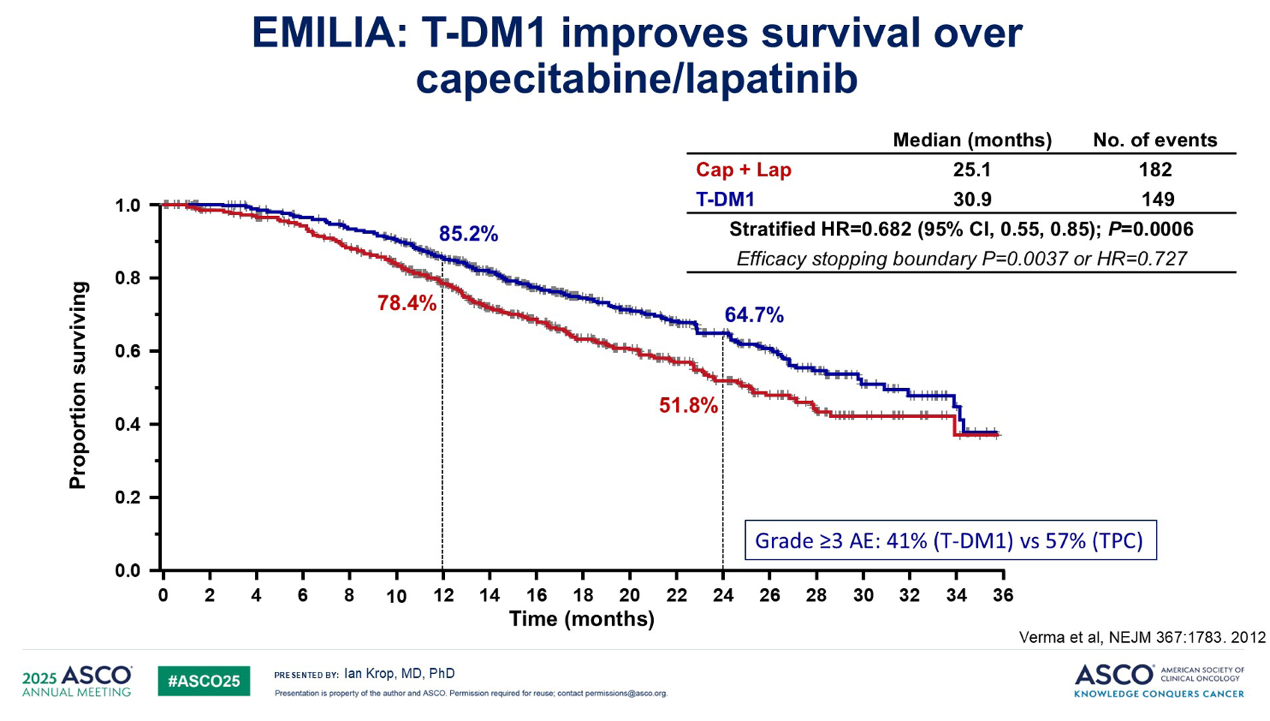
基于 EMILIA 研究的数据,T-DM1 获批用于二线治疗,这是第一个获批用于实体瘤的ADC。
这带来了许多下游影响:它验证了 HER2 作为 ADC 靶点的价值;最重要的是,它的成功可能推动了 ADC 在多种肿瘤类型中的广泛开发。去年有超过 370 种 ADC 进入临床开发。此外,它还激励了连接子和有效载荷技术的进步,旨在提高这些药物的疗效。

德曲妥珠单抗(T-DXd)是一大典范,它与 T-DM1 有几个不同之处,包括使用拓扑异构酶抑制剂作为有效载荷,以及采用可裂解连接子,这使得它具有 旁观者效应(Bystander effect)。一旦偶联物与肿瘤细胞结合并被内化,有效载荷释放后能够扩散出细胞并杀死邻近的细胞,即使这些细胞本身没有 HER2 靶点。这些特征在临床上得到了印证。

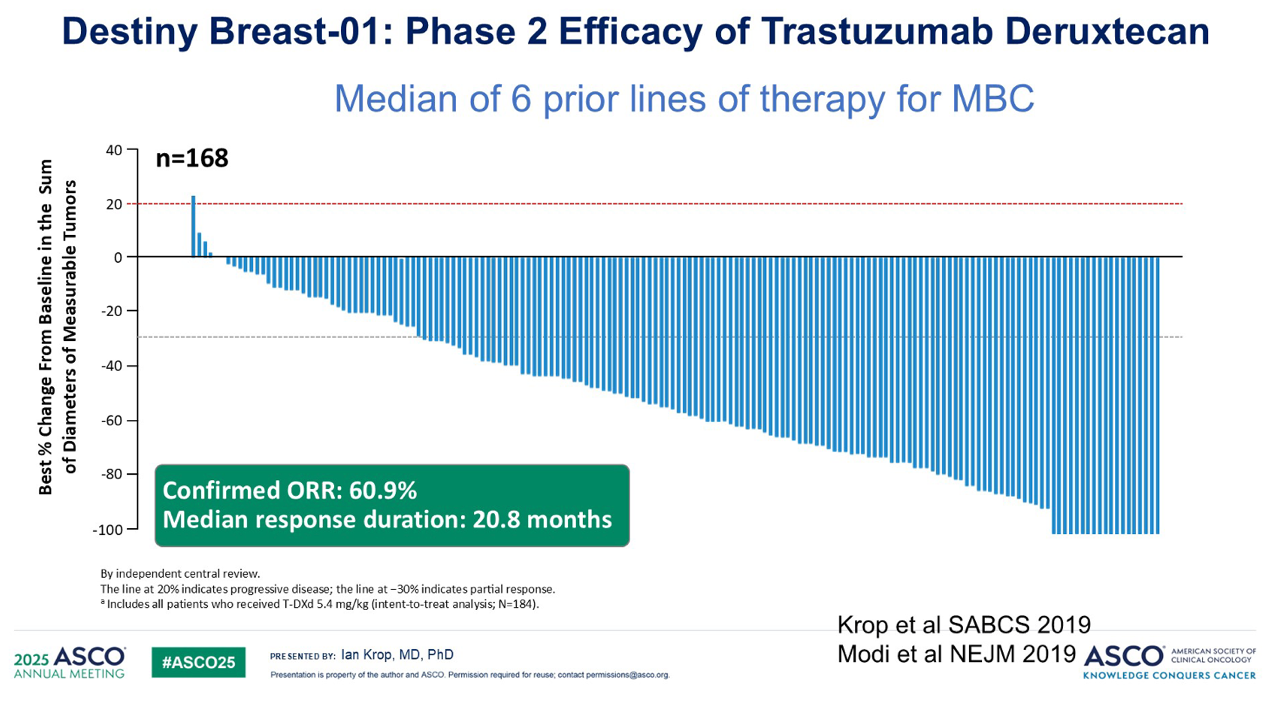
DESTINY-Breast01 试验展现了令人惊叹的瀑布图,提示几乎整个患者群体都广泛获益,尽管这些都是经过多线治疗的患者。这无疑加速了 T-DXd 的获批。
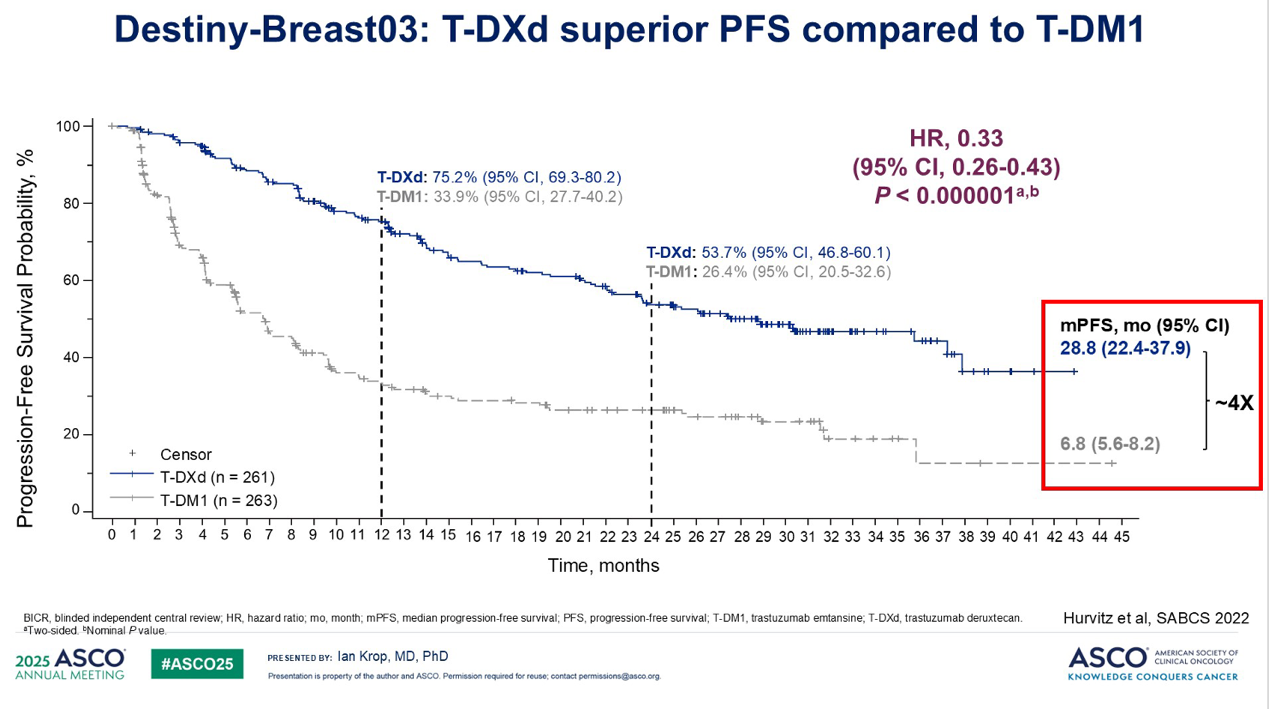
随后,确证性试验 DESTINY-Breast03 表明,T-DXd 的疗效远优于 T-DM1,无进展生存期(PFS)增加了4倍,这真正夯实了抗体药物偶联物(ADC)的疗效获益证据。
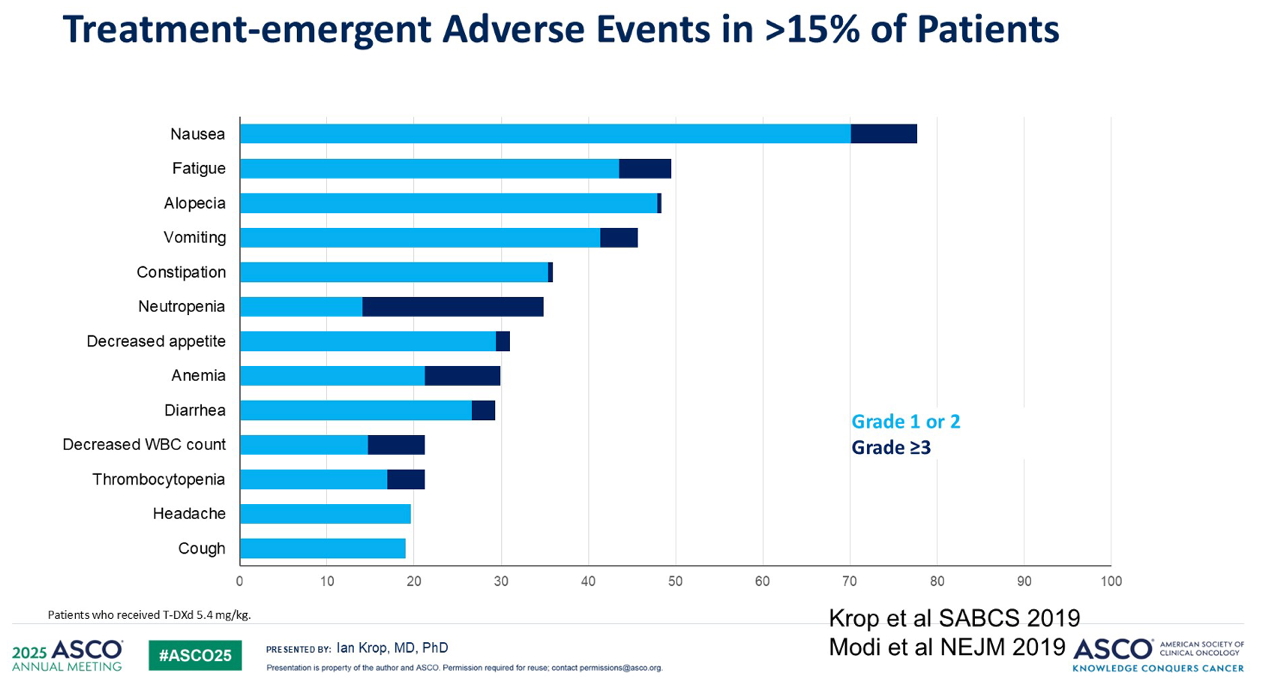
然而,这种疗效的提升也伴随着代价:T-DXd 的毒性相对更大。它可能导致胃肠道毒性、脱发,并且大约有 15% 的患者出现 间质性肺病(ILD),ILD是一种相对严重的不良反应,需要临床进行密切监测。
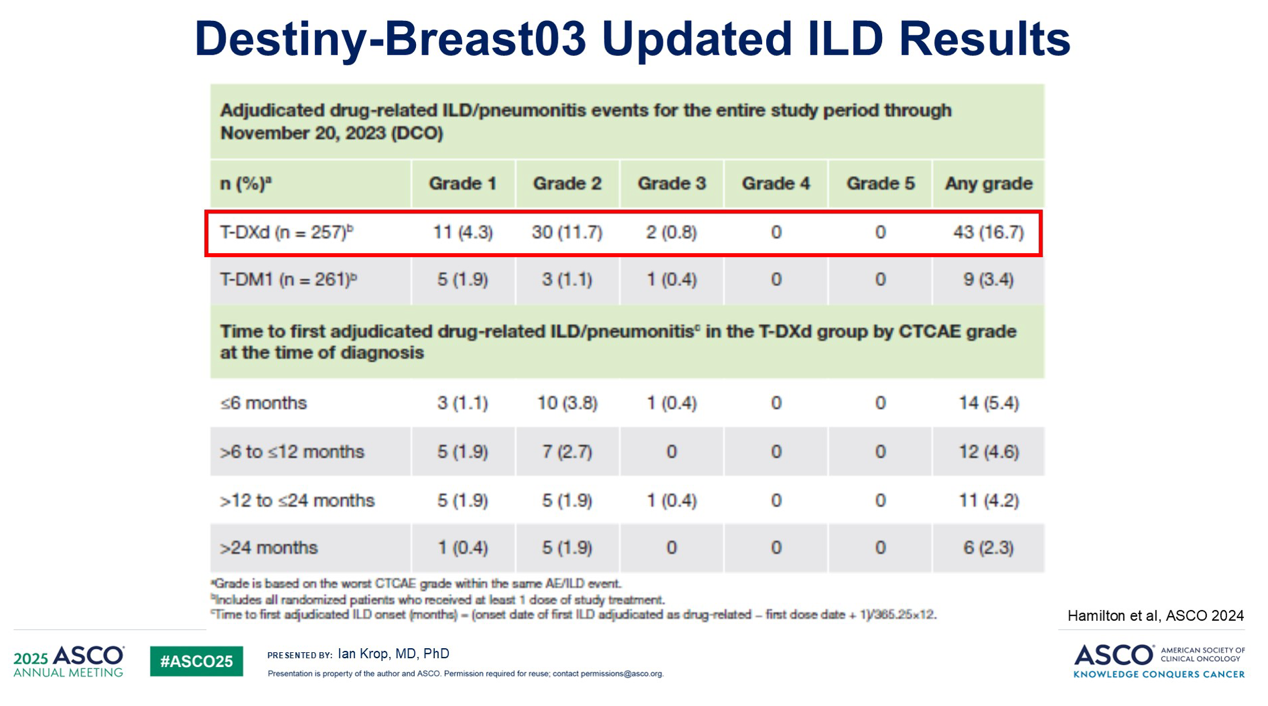
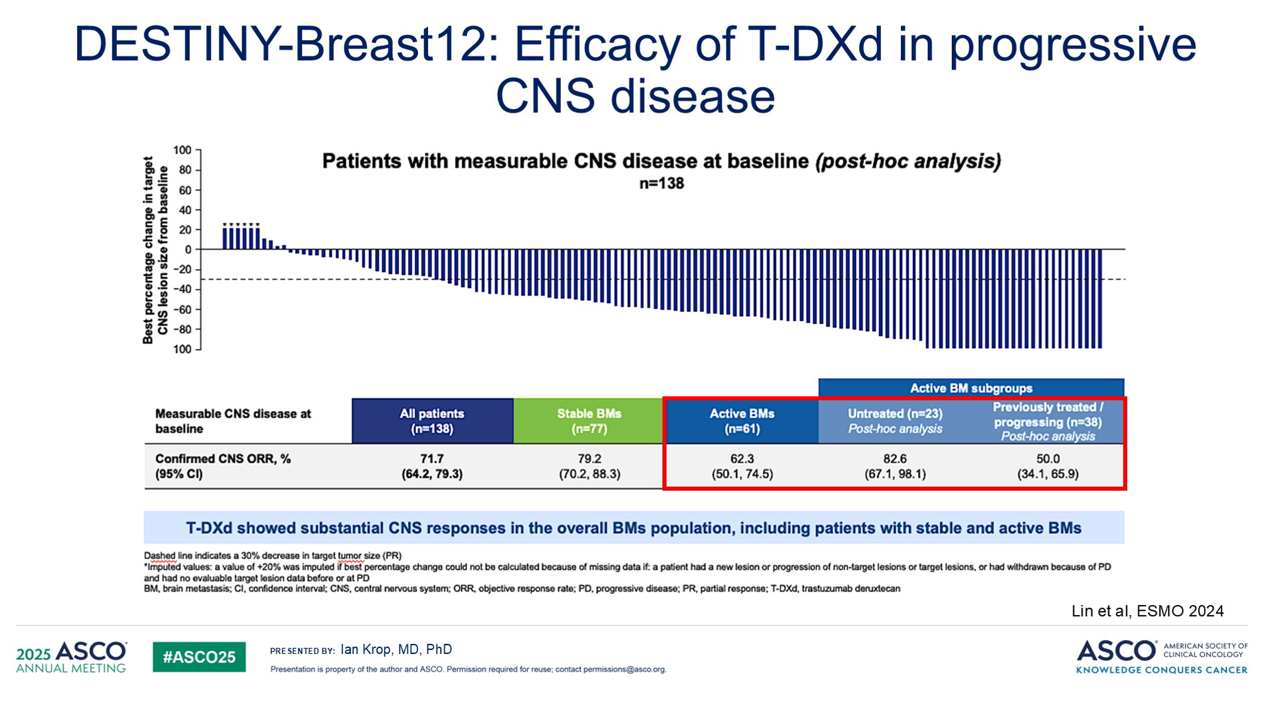
然而,我们随后开始看到,T-DXd 真正突破了我们对 ADC 能力的认知界限。在 DESTINY-Breast12 试验中,我们观察到 T-DXd 具有显著的颅内疗效。在活动性脑转移患者中——这是一个既往难以治疗且在 HER2 阳性疾病中并不少见的人群——脑部缓解率超过 60%。
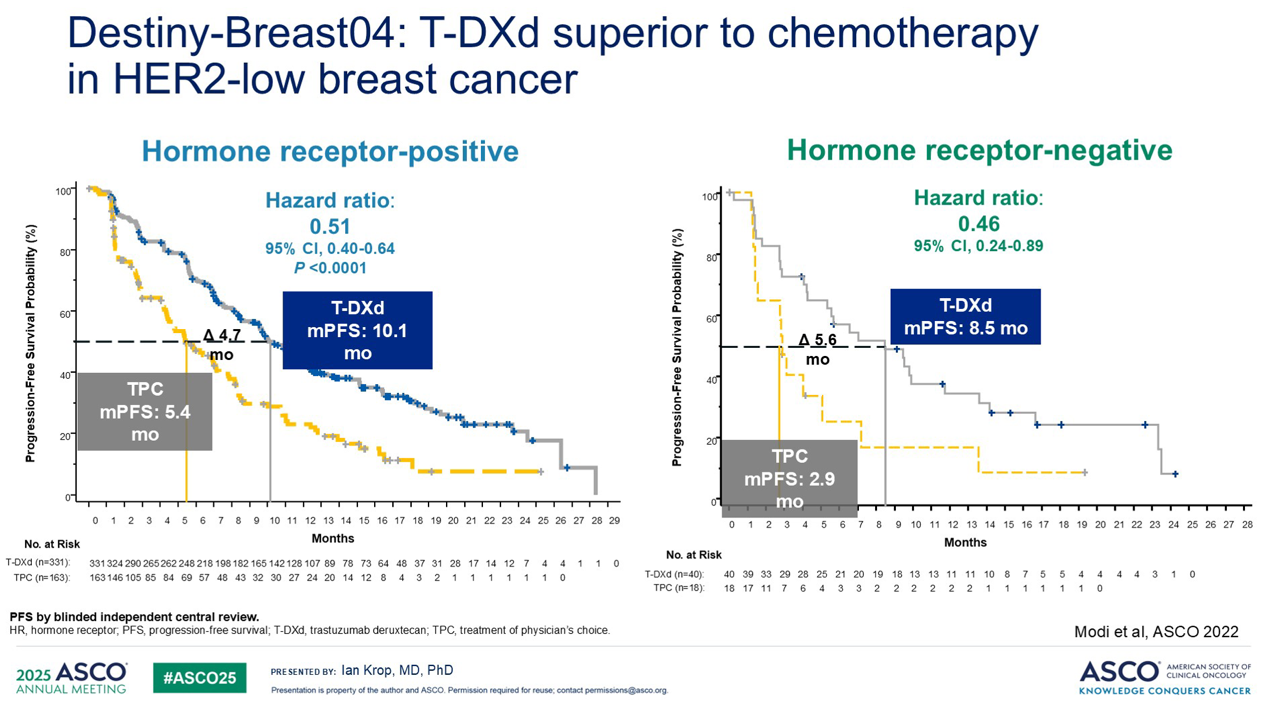
更令人惊讶的是, DESTINY-Breast04 试验表明,T-DXd 与几乎所有先前的 HER2 疗法不同,即使在 HER2 表达水平较低的癌症中也具有显著疗效。
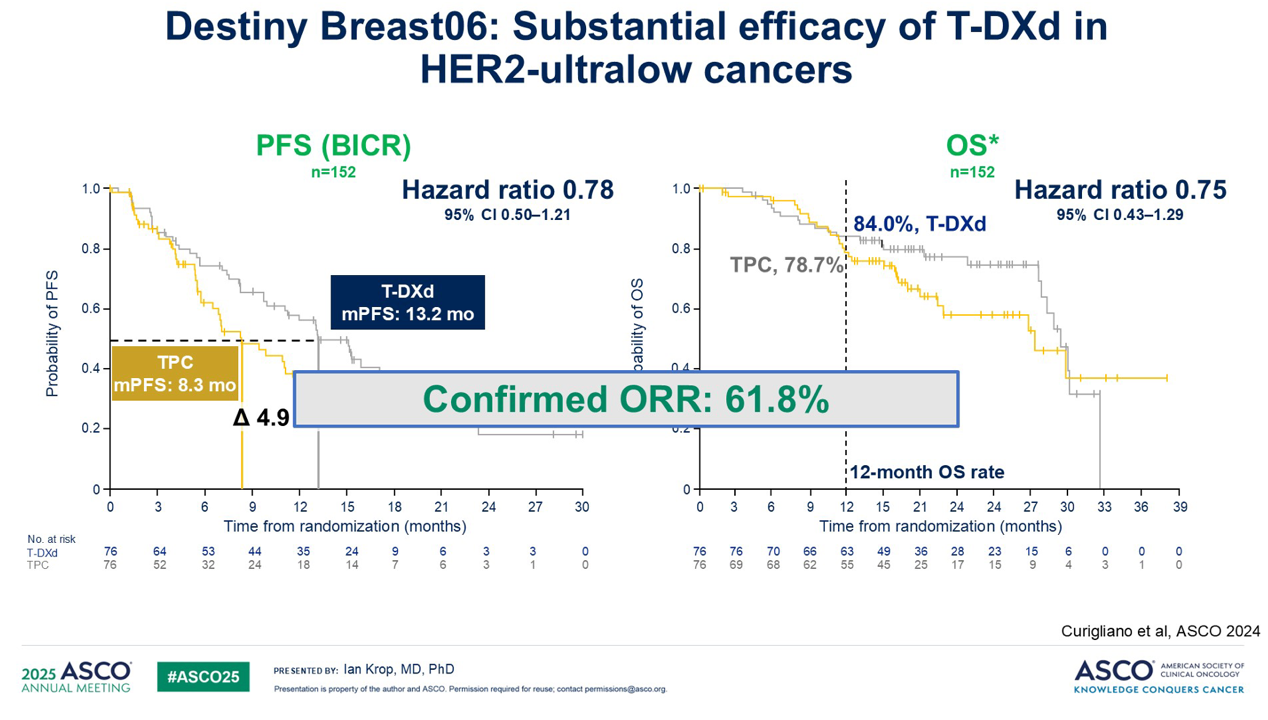
在此基础上,去年 ASCO 会议上公布的 DESTINY-Breast06研究则更进一步证明, T-DXd 在 HER2“超低表达”的肿瘤中仍然有活性,缓解率超过 60%。
因此,事实已然明晰:无论是在HER2阳性,还是HER2低表达、超低表达的乳腺癌亚型中,抗体药物偶联物(ADC) 均展现出卓越的疗效。此外,也有数据显示,ADC在乳腺癌中还可以针对其他靶点发挥作用。目前,针对 Trop-2 的ADC药物有戈沙妥珠单抗和 Dato-DXd;针对 HER3 的 德帕曲妥尤单抗也正在研发中。显而易见,ADC已经成为我们乳腺癌治疗中不可或缺的组成部分。展望2025年美国临床肿瘤学会(ASCO)年会的今后,ADC有望成为所有乳腺癌亚型一线治疗的标准疗法。

刚才,我向各位展示了行业赞助试验所取得的进展。而与之相比,研究者发起试验(IIT)则具有独特优势:能回答更多行业赞助试验中不能或不会被问到的问题。IIT 研究还能收集优秀的生物标本,用于解决其他相关问题,并推动未来的科学发展。因此,我想谈谈部分值得关注的IIT 研究。

第一个试验提出了一个我认为很直接的问题:在低风险 HER2 阳性乳腺癌中,T-DM1 能否代替紫杉醇类加曲妥珠单抗(TH)方案?这是ATEMPT 试验,由现任丹娜- 法伯癌症研究所乳腺肿瘤学部主任Sara M. Tolaney医生牵头。
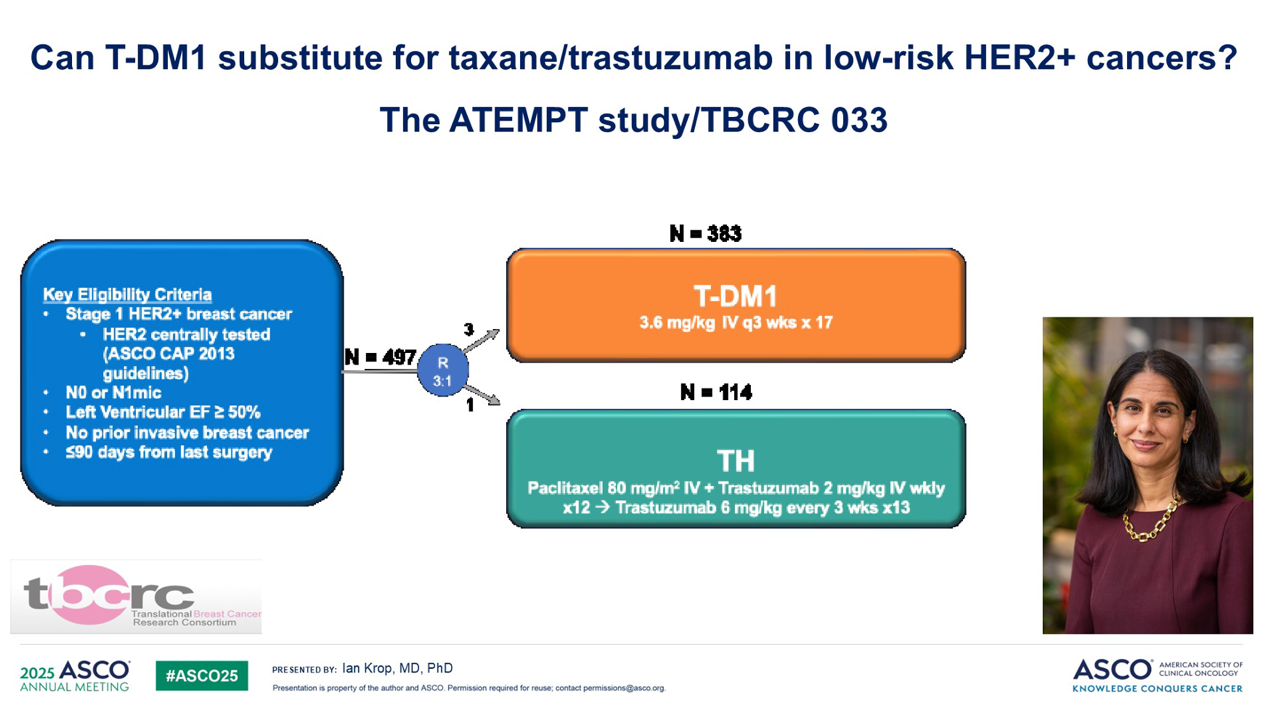
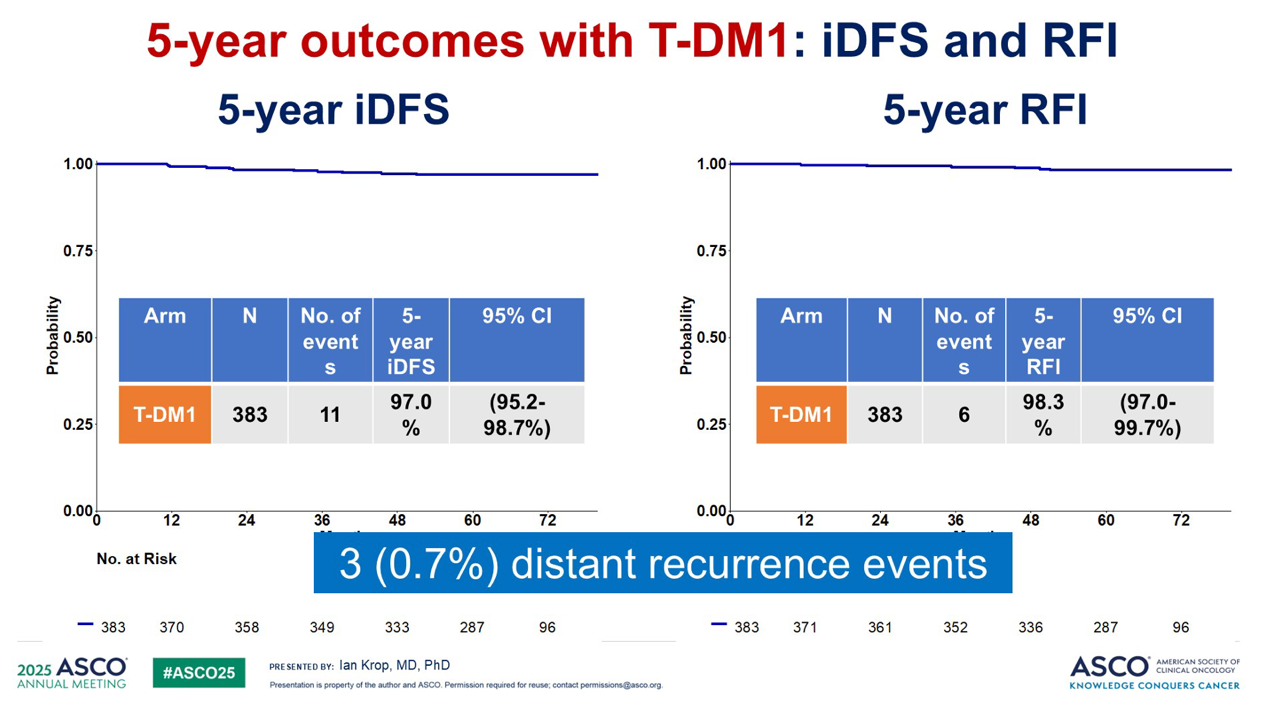
这项试验入组了 500 名患者,提出了两个问题:一年期的 T-DM1 治疗是否与极低的复发率相关?以及 T-DM1 的毒性特征是否低于标准的 TH 方案?结果提示,一年期的 T-DM1 治疗在预防复发方面非常有效,五年远处复发率低于 1%。
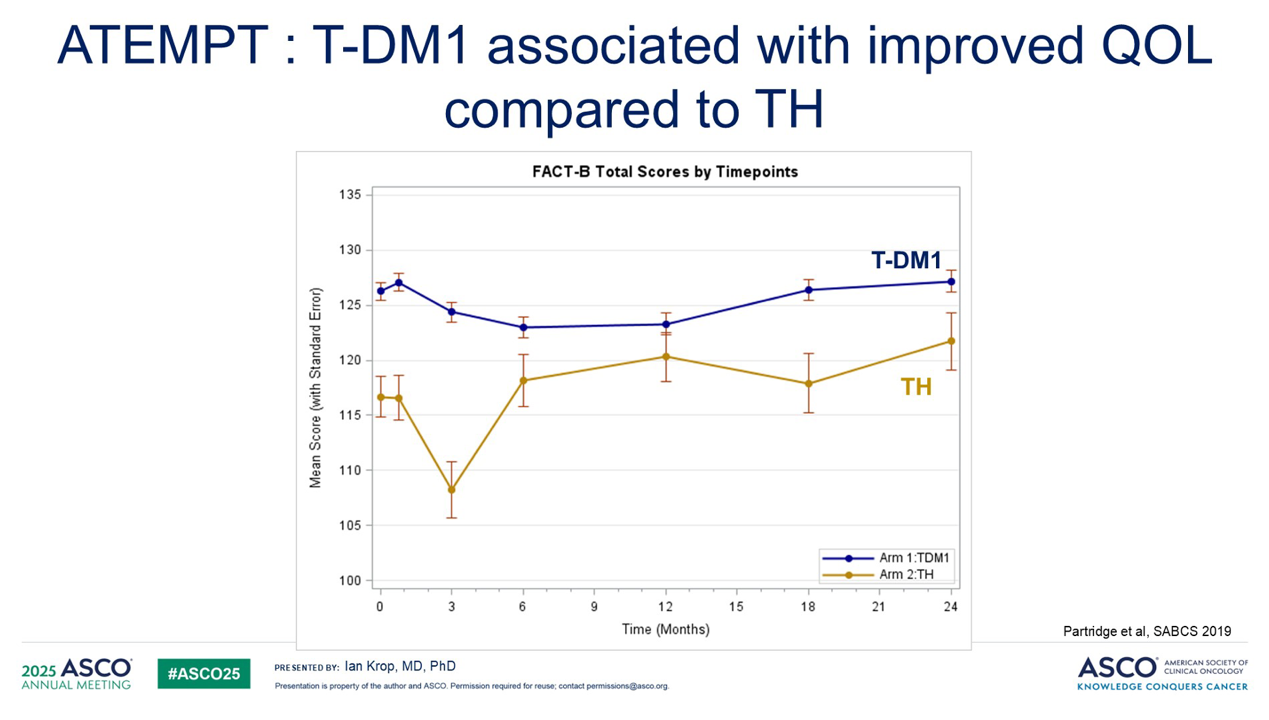
并且与 TH 方案相比,T-DM1 与显著更优的生活质量相关。
另一项研究者发起的试验(IIT)提出了一个更为根本性的问题:具有HER2异质性的肿瘤是否对HER2靶向治疗存在固有的耐药性? 研究者假设,如果一个肿瘤由HER2阳性细胞和HER2阴性细胞混合而成,使用像T-DM1这样高度特异的HER2靶向治疗,虽然可以有效杀灭HER2阳性细胞,但可能会使HER2阴性细胞存活下来。这一问题在新辅助治疗阶段尤为关键,因为该阶段治疗的目标是根除所有肿瘤细胞以预防远期复发。
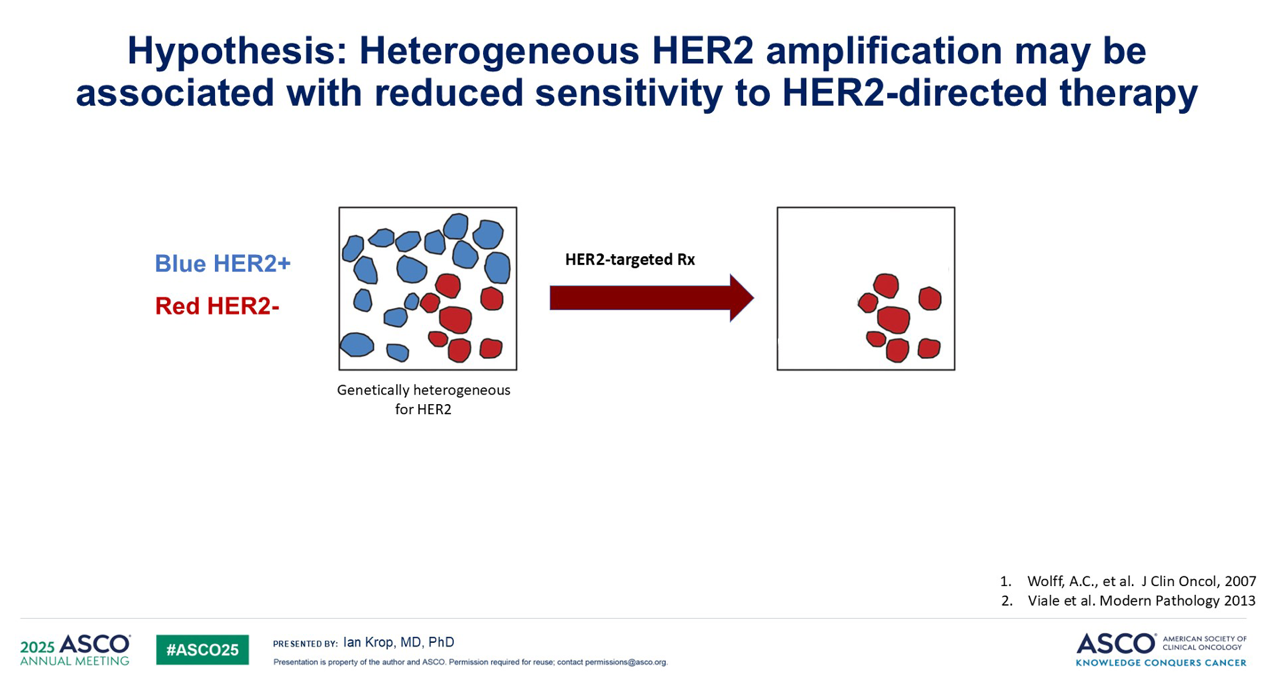
这种肿瘤内部的异质性不仅限于HER2,几乎是所有靶向治疗所面临的共同挑战,但当时尚无前瞻性临床研究对此进行深入探究。基于此,该研究团队开展了这项试验。

该研究共入组164名经中心实验室确诊的II期或III期HER2阳性乳腺癌患者。在治疗前,研究者在患者肿瘤的两个不同区域进行了活检,并获取六个核心组织样本,以评估基线时的肿瘤异质性。随后,患者接受了6个周期的T-DM1联合帕妥珠单抗新辅助治疗,并在治疗结束后进行手术。
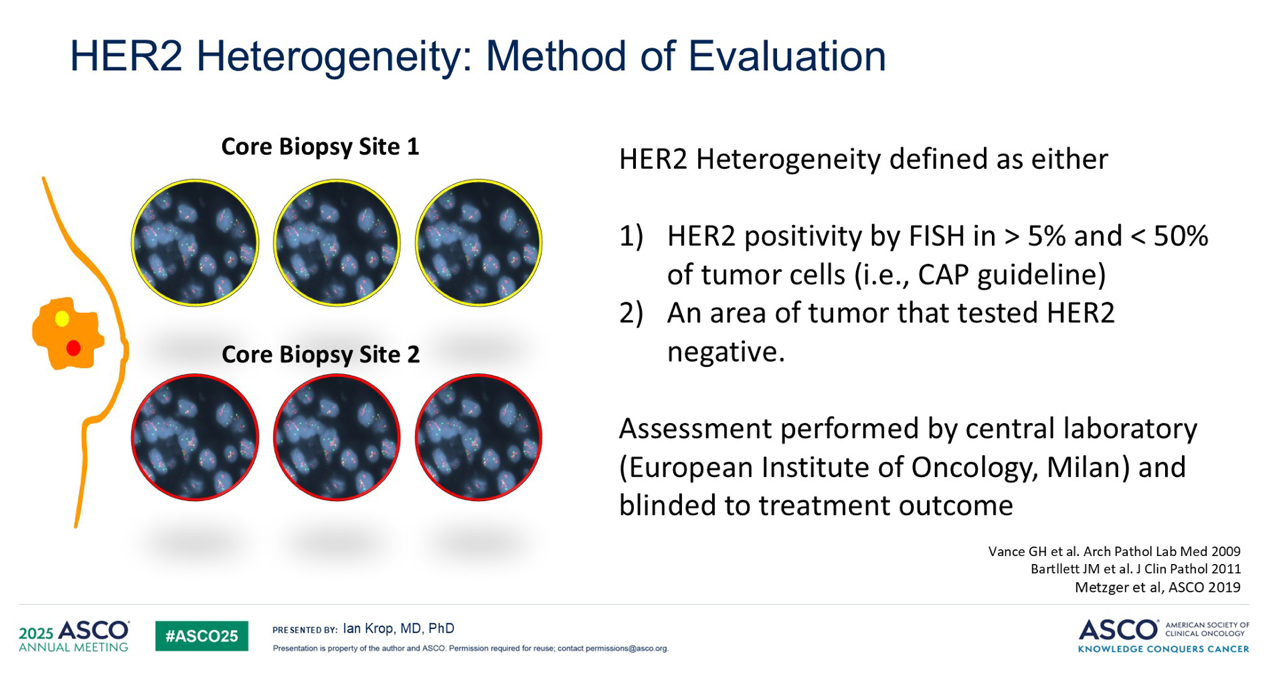
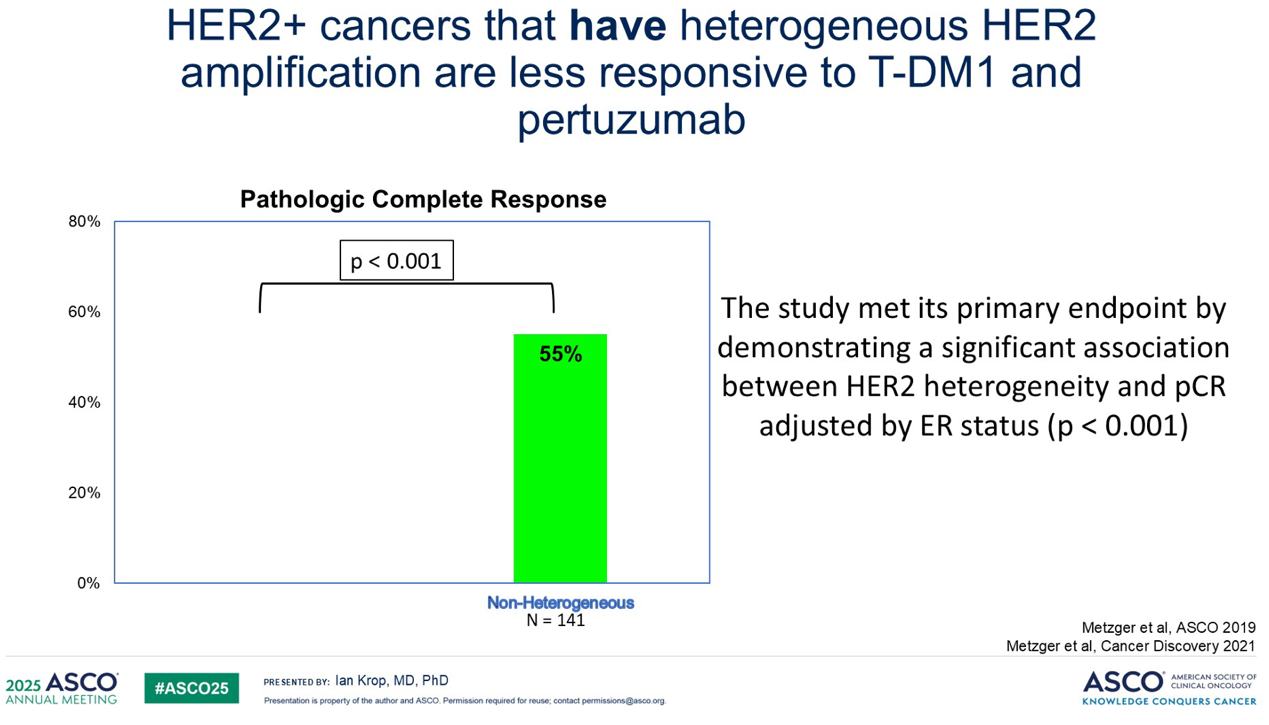
研究发现,在没有 HER2扩增异质性(即HER2扩增呈高度均质性)的患者中,病理完全缓解(pCR)率达到了可观的55%。然而,在存在异质性的肿瘤中,pCR率则显著降低。这些差异在统计学上具有高度显著性,并且在随后的KRISTINE试验中得到了验证。KRISTINE试验同样考察了T-DM1联合帕妥珠单抗,结果显示了几乎相同的差异:异质性与较低的pCR率相关。值得注意的是,该试验是利用免疫组织化学(IHC)来定义异质性。因此,我认为这些试验的汇总数据有力地证明了,当采用高度特异的靶向治疗时,肿瘤的异质性是一个不容忽视的问题。
那么接下来的问题是,对于具有旁观者效应(bystander effect)的药物,例如T-DXd,情况又会如何?这种旁观者效应本质上就是为了克服肿瘤异质性而设计的。因此,在T-DXd这类药物的治疗中,肿瘤异质性是否仍然会影响耐药性?这个问题的答案目前尚不明确。我们期待像DESTINY-Breast11这样考察T-DXd新辅助治疗的试验能够回答这个问题,其结果预计将很快公布。我认为,这是一个对于未来肿瘤治疗至关重要的议题。

此外,还有许多问题需要我们解决。目前可能最紧迫的是,在临床上我们应如何以及是否应该对 ADC 进行序贯使用?如果进行序贯治疗,不同 ADC 的靶点不同或者有效载荷不同,是否重要?

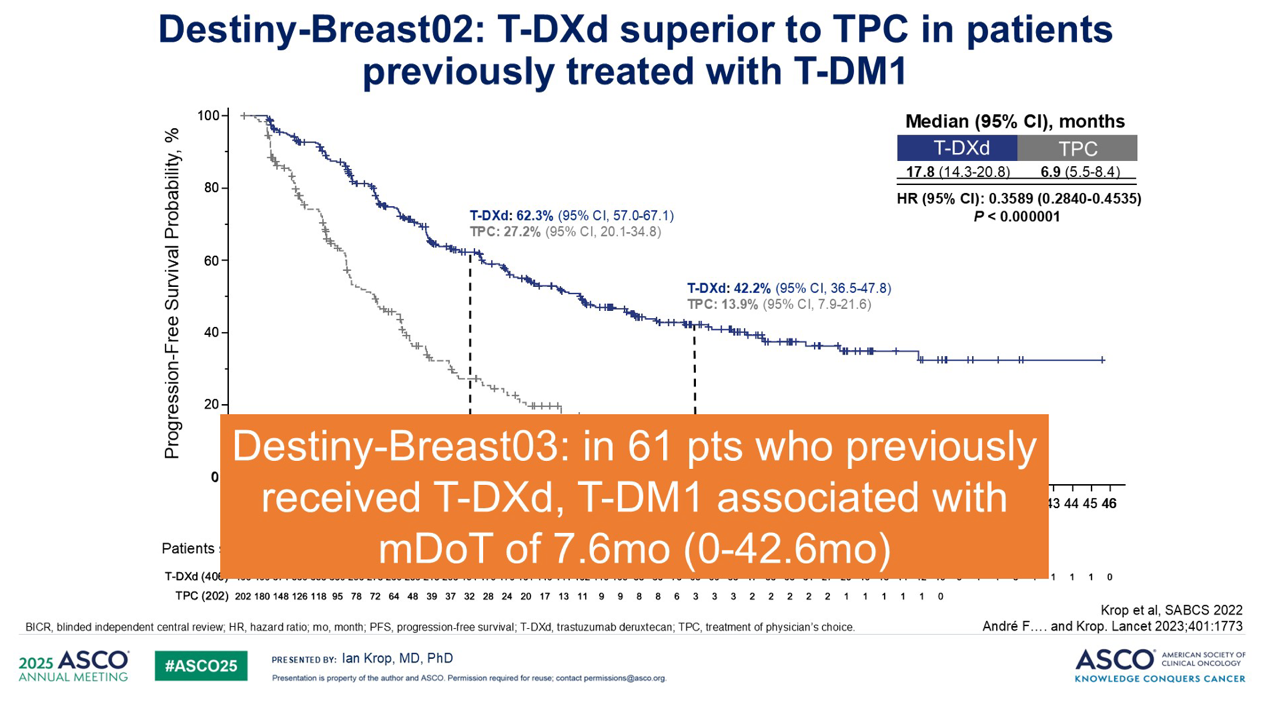
DESTINY-Breast02 研究提示,可以对ADC 进行序贯使用:该研究提示,在先前接受过 T-DM1 治疗的患者中,尽管之前对 ADC 进展,T-DXd 仍然远优于传统的标准治疗。我们现在在 DESTINY-Breast03 中也有一些关于相反顺序的数据:那些先前接受 T-DXd 治疗进展后,接下来使用 T-DM1 作为后续治疗的患者,其中位治疗持续时间约为 7.6 个月。因此,尽管之前使用过 ADC,仍然显示出显著的疗效。
但是,有大量的真实世界回顾性研究表明,在接受过第一种 ADC 治疗后,再接受第二种 ADC,尤其是具有相同有效载荷类别的 ADC 的患者,其获益相当有限。所以这仍然是一个未解决的问题。我们需要前瞻性数据。
由于该问题的重要性,TBCRC 已经启动了两项试验来对之探索。一项是 TRADE-DXd 试验,该试验将患者随机分配至 T-DXd 或 Dato-DXd 组,然后在进展时换用另一种 ADC。
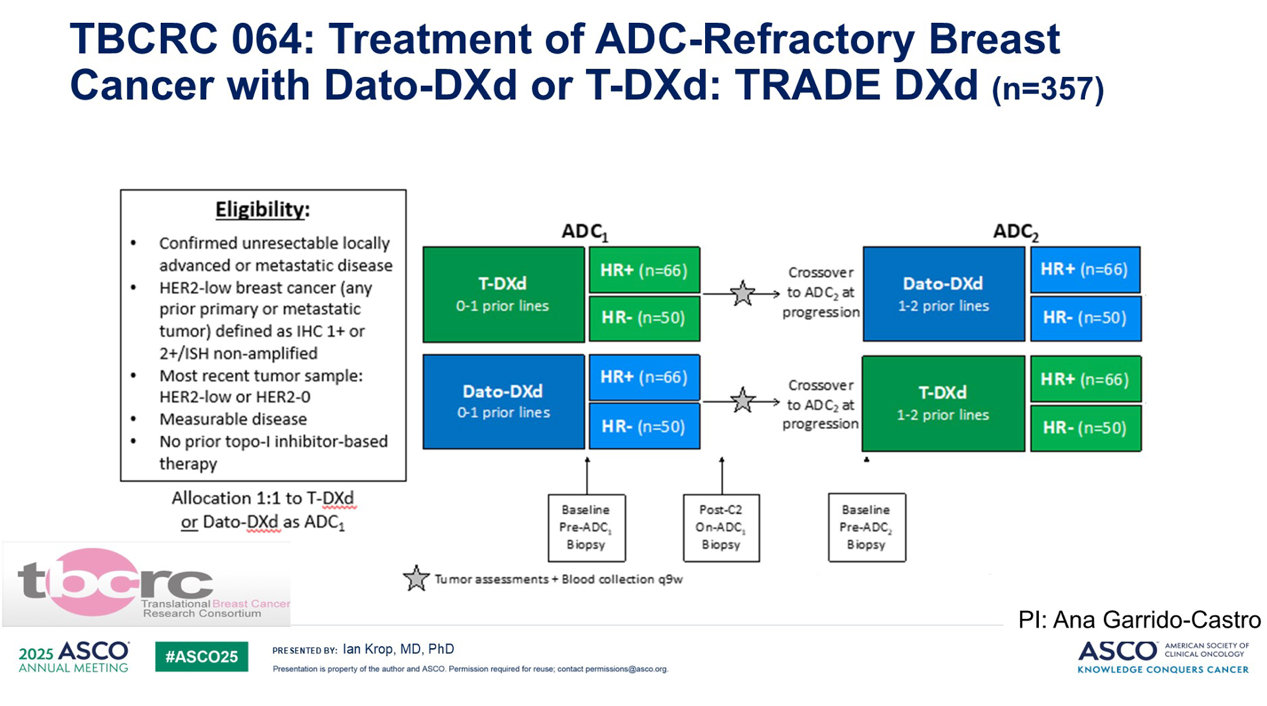
另一项研究TBCRC 067研究也涉及目前所有已获 FDA 批准的 ADC 的序贯使用。这两项试验都内置了广泛的生物标志物分析,试图找出对每种个体药物获益的预测因子和耐药机制,所以这方面还会有更多进展。

另一个关键问题在于耐药机制。迄今为止,学界在明确识别ADC的耐药机制方面尚未取得突破性进展。

尽管已经提出了一些可能的机制,例如对有效载荷本身的耐药性、靶点的丢失,或者ADC内化过程的改变,但目前我们尚缺乏确凿的临床证据来证实这些机制的实际发生。

但这种情况正在发生改变。对 DESTINY-Breast03 的 ctDNA 分析表明,在一些接受 T-DXd 治疗并发生进展的患者中出现了 拓扑异构酶I的突变,而这些突变在T-DM1治疗进展的患者中未出现。
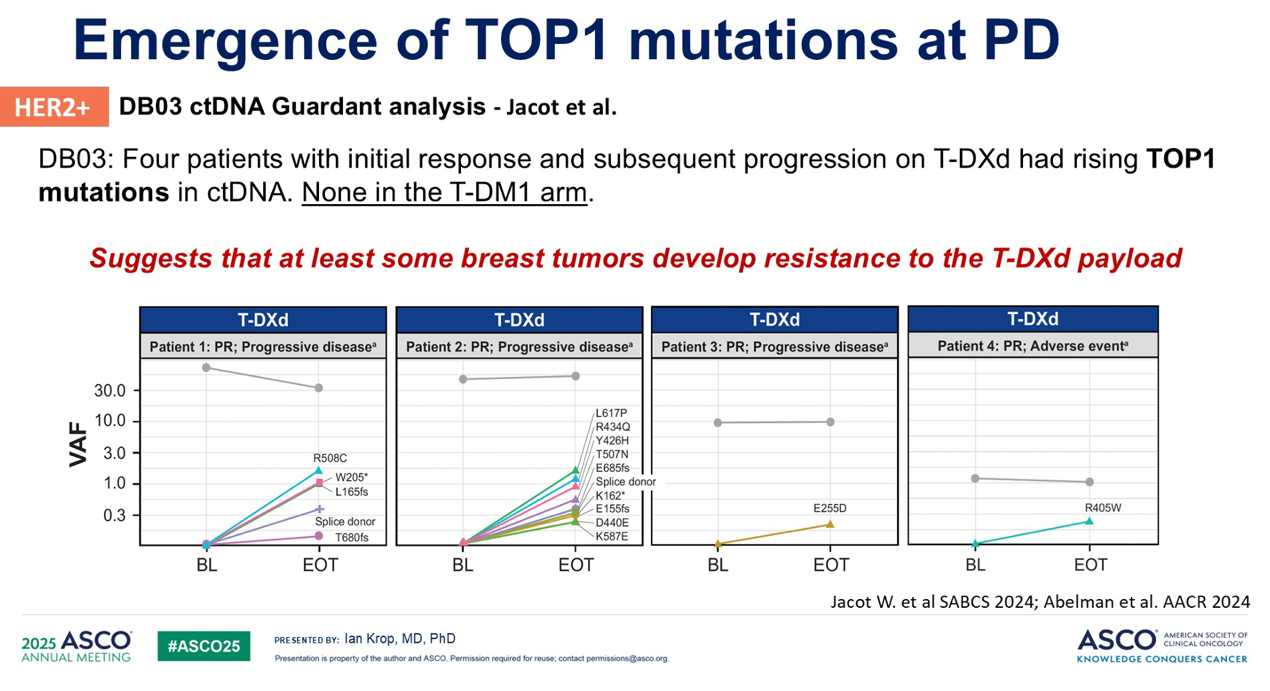
此外,最近一项对近 2,800 个接受 T-DXd 治疗的患者的肿瘤进行的多组学分析数据显示,ABCC1(编码一种多药耐药转运蛋白的基因)的上调与接受 T-DXd 治疗后的较差结局相关,如下方红色曲线所示。
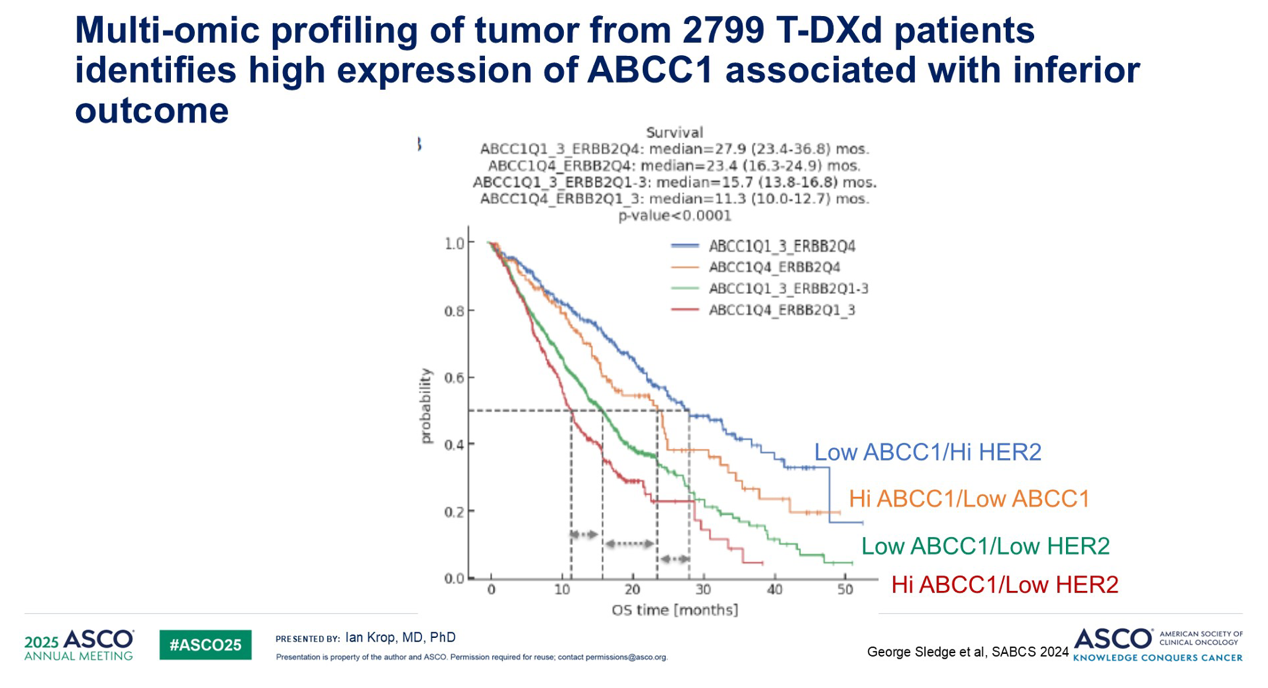
因此,确实有迹象表明对有效载荷的耐药问题仍是临床一大挑战。当然,这也意味着如果我们尝试使用相同有效载荷类别的 ADC,很可能存在交叉耐药。

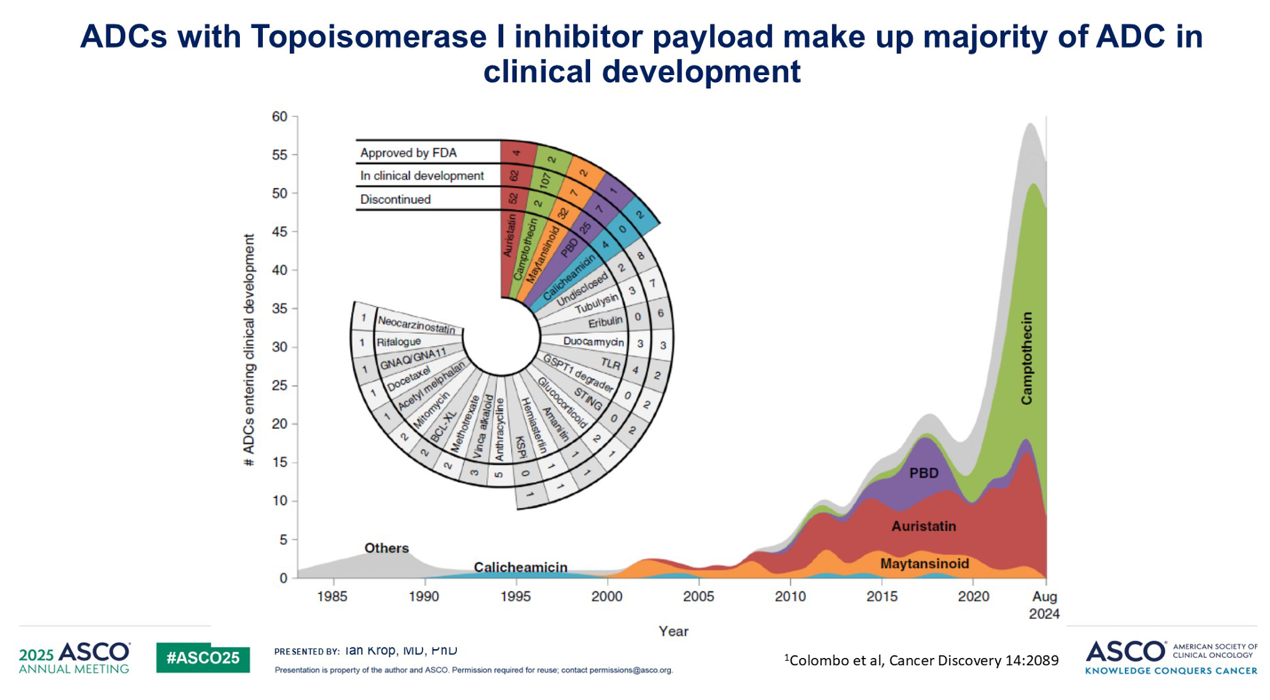
我认为这是一个特别的问题,因为尽管我们有许多 ADC 靶点正在开发中,但我们并没有很多种有效载荷。事实上,当前临床开发中所有 ADC 的 90% 要么是拓扑异构酶抑制剂有效载荷,要么是微管蛋白抑制剂有效载荷。因此,如果我们真的像我认为应该的那样在临床上对 ADC 进行序贯治疗,我们迫切需要新的有效载荷类别。

此外,关于ADC还有另一个问题——其作用机制是什么?

我原以为学界对ADC的探索已足够深入,然而几个月前一项研究考察了 HER2 低表达和 HER2 零表达肿瘤的临床前模式,并提示,在体外,当 T-DXd 作用于这些癌症时,几乎没有观察到旁观者效应的证据。这是因为在这些 HER2 表达极低或无明显表达的癌症中,很少有 T-DXd 被内化。

但有趣的是,在体内确实观察到 T-DXd 在这些 HER2 低表达和无表达癌症中具有显著疗效。研究者发现这是因为 T-DXd 在肿瘤微环境中被分泌的组织蛋白酶在细胞外裂解,而这些组织蛋白酶在这些癌症的肿瘤微环境(TME)中有所上调。这只是一项研究,但如果它在未来的探索中得到验证,那就确实表明如果 T-DXd 的有效载荷释放不需要细胞内连接子裂解,这就解释了为什么在 HER2 水平极低时,HER2 水平似乎不能很好地预测 T-DXd 的疗效。

这也提示我们应该关注肿瘤微环境中组织蛋白酶的水平作为 T-DXd 获益的潜在预测因子。从好的方面看,它表明如果药物真的不需要被细胞内化运输,那么 T-DXd 可能不太容易受到与细胞内运输相关的耐药机制的影响,所以这方面同样会有更多进展。
这是一项多中心研究,考察 T-DXd 在 HER2 表达转移性乳腺癌患者中的应用。所有患者都将接受 T-DXd 治疗直至进展。研究将收集大量的组织和 ctDNA 进行分析,试图解决其中一些生物标志物问题。

遗憾的是,关于ADC还有许多悬而未决的问题,诸如如何克服 ADC 的毒性等。但我想再提出一个值得关注问题:鉴于我们当前一代 HER2 靶向疗法所具有的高疗效水平,我们是否应该开始考虑以治愈为目的,而非目前的姑息目的来治疗 HER2 转移性乳腺癌呢?

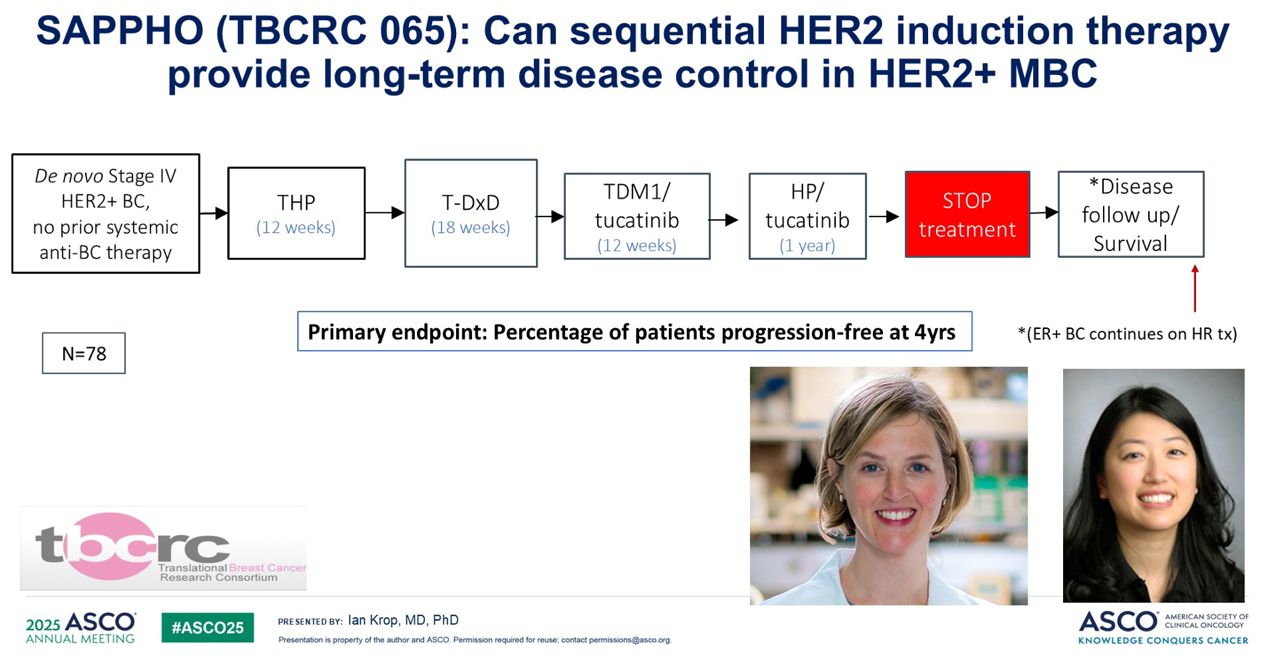
TBCRC 一项名为 SAPPHO的研究正在对该问题进行探索。该研究入组新发转移性 HER2 阳性乳腺癌患者,并使用所有最有效的 HER2 疗法,但不是用到进展为止,而是按既定疗程序贯使用。患者将先接受一个疗程的 THP(曲妥珠单抗联合帕妥珠单抗联合紫杉类),然后是 T-DXd,接着是 T-DM1 联合图卡替尼,然后是 HP(曲妥珠单抗联合帕妥珠单抗加图卡替尼)。之后停止治疗并密切随访这些患者。其设想是,通过使用这些序贯的、希望是非交叉耐药的疗法,我们能够消除肿瘤的所有亚克隆,使得患者无需无限期地持续接受治疗。研究的主要终点是4年无进展患者的百分比。
最后,我想再次强调研究者发起的研究(IIT)的重要性,特别是作为临床研究者职业发展道路的重要性,IIT是培养下一代临床科学家的摇篮。期待各方共同努力,确保这一关键的创新模式得以延续。

排版编辑:xiaodong











 苏公网安备32059002004080号
苏公网安备32059002004080号


