近期,一项由浙江大学医学院附属第二医院丁克峰教授团队主导的研究在国际知名期刊Signal Transduction and Targeted Therapy(STTT,IF 52.7)上发表。该研究是一项汇总分析,旨在评估口服小分子KRAS G12C抑制剂IBI351(fulzerasib)单药在未经KRAS G12C抑制剂治疗的KRAS G12C突变转移性结直肠癌(mCRC)中国患者中的疗效与安全性。这项对两项I期临床研究的汇总分析结果显示,IBI351表现出令人鼓舞的抗肿瘤活性:在总体人群(n=56例)中,客观缓解率(ORR)为44.6%,中位无进展生存期(mPFS)为8.1个月,中位总生存期(mOS)达17.0个月。尤其值得注意的是,在接受过至少两线既往治疗的患者中,ORR高达63.0%,mPFS为8.2个月。该研究证实了IBI351单药治疗KRAS G12C突变mCRC的潜力,有望为患者提供一种高效且耐受性良好的治疗新选择。

结直肠癌(CRC)是我国第二大常见恶性肿瘤,同时也是第四大癌症相关死亡原因。 2022年中国新发病例数约51.7万,死亡病例数约24万。在过去二十年间,无论男女,中国CRC的发病率与死亡率均呈攀升态势。
KRAS G12C突变通常与不良临床结局相关
CRC是一种分子异质性疾病,其从良性肿瘤演变为浸润癌,并最终发展为转移性CRC的过程,涉及一系列基因的改变。在这些基因中,KRAS在肿瘤发生中扮演着重要角色,驱动了约50%的CRC患者的肿瘤进展。其中,KRAS G12C突变见于3%~4%的CRC患者,这一亚型通常与更差的临床预后相关。
根据美国国家综合癌症网络(NCCN)和中国临床肿瘤学会(CSCO)的指南,建议转移性CRC(mCRC)患者进行微卫星不稳定性(MSI)、KRAS/NRAS、BRAF、HER-2、NTRK以及POLE/POLD1等基因检测。KRAS在过去被认为是“不可成药”的靶点。近年来,随着研究的推进,已成功开发出针对KRAS G12C的靶向药物,为这一患者群体开辟了新的治疗选择。Sotorasib和Adagrasib这两种KRAS G12C抑制剂已在美国获批,用于治疗经治KRAS G12C突变CRC成人患者。2024年8月21日,我国自主研发的KRAS G12C抑制剂(IBI351/GFH925)获国家药品监督管理局(NMPA)批准上市,用于至少接受过一种系统性治疗的KRAS G12C突变晚期非小细胞肺癌(NSCLC)成人患者。但我国结直肠癌治疗领域,仍无KRAS G12C抑制剂获批。
口服小分子KRAS G12C抑制剂IBI351
治疗KRAS G12C突变mCRC中国患者
IBI351是一种口服小分子KRAS G12C共价抑制剂,在晚期实体瘤(如NSCLC)患者中已展现出良好的疗效。然而其在KRAS G12C突变mCRC患者中的数据尚不充分。在此背景下,丁克峰教授领衔的研究团队对两项I期临床试验(NCT05005234和NCT05497336)的数据进行了汇总分析,旨在评估IBI351单药对于未经KRAS G12C抑制剂治疗的、KRAS G12C突变mCRC中国患者的疗效与安全性。
本次汇总分析共纳入56例未经KRAS G12C抑制剂治疗的、携带KRAS G12C突变的mCRC患者(总体人群),他们均接受了IBI351单药治疗。超过60%的患者既往接受过至少二线治疗后失败。中位治疗持续时间为7.7个月。在总体人群中,患者的中位年龄为58岁。其中,60.7%为男性,73.2%的ECOG PS评分为1分,78.6%的患者存在肺转移,60.7%存在肝转移。
总体人群:ORR 44.6%,DCR 87.5%,mPFS 8.1个月,mOS 17.0个月
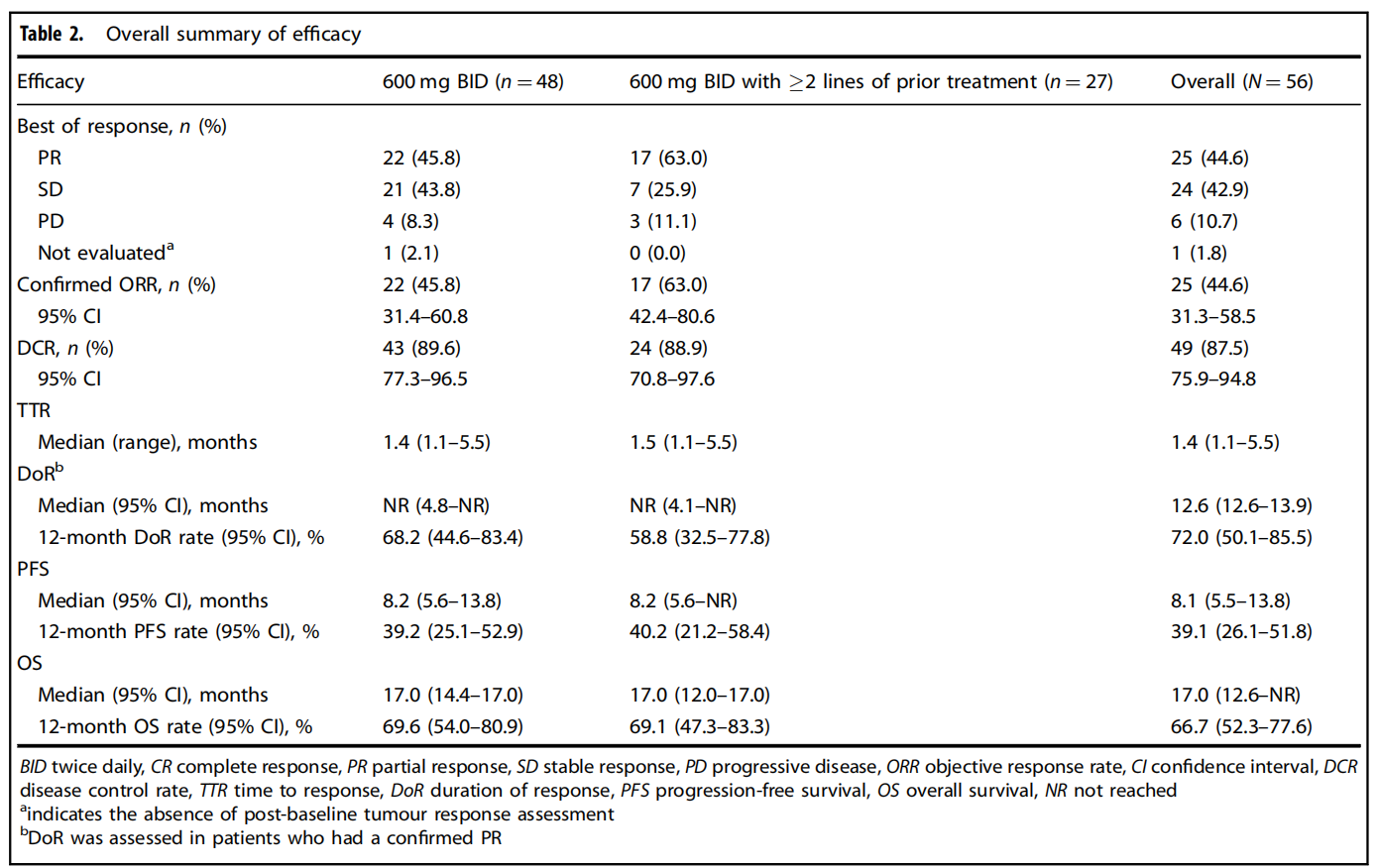
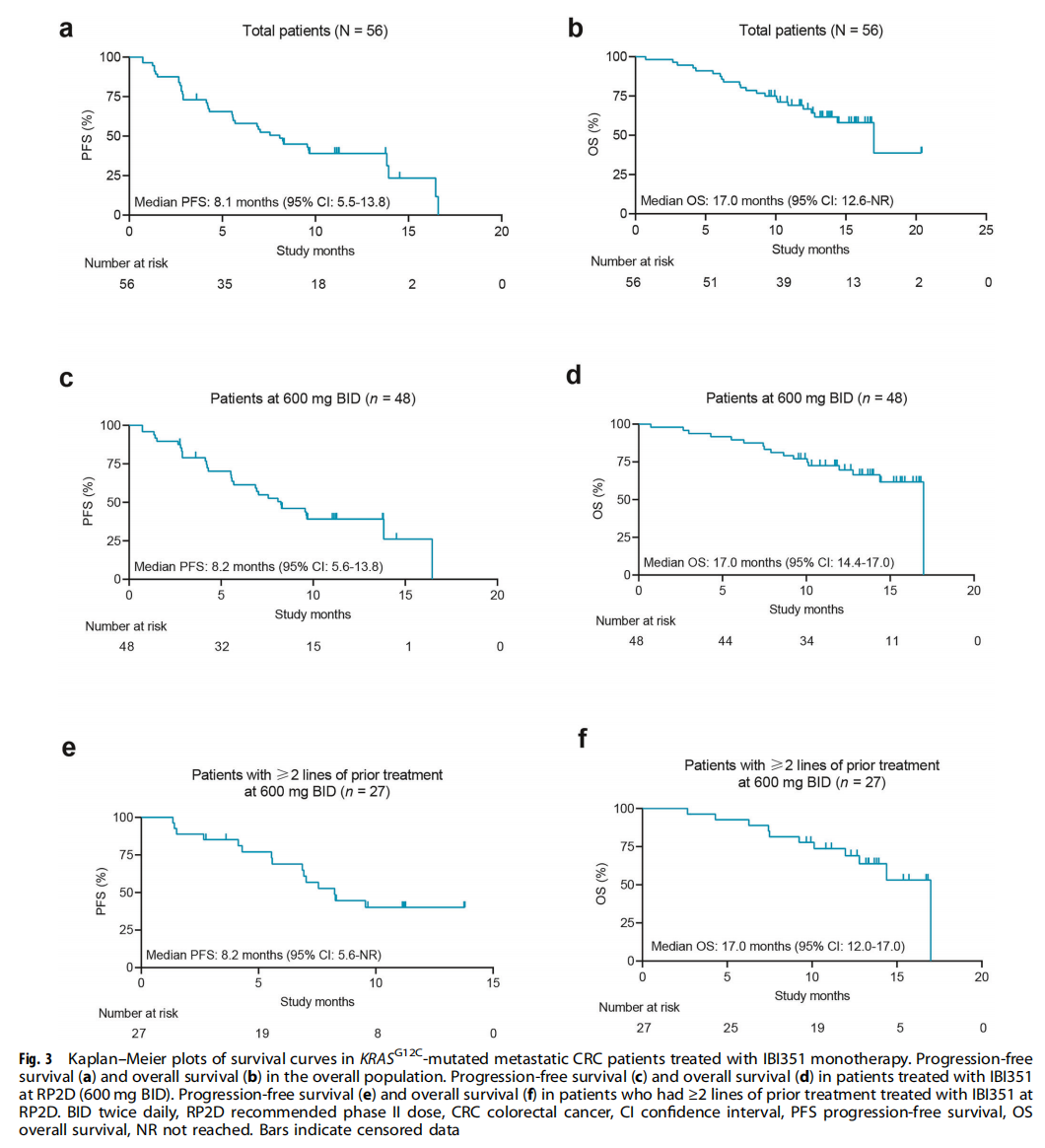
在56例患者中,55例有基线后的肿瘤评估数据。结果显示,46例患者的靶病灶出现不同程度的缩小。25例获得确认的部分缓解(PR),24例疾病稳定(SD),另有6例疾病进展(PD)。经研究者确认的客观缓解率(ORR)为44.6%(图1),疾病控制率(DCR)为87.5%。中位至缓解时间(TTR)为1.4个月。在获得确认PR的25例患者中,大部分(64.0%)在数据截止日时仍在接受治疗。中位缓解持续时间(DoR)为12.6个月。在中位随访13.8个月时,中位无进展生存期(PFS)为8.1个月,中位总生存期(OS)为17.0个月(表1)。
在接受II期推荐剂量(RP2D)即600 mg BID治疗的48例患者中,经确认的ORR为45.8%,DCR为89.6%。中位TTR为1.4个月。中位DoR尚未达到,在22例获得确认PR的患者中,有7例后续出现PD或死亡。在中位随访11.3个月时,中位PFS为8.2个月,中位OS为17.0个月(表1)。
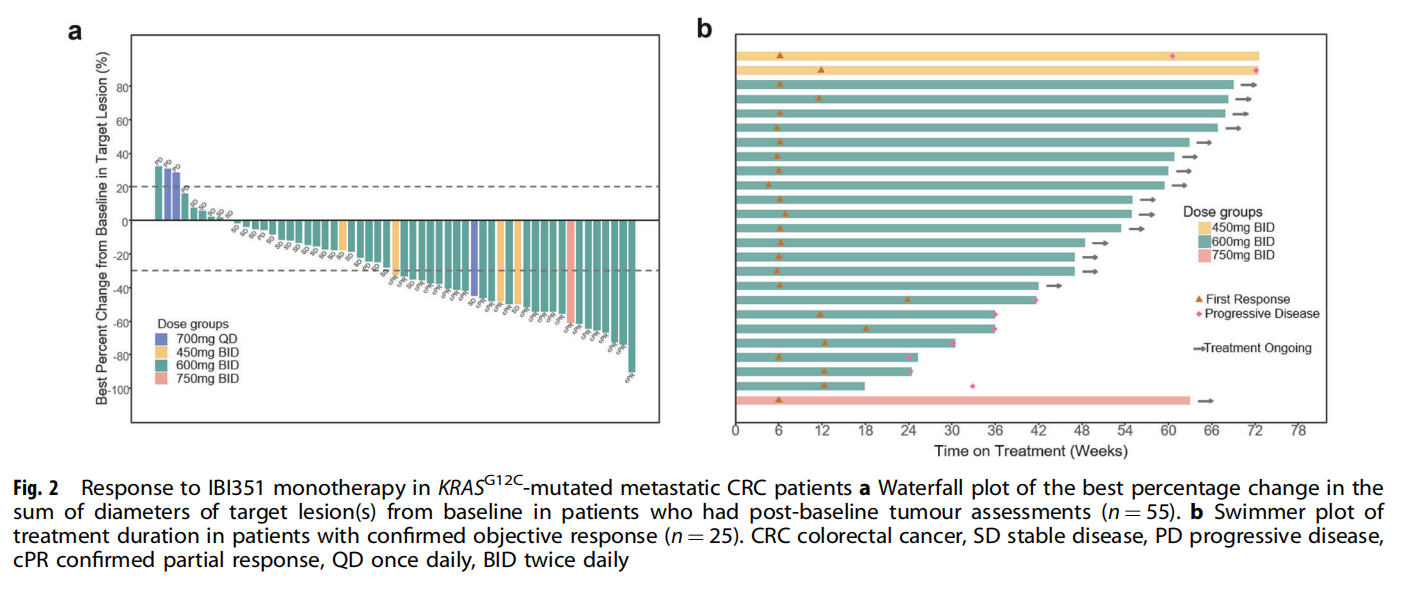
表1 疗效总结
后线治疗患者:ORR 63.0%,DCR 88.9%,mPFS 8.2个月,mOS 17.0个月
在既往接受过至少两线治疗的患者亚组中(n=27例,均接受600 mg BID的RP2D剂量治疗),经确认的ORR达到63.0%,DCR为88.9%。在中位随访11.2个月时,该亚组患者的中位PFS为8.2个月,中位OS为17.0个月(表1、图2)。
安全可控
与既往研究报告相比,本次汇总分析未发现新的安全性信号。53例(94.6%)发生了治疗相关不良事件(TRAE)。最常见的TRAE包括贫血(50.0%)、白细胞计数降低(32.1%)、血胆红素升高(30.4%)和瘙痒(26.8%)。共有14例(25.0%)患者报告了3级TRAE,最常见的3级TRAE为贫血(7.1%)和γ-谷氨酰转移酶升高(5.4%)。未观察到4-5级TRAE。
分别有12例(21.4%)和6例(10.7%)患者因TRAE导致剂量中断或剂量下调。无TRAE导致治疗中止。
在接受600 mg BID剂量治疗的患者中,观察到的安全性特征与总体人群相似。
令人鼓舞的疗效和可控的安全性
该汇总分析结果表明,IBI351单药在未经KRAS G12C抑制剂治疗的、KRAS G12C突变mCRC中国患者中,展现了令人鼓舞的疗效和可控的安全性。这些发现为IBI351单药或联合疗法的进一步临床开发奠定了坚实基础,有望为该患者群体提供一种新的治疗选择。一项评估IBI351联合西妥昔单抗治疗mCRC的III期研究已在计划中,其结果值得期待。
Yuan Y, Deng Y, Jin Y, et al. Efficacy and safety of IBI351 (fulzerasib) monotherapy in KRASG12C inhibitor-naïve Chinese patients with KRASG12C-mutated metastatic colorectal cancer: a pooled analysis from phase I part of two studies. Signal Transduct Target Ther. 2025 Jul 25;10(1):241.
排版编辑:肿瘤资讯-Marie











 苏公网安备32059002004080号
苏公网安备32059002004080号


