福建省抗癌协会癌痛专业委员会和福建省抗癌协会中西医整合肿瘤专委会青年委员会主办的【十邑论坛】开播啦!论坛于每周二推出,带您用中文听原汁原味的2025年美国临床肿瘤学会(ASCO)研究。本期论坛聚焦2025 ASCO年会上激素受体阳性(HR+)乳腺癌二线及以上治疗的未来发展,【肿瘤资讯】特邀三明市第二医院杨兰芳教授主要基于纪念斯隆-凯特琳癌症中心和威尔康奈尔医学院的Komal Jhaveri博士的精彩报告进行深度解读。
三明市第二医院 肿瘤科 主治医师

今天话题的关键要点将围绕几个关键要点展开。首先,未来将有不止新型内分泌药物的单药疗法获批作为 ESR1 突变型乳腺癌的治疗,这些药物也有可能成为与其他靶向药物联合治疗的首选。其次,下一代突变选择性 PI3K 抑制剂在早期临床试验中已展现出良好的安全性,其导致的高血糖和皮疹等副作用较轻。第三,从目前I期临床试验数据可见, CDK2 抑制剂作为单一疗法可能效果有限,但与 CDK4 或 CDK4/6 抑制剂联合使用有望克服耐药问题。此外,KAT6 抑制剂与内分泌疗法的联合应用,也可能解决 CDK4/6 抑制剂治疗后的耐药机制问题。

目前,HR+晚期乳腺癌的一线标准治疗方案是 CDK4/6 抑制剂联合内分泌疗法。然而,大约 50% 的患者在接受治疗 18 个月后病情会出现进展。
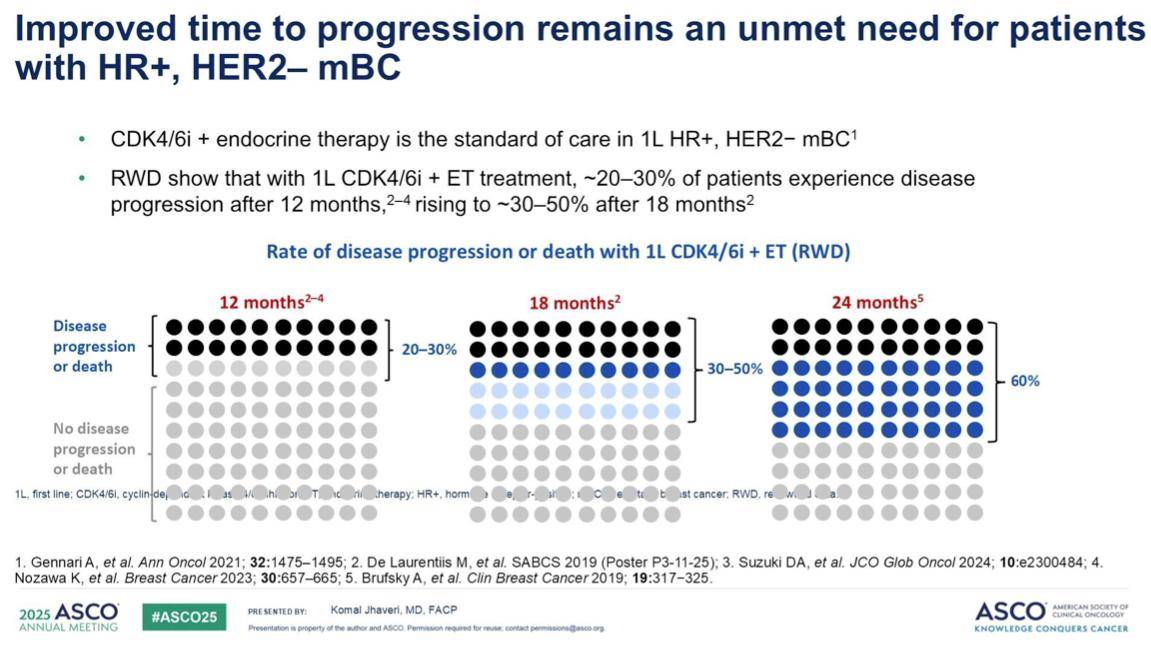
在 CDK4/6 抑制剂治疗失败后,二线及以上治疗的疗效并不理想,例如,针对 PI3K/AKT/mTOR 通路的靶向联合疗法通常只能维持 7~8 个月。
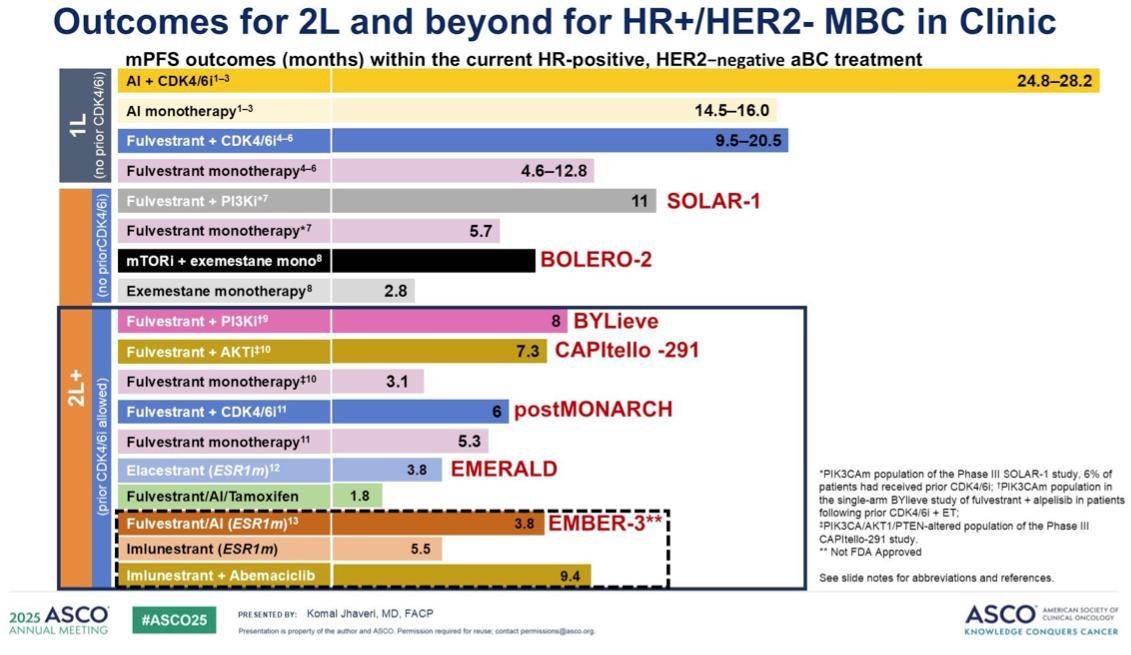
这凸显了我们迫切需要新的治疗方案来改善激素受体阳性转移性乳腺癌的疗效。在这些新兴药物的开发中,我们始终致力于在安全性和有效性之间取得平衡,最终目标是延长患者的内分泌治疗时间并推迟化疗。

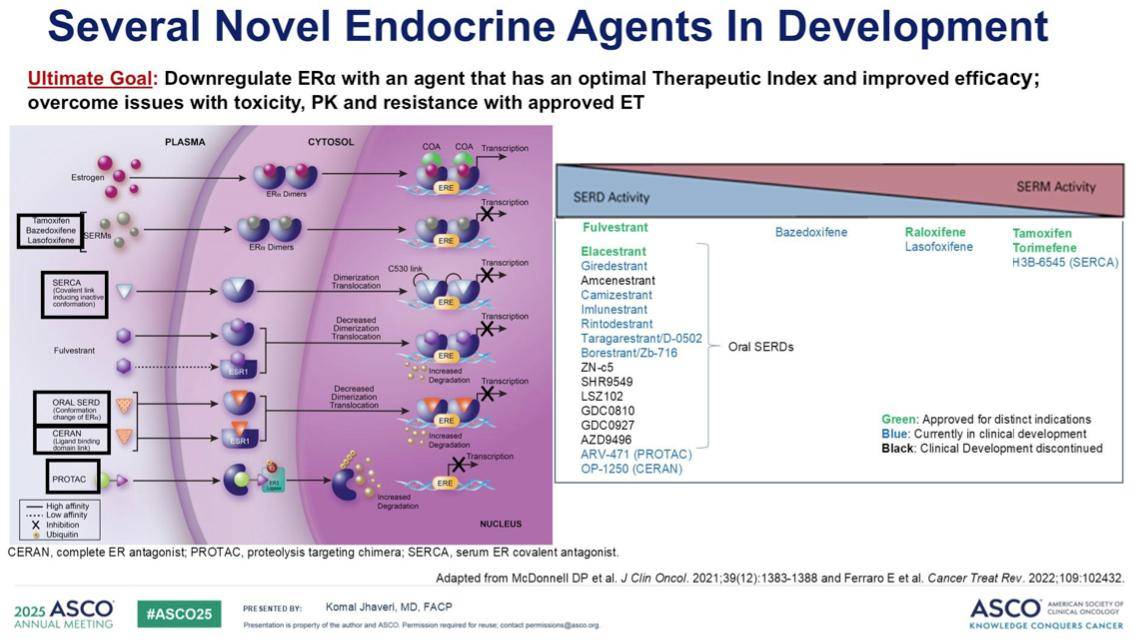
新兴的内分泌药物中,除了已上市的口服选择性雌激素受体降解剂(SERD)艾拉司群,我们还看到了其他新型内分泌药物的数据。
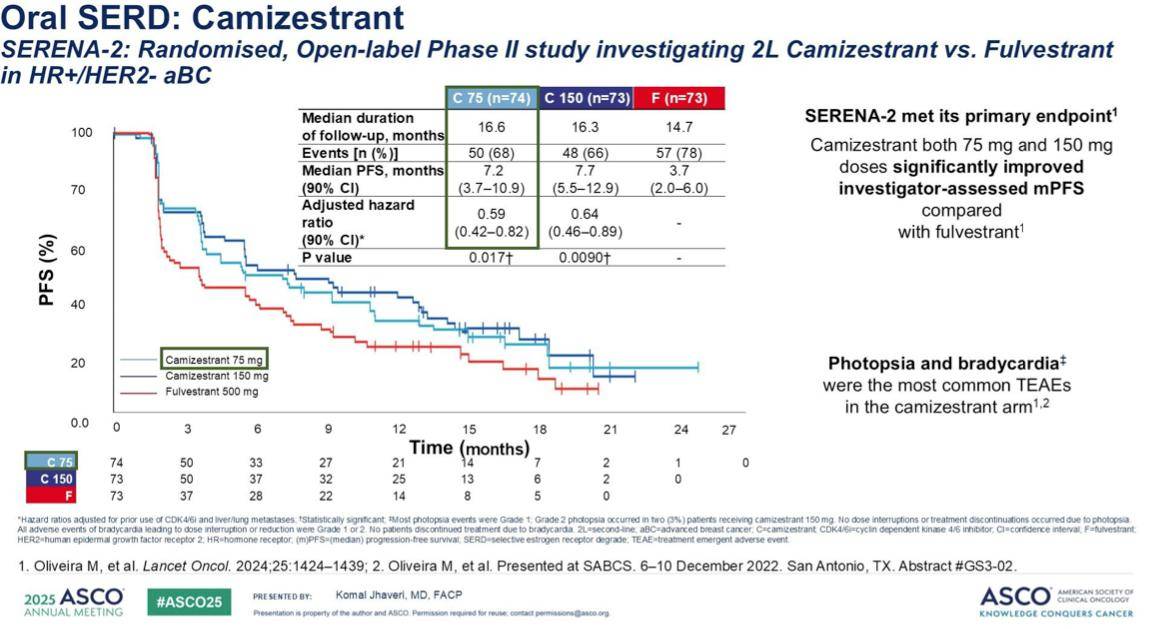
口服SERD 卡米司群在SERENA-2试验中显示出有效性,尤其是在 ESR1 突变型乳腺癌中。
同时,我们也有了PROTAC 药物 ARV-471,它通过泛素化和蛋白酶体降解来靶向雌激素受体,在二期试验中表现良好。
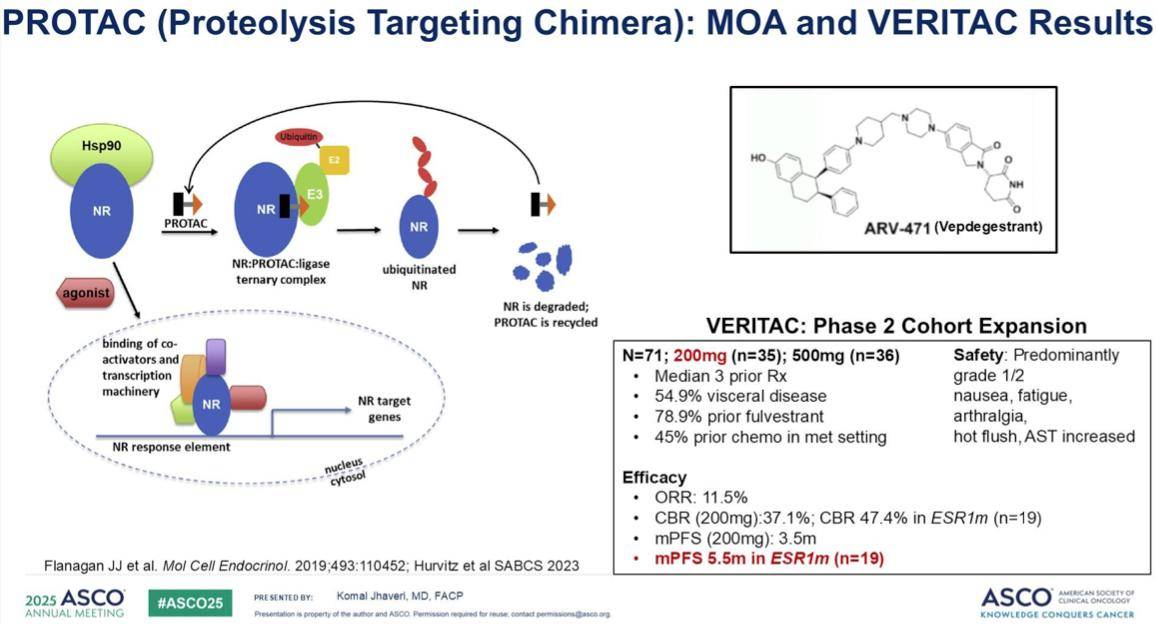
我们即将看到三期VERITAC-2研究的数据。该研究是一项注册三期临床试验,比较Vepdegestrant与氟维司群在二线或三线治疗中的疗效。患者此前接受的CDK4/6抑制剂联合内分泌治疗只能为一线,接受的内分泌治疗共计不超过两线。

接下来,我们将探讨完全雌激素受体拮抗剂(CERAN)的临床应用。与仅部分拮抗的药物(如他莫昔芬)不同,Palazestrant能够实现对雌激素受体的完全拮抗。
一项关于Palazestrant单药治疗的II期临床试验得出了令人鼓舞的结果。即使是那些此前接受过CDK4/6抑制剂和氟维司群治疗的患者,Palazestrant作为单药治疗ESR1基因突变肿瘤时,依然展现出更优的疗效。在安全性方面,该药物的主要副作用值得关注的是中性粒细胞减少症。
目前,一项名为OPERA-01的注册性III期单药试验正在进行中,旨在将Palazestrant与研究者选择的二线或三线转移性乳腺癌内分泌疗法进行对比,以进一步评估其疗效和安全性。
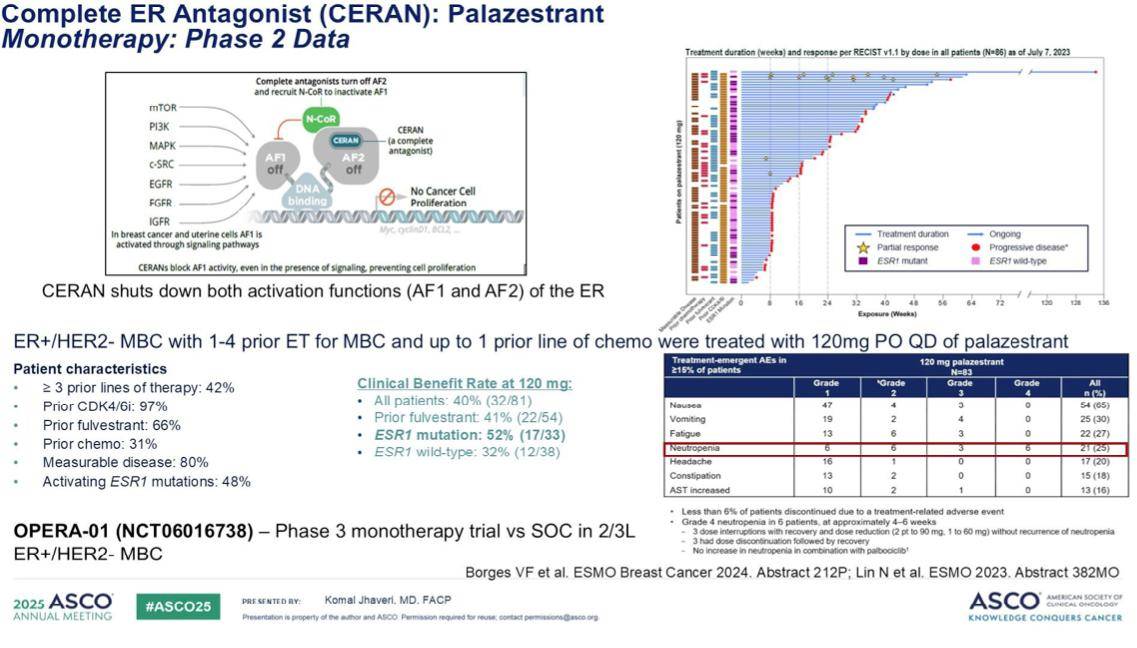
综合目前的研究数据,无论是来自像EMERALD这样获得阳性结果的研究,还是其他一些结果为阴性的试验,我们都观察到一个共同的信号:口服SERD类药物对ESR1基因突变肿瘤表现出显著的疗效,并且优于研究者选择的内分泌疗法。
然而,一个值得警惕的现象是,在单药治疗中,仍有高达40%的患者在早期阶段就出现了疾病进展。这表明,在看似相似的生存曲线上,有一部分患者过早地退出了治疗。同时,仍有60%的患者获益时间不足6个月。这一现实情况凸显了单一药物治疗方案的局限性,并强调了探索口服SERD与其他新型内分泌药物联合治疗的必要性,以期进一步提升临床疗效,为更多患者带来持久获益。
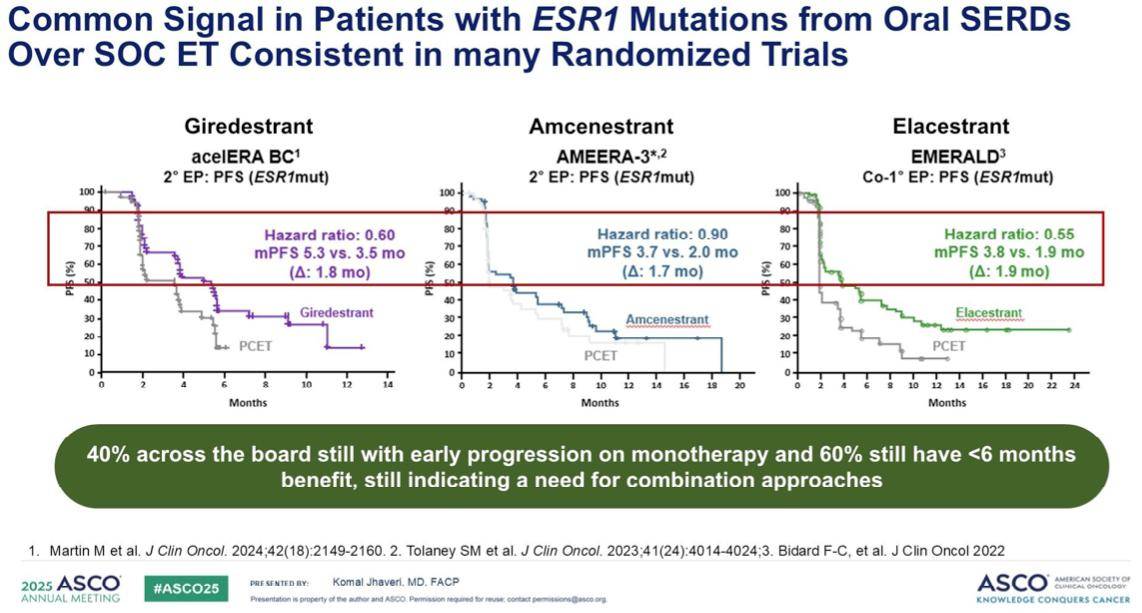
EMBAR-3试验的亚组分析显示,对于接受 Imlunestrant联合阿贝西利治疗的患者,无论其肿瘤的ESR1基因是突变型还是野生型,均可获得显著的临床获益。
具体来说,在ESR1突变型患者中,联合治疗组的中位无进展生存期(PFS)达到了11.1个月,相比 Imulnestrant 单药组的 5.5 个月有了显著延长,风险比(HR)为 0.53。而在 ESR1 野生型患者中,联合组的中位 PFS 也达到了 9.1 个月,同样优于单药组的 5.5 个月。这表明,Imulnestrant 联合阿贝西利的双药疗法,能够为不同 ESR1 基因状态的患者带来治疗上的优势。
同样,我们看到了阿贝西利与Lasofoxifene联合应用的潜力。ELAINE 2作为一项规模较小的II期临床试验,取得了令人瞩目的成果:中位无进展生存期(PFS)达到了13个月。这一积极数据为正在进行的注册性III期试验ELAINE 3提供了强有力的支持。
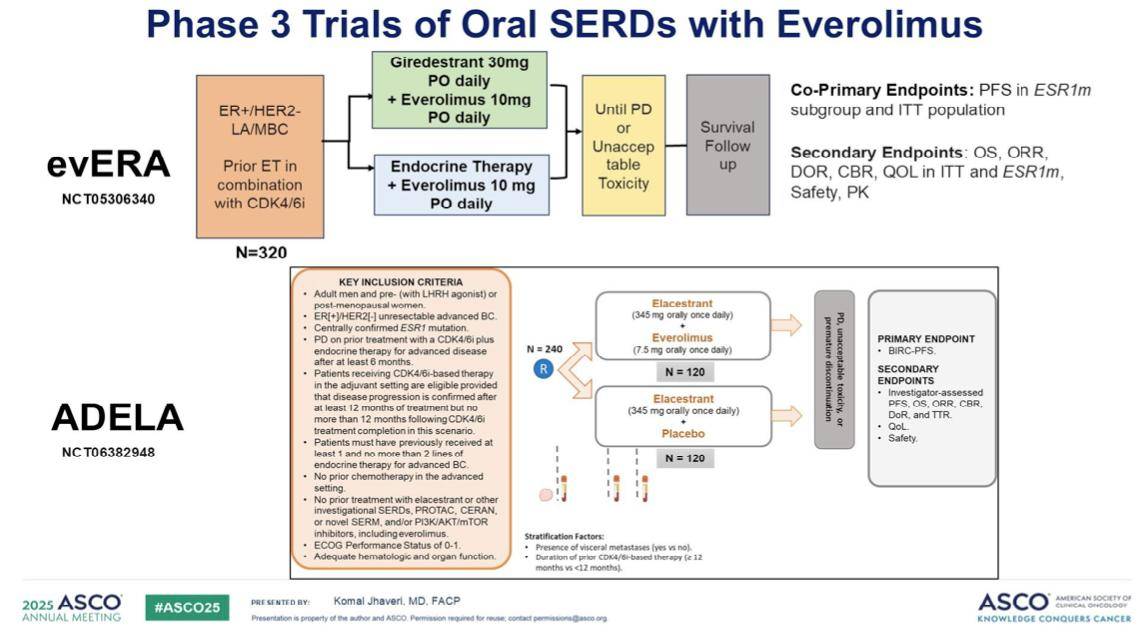
此外,我们正在进行evERA试验。我们希望在今年年底之前能够听到这项III期试验的结果,该试验正在评估Giredestrant口服药联合依维莫司与医生选择的方案的疗效对比。
同样, ADELA是一项有趣的研究,主要在欧洲和巴西境开展。这是在研究 ESR1 阳性突变肿瘤中艾拉司群联合依维莫司与艾拉司群单药的对比。
接下来,我们将探讨新一代PI3K抑制剂。我们熟知阿培利司,以及来自SOLAR-1等关键研究的数据。尽管这些药物为治疗带来了希望,但其毒性,如高血糖、腹泻和皮疹等,一直是临床上面临的挑战。这些不良反应通常被认为是PI3K野生型抑制所导致的脱靶效应。因此,在抑制突变型PI3K的同时,我们也在抑制导致这些毒性的野生型PI3K。
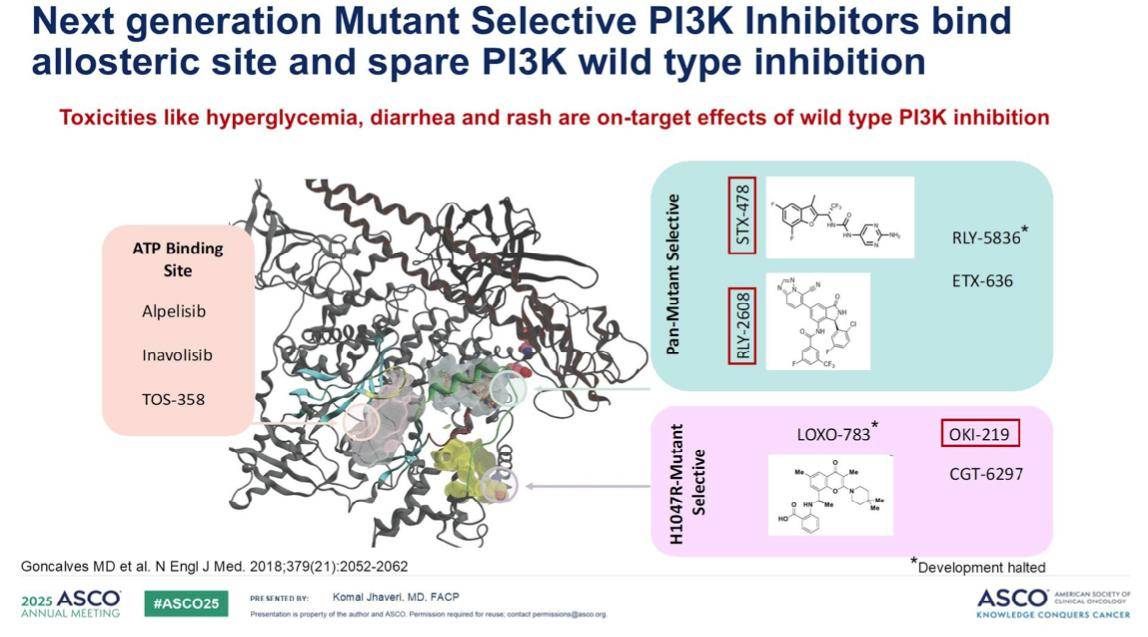
这正是我们对下一代突变选择性抑制剂寄予厚望的原因。这类药物的前景在于,它们能够通过结合变构位点来选择性抑制突变型PI3K,从而有效避免对野生型PI3K的抑制,减轻或消除由其引起的毒性。
在此背景下,我们将重点关注几种主要的在研药物:
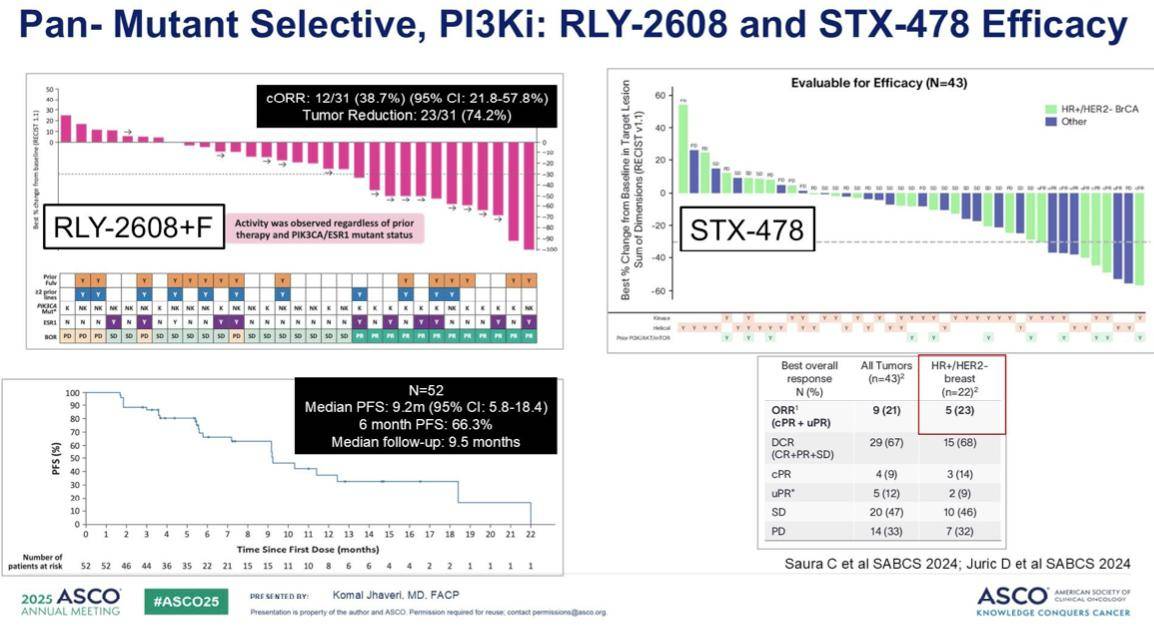
RLY-2608:在RLY-2608联合氟维司群的一期临床试验中,我们看到了令人振奋的结果。该研究的总缓解率(ORR)达到38%,中位无进展生存期(PFS)为9.2个月。
STX-478:作为单药治疗,STX-478在一项针对PIK3CA突变阳性乳腺癌患者的临床试验中,取得了23%的总缓解率。
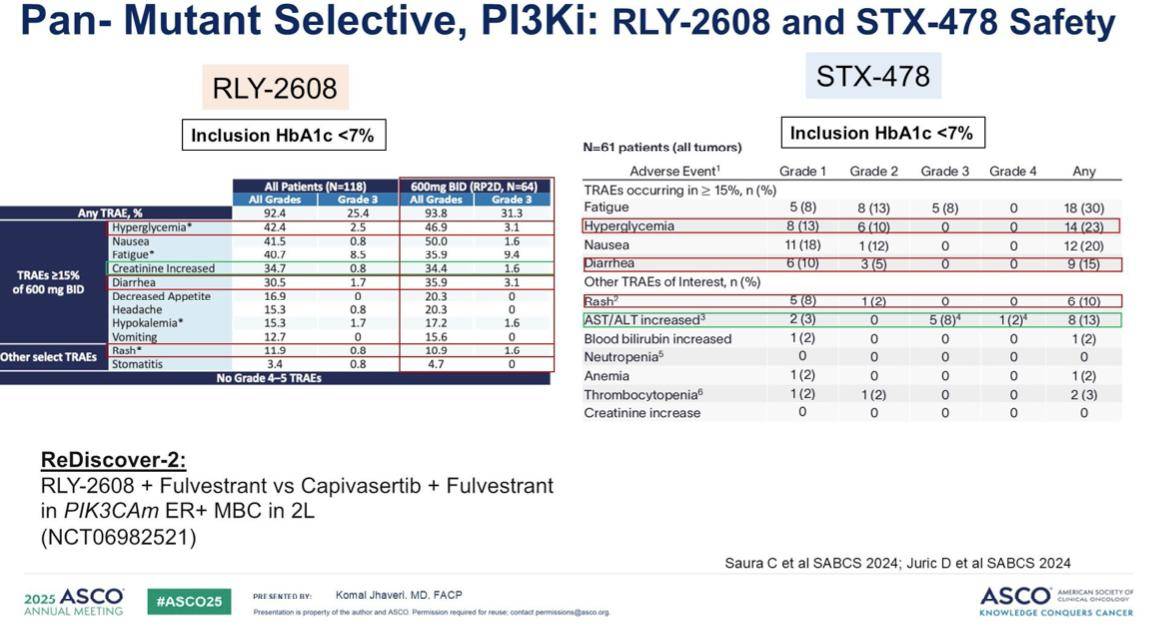
更重要的是,这些新药旨在改善毒性。回顾这两项试验的数据,我们发现与目前已获批的药物相比,3级或4级的高血糖、腹泻和皮疹的发生率显著降低。尽管这些研究规模较小,但其结果与我们对这类药物的预期相符,预示着PI3K抑制剂的未来发展方向正朝着更精准、更安全的方向迈进。
关于RLY-2608,一个值得关注的安全性信号是血肌酐水平升高,这在后续更大规模的数据集中需要持续监测。同样,对于STX-478,我们也观察到谷丙转氨酶(ALT)和谷草转氨酶(AST)水平的升高,对此我们将进行密切关注。目前,RLY-2608正进入ReDiscover-2这项注册性III期临床试验阶段,该试验将RLY-2608联合氟维司群与依维莫司联合氟维司群进行头对头比较,旨在评估其在PIK3CA突变肿瘤中的疗效。
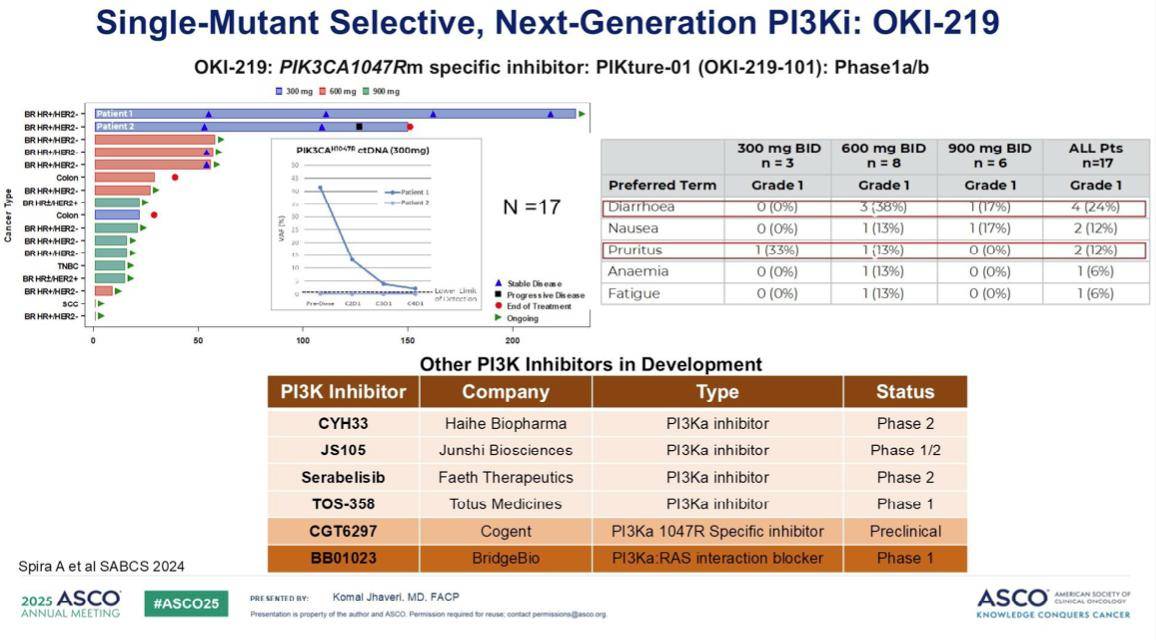
此外,我们还看到了针对1047R突变特异性PI3K抑制剂的早期I期临床数据,以及其他多种在研的PI3K抑制剂,这些新药有望在未来改变我们的治疗格局。

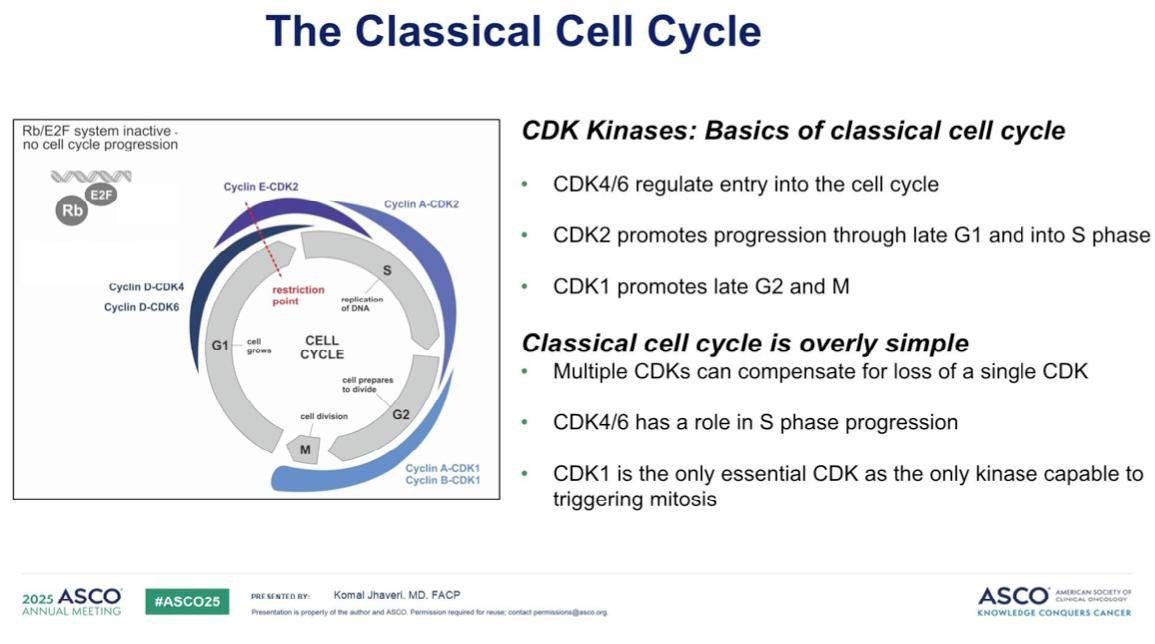
接下来,我们来讨论选择性细胞周期抑制剂。首先回顾经典的细胞周期:CDK4/6调节细胞进入细胞周期,CDK2促进细胞从G1期进入S期,而CDK1则驱动细胞从G2期进入M期。然而,细胞周期的调控并非完全简单,因为多个CDK之间存在代偿机制,一个CDK的缺失可由其他CDK弥补。在细胞周期中,CDK4/6发挥作用于S期,而CDK1是唯一能够触发有丝分裂的必需CDK。
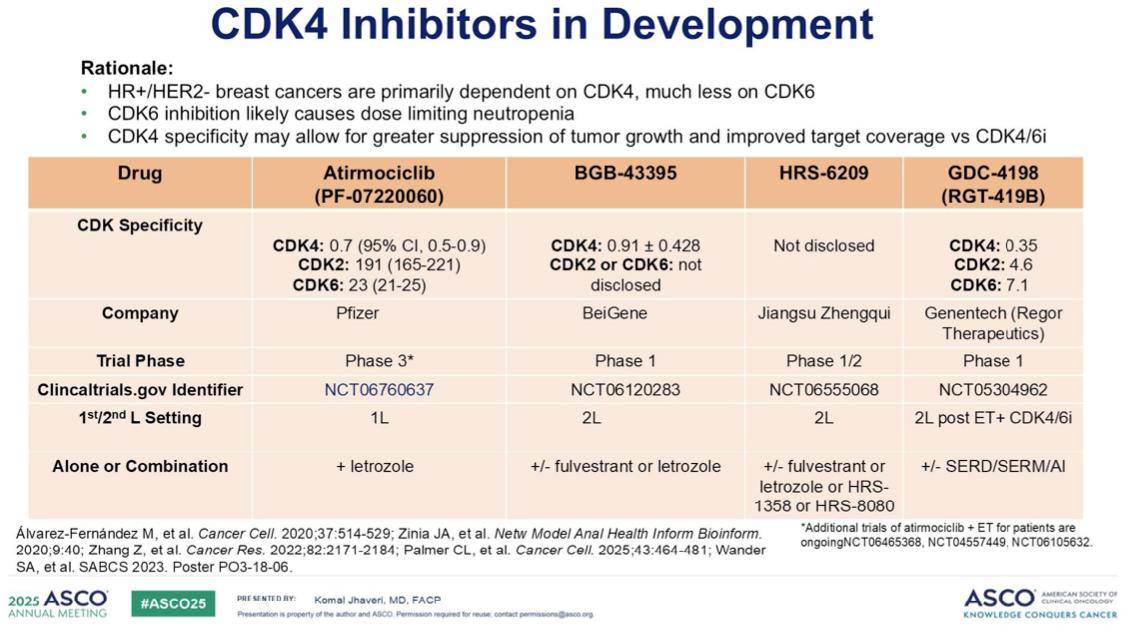
那么,为何我们需要开发选择性细胞周期抑制剂,特别是CDK4特异性抑制剂呢?在激素受体阳性(HR+)乳腺癌中,肿瘤细胞主要依赖于CDK4,而对CDK6的依赖程度相对较低。目前,CDK4/6抑制剂所引起的中性粒细胞减少症这一主要毒性,通常被认为是CDK6抑制所导致的。因此,与CDK4/6抑制剂相比,CDK4特异性抑制剂有望在有效抑制肿瘤生长的同时,减少因CDK6抑制带来的毒性,从而提高靶点覆盖率和安全性。目前,如表格所示,有多种CDK4选择性抑制剂正在开发中,它们的出现为乳腺癌的精准治疗提供了新的方向。
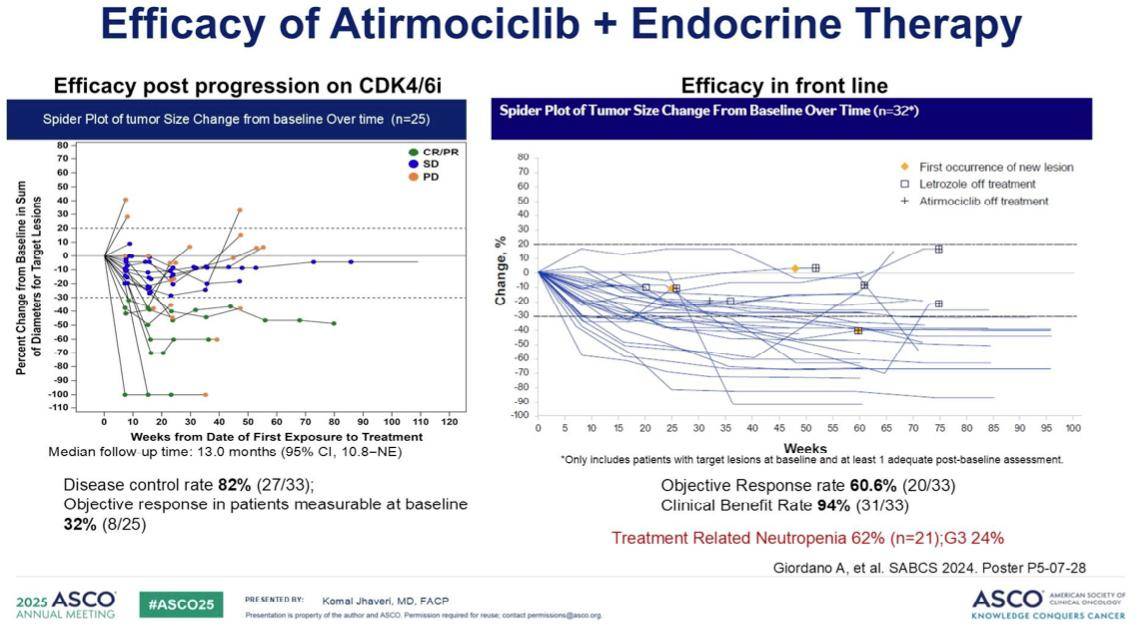
Atirmociclib在一项针对接受CDK4/6抑制剂治疗后病情进展的患者的临床研究中,我们观察到了令人鼓舞的数据:疾病控制率达到了82%,总缓解率(ORR)超过30%。在一线治疗中,Mosaciclib联合来曲唑同样展现了极具吸引力的总缓解率。尽管中性粒细胞减少症的发生率并非为零,但其3级及以上中性粒细胞减少症的发生率为24%,这一数据明显低于当前的CDK4/6抑制剂。目前,相关的多项临床试验正在进行中。
左边是FourLight-1 II期试验,研究对象是接受CDK4/6抑制剂治疗后病情进展的患者;右边为FourLight-3 III期试验,旨在将CDK4抑制剂与来曲唑联合用于一线治疗,并与标准的CDK4/6抑制剂进行头对头比较。然而,我们不能简单地认为CDK4抑制剂就是唯一的解决方案。有观点指出,如果仅针对CDK4进行抑制,可能出现的耐药机制是CDK6的过度表达。因此,尽管这些试验数据令人振奋,我们仍需警惕这种潜在的耐药机制,并认识到这些新药可能不是解决所有问题的唯一途径。

接下来我们讨论CDK2抑制剂。CCNE1基因扩增与高水平的细胞周期蛋白E1相关,这会导致细胞对CDK2产生依赖性,并与疾病的早期进展和治疗效果不佳有关。这被认为是CDK4/6抑制剂耐药的关键获得性机制之一。
事实上,PALOMA - 3的分析表明,细胞周期蛋白E1表达水平较低的患者使用哌柏西利和氟维司群治疗获益更大。来自纪念斯隆-凯特琳癌症中心(MSKCC)的Dr. Celeste Chang Lerapetyan补充数据也证实,P53通路改变与一线使用CDK4/6抑制剂时缺乏长期应答相关。这些数据(包括来自MONALEESA等试验的数据)显示,部分患者无法获得长期疗效可能与P53突变有关。在激素受体阳性乳腺癌患者中,P53突变的发生率可能高达27%至30%。

在这种背景下,CDK2抑制剂有望为这类特定患者带来长期的应答。一项针对CDK2抑制剂和CDK4/6抑制剂耐药人群的I期临床试验已将II期推荐剂量确定为每日两次300毫克。该药物展现出一定的抗肿瘤活性,但同时也观察到一些毒性,主要为胃肠道反应,并伴有或不伴有贫血。
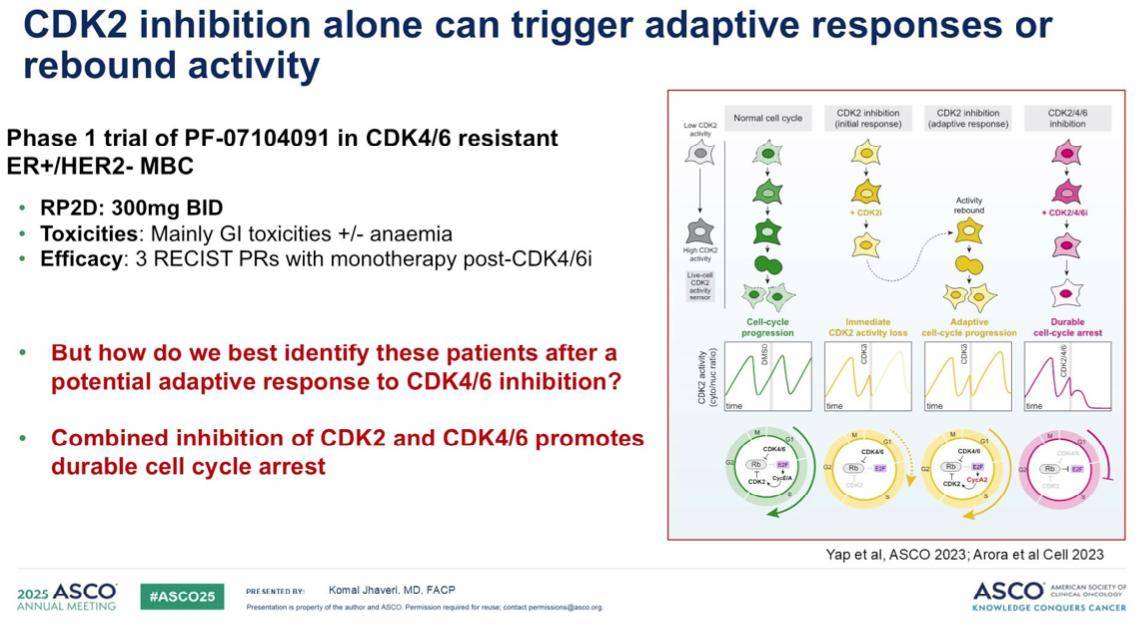
然而,一个关键的挑战是如何精准地识别最有可能从CDK2抑制剂中获益的CDK4/6抑制剂耐药患者。此外,现有数据表明,联合抑制可能更有利于实现持久的细胞周期阻滞,因为单独使用CDK2抑制剂可能触发一种适应性反应或“反弹”活性。因此,未来的治疗方案可能需要联合用药。目前,多种CDK2抑制剂及其联合用药方案正在临床研究中,我们期待最终结果能够为未来的治疗提供更多选择。
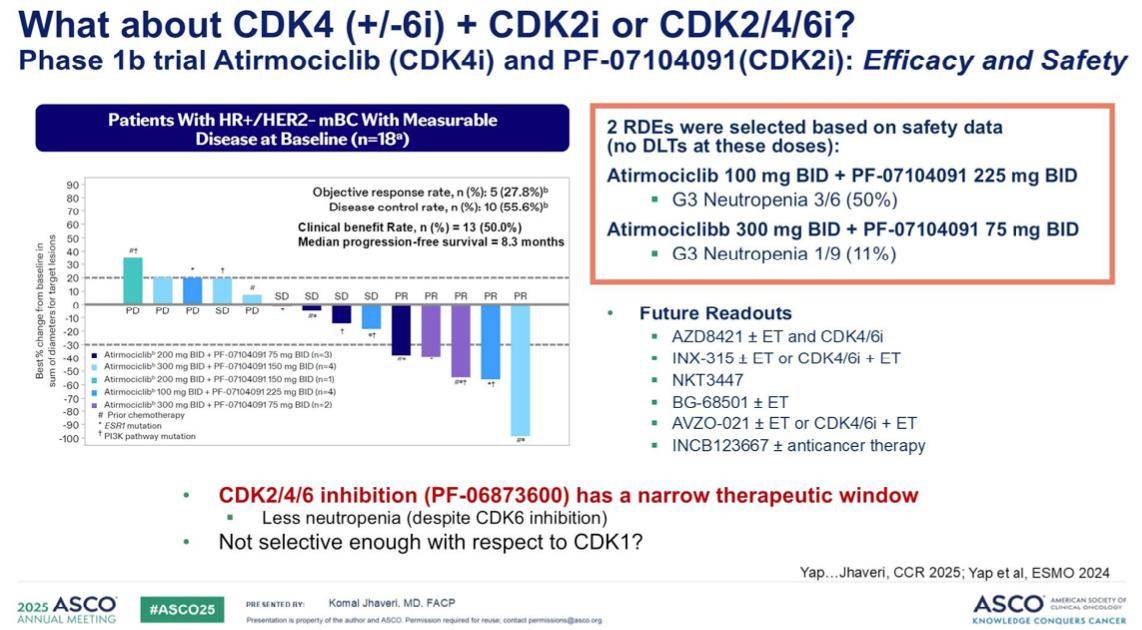
目前,一项针对Atirmociclib联合CDK2抑制剂的研究正在进行中,并已确定了两种推荐的扩展剂量。值得注意的是,虽然单药治疗的推荐剂量是每种药物每日两次,每次300毫克,但在联合用药方案中,两种药物的剂量并未简单地维持在300毫克,这提示我们在评估这类联合疗法时需特别留意剂量调整。未来,我们期待看到更多此类联合疗法的临床数据公布。
我们也曾尝试探索CDK2/4/6三重抑制剂。然而,遗憾的是,这类化合物的治疗窗非常狭窄。尽管在抑制CDK6后,我们观察到了中性粒细胞减少的发生率有所降低,但仍未能找到一个最佳的治疗方案。这表明在开发更广谱的CDK抑制剂方面,仍然有大量工作需要完成。

最后,我们来探讨新兴的KAT6抑制剂。染色质重塑是一种靶向雌激素受体(ER)的新方法。此前,研究者曾尝试使用组蛋白去乙酰化酶(HDAC)抑制剂,但并未观察到显著的临床获益。那么,KAT6抑制剂为何如此引人关注?
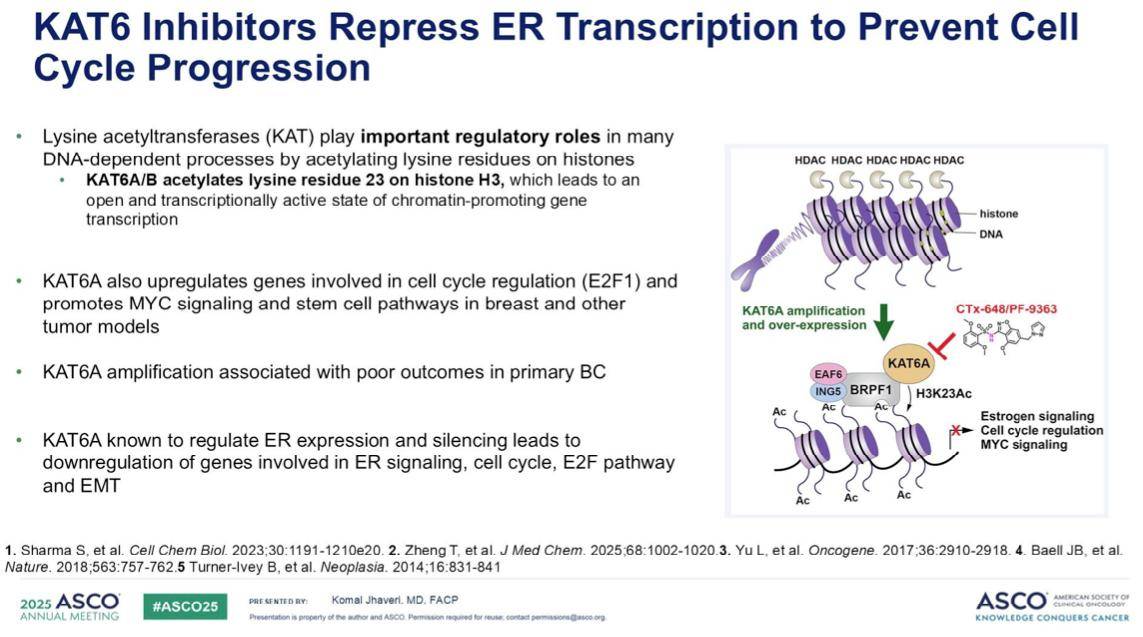
KAT6(赖氨酸乙酰转移酶)通过乙酰化组蛋白上的赖氨酸残基,在多种DNA依赖性过程中发挥着关键的调控作用。特别是KAT6A/B能够乙酰化组蛋白H3第23位的赖氨酸残基,从而使染色质处于“开放”和“转录活跃”的状态,促进基因转录。KAT6A还会上调E2F1等参与细胞周期调控的基因,并在乳腺癌等肿瘤模型中促进MYC信号传导和干细胞通路。有研究表明,KAT6的过度表达与原发性乳腺癌的不良预后相关。此外,KAT6A已知能调节ER的表达,其沉默可导致与ER信号传导、细胞周期、ER-依赖性通路以及上皮间质转化相关的基因表达下调。
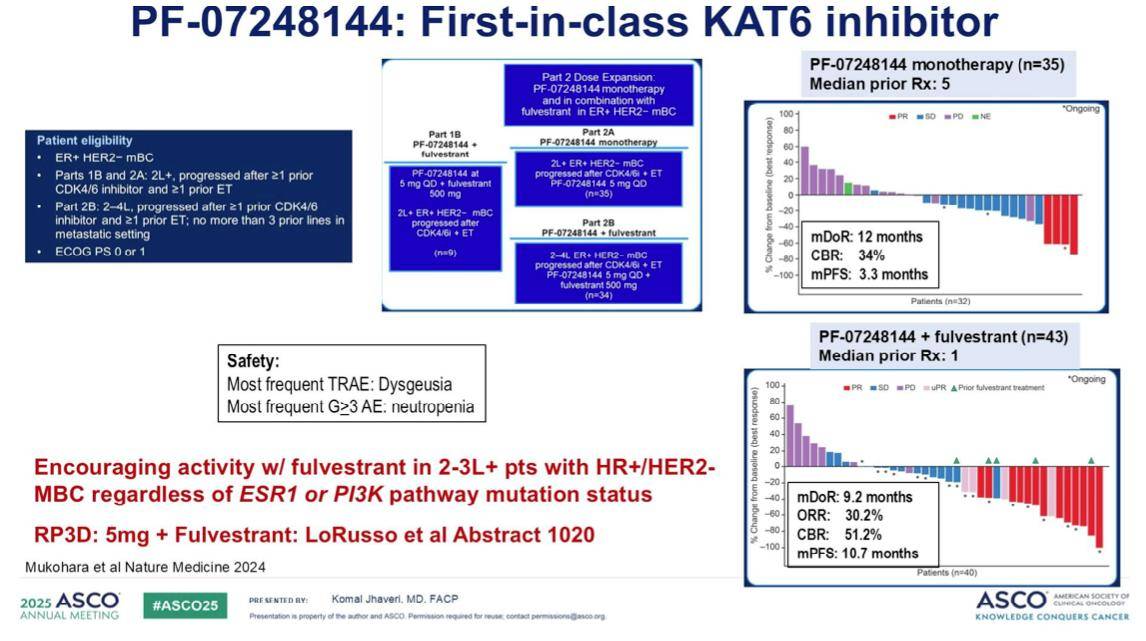
目前,领先的KAT6抑制剂是PF-07248144。在一项I期临床试验中,该药物作为单药治疗和与氟维司群联合治疗均显示出活性。在单药治疗中,尽管患者先前已接受过中位五线治疗,但我们观察到中位无进展生存期(PFS)为3.3个月。而在与氟维司群联合治疗且先前接受过中位一线治疗的患者中,PFS达到了10.7个月。
该药物的关键安全性信号包括味觉障碍以及值得我们密切关注的3级中性粒细胞减少症。这项试验的核心发现是,PF-07248144联合氟维司群在二线和三线治疗中表现出令人鼓舞的疗效,并且这种疗效不受ESR1和PIK3CA通路突变状态的影响,这正是其吸引人之处。
在该次会议上,Patel Narushe博士展示了相关摘要数据,旨在寻找该联合疗法的最佳剂量。研究评估了5mg和1mg剂量,最终确定5mg为推荐的III期剂量。事实上,根据该摘要,一项针对此联合疗法的III期临床试验正在计划中。此外,另外两种KAT6抑制剂也已进入I期临床试验,我们同样期待其结果。

综上所述,今日讨论的关键点在于,未来的治疗策略将不再局限于单一的新型内分泌药物,联合疗法将变得至关重要,并可能成为首选的治疗方案。我们希望突变选择性PIK3CA抑制剂能够降低毒性,并带来更好的疗效。CDK2抑制剂虽然单药治疗效果有限,但其联合疗法可能更具吸引力。KAT6抑制剂联合内分泌疗法,无论在CDK4/6抑制剂治疗后患者的突变状态如何,都可能是一个重要的潜在治疗选择。

最后,我想强调,药物研发无疑是一场马拉松而非短跑,这是一段漫长的旅程。但我坚信,只要我们齐心协力,尽我们所能,最终一定能够实现一个没有癌症的世界。在此,我要感谢所有患者、他们的护理人员以及家人,是他们的勇气和支持激励着我们每天进行这些工作和研究。
排版编辑:xiaodong











 苏公网安备32059002004080号
苏公网安备32059002004080号


