福建省抗癌协会癌痛专业委员会和福建省抗癌协会中西医整合肿瘤专委会青年委员会主办的【十邑论坛】开播啦!论坛于每周二推出,带您用中文听原汁原味的2025年美国临床肿瘤学会(ASCO)研究。本期论坛聚焦2025 ASCO年会上HR+乳腺癌后线治疗相关研究。来自哈佛医学院麻省总医院的Seth A. Wander教授带来了题为“CDK4/6抑制剂治疗后:HR+转移性乳腺癌靶向治疗及内分泌联合治疗优化,及分子标志物的最新研究进展”的报告。【肿瘤资讯】特邀三明市第二医院杨兰芳教授进行深入解读。
三明市第二医院 肿瘤科 主治医师

利用分子标志物优化乳腺癌的靶向治疗与内分泌联合治疗是迈向个性化医疗和精准肿瘤学的重要一步。本次讨论将围绕以下关键议题展开:CDK4/6 抑制剂的耐药机制与临床对策、ESR1突变的靶向策略及PIK3CA 通路抑制剂在临床中的应用、复合突变(PIK3CA/ESR1)的应对,及二线 HR阳性/HER2阴性转移性乳腺癌的系统性治疗框架的构建。

本次讲座将得出一些关键结论,它们对临床实践具有重要指导意义:所有 ER+ /HER2-转移性乳腺癌患者均应接受ESR1基因检测。我们已拥有针对携带 ESR1突变患者的新型口服SERDs药物。目前已有多种针对PI3K通路靶点的新型药物可供临床使用,其应用均基于特定的基因变异。我们正迈向一个新时代,届时将能通过多基因标记和液体活检更精准地预测治疗反应。

乳腺癌个性化治疗的里程碑始于1977年他莫昔芬的诞生,CDK4/6抑制剂的突破更是极大地改变了临床格局。如今,随着分子诊断技术的进步,美国食品药品监督管理局(FDA)已批准了基于患者肿瘤特定基因组变异的转移性 HR+乳腺癌药物。今天的讨论将重点关注这些创新疗法。
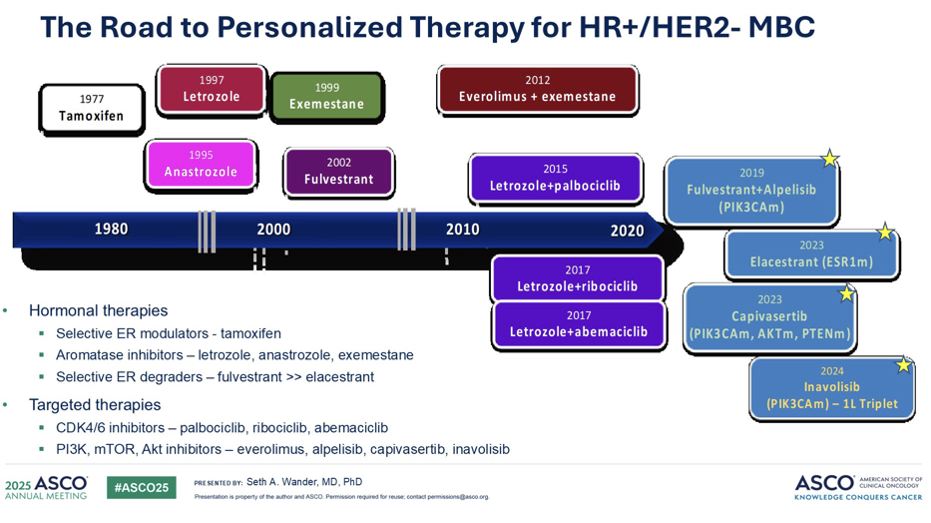
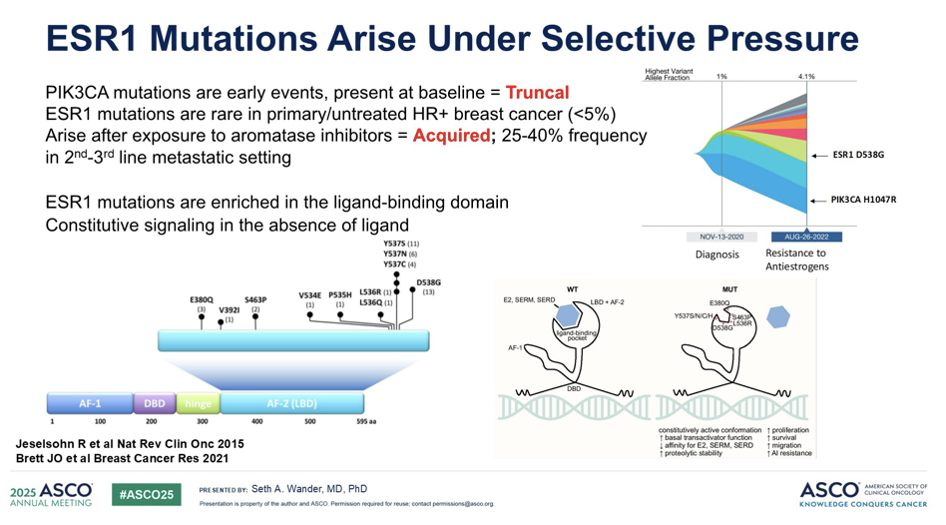
PIK3CA 突变作为乳腺癌的驱动突变,已被证实能从原发灶持续存在至转移灶,是贯穿治疗全程的关键靶点。ESR1突变是HR+乳腺癌治疗中重要的耐药机制。此类突变在未经治疗的乳腺癌中极为罕见,检出率通常低于5%。然而,在接受二线甚至三线治疗的患者中,ESR1突变检出率可显著增高至40%。
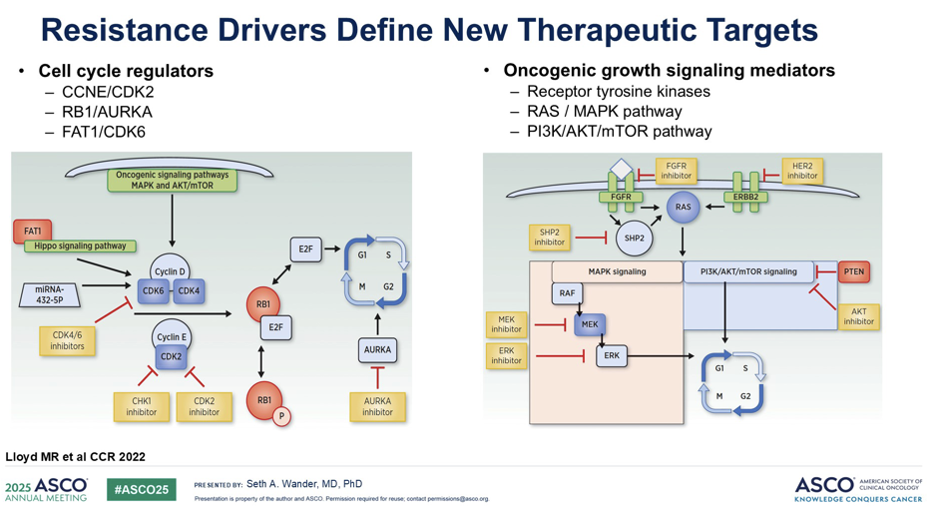
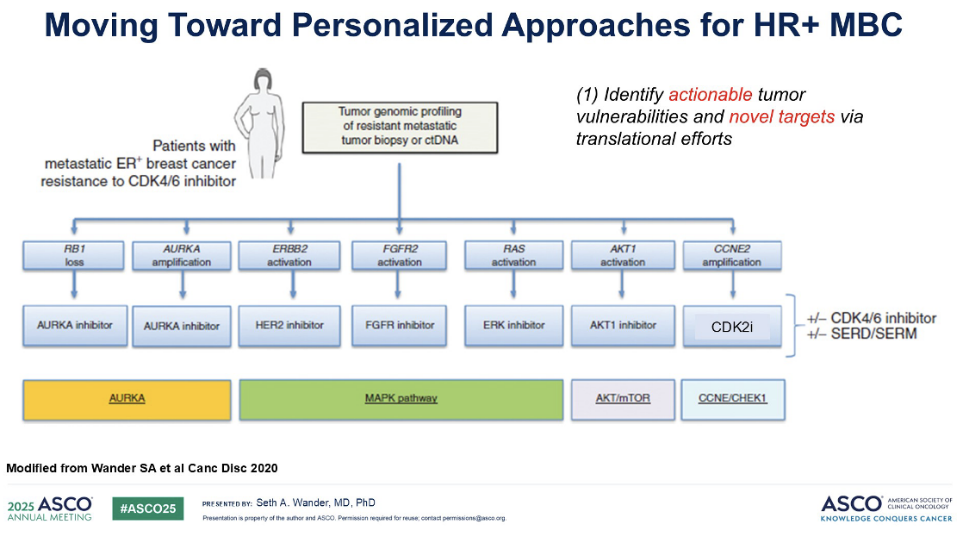
我们对 CDK4/6 抑制剂的耐药机制进行了系统性梳理。驱动耐药的基因变异可大致分为两大类:细胞周期调控失调和致癌信号通路激活。黄色区域清晰标注了当前临床可用药物(如 CDK 抑制剂)以及众多在研疗法的潜在干预窗口。
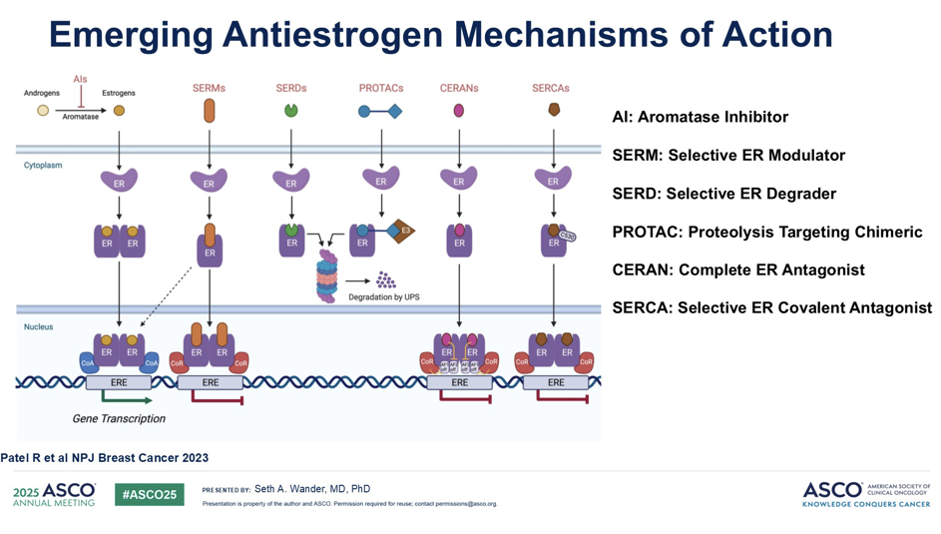
我们同样拥有许多不同种类的新型抗雌激素药物,它们可通过不同的机制发挥作用,如:芳香化酶抑制剂(AI)通过减少外周雌激素的转化与生成来发挥作用;选择性雌激素受体调节剂(SERM)通过竞争性地结合雌激素受体来发挥作用;而选择性雌激素受体降解剂(SERD)和蛋白水解靶向嵌合(PROTAC)则直接靶向雌激素受体,促进其降解。此外,我们还有一些较新的药物,例如完全雌激素受体拮抗剂(CERAN)和新型选择性雌激素受体共价拮抗剂(SERCA)。
接下来,让我们重点关注新型口服 SERD 的进展。艾拉司群关键III期EMERALD 研究中,受试者此前已接受过≥1线内分泌治疗(必须含CDK4/6抑制剂),其中部分患者接受过化疗(最多接受一线化疗),被随机分配至接受口服选择性雌激素受体降解剂(SERD)艾拉司群治疗或标准内分泌治疗。值得注意的是,这是一组接受过大量既往治疗的患者群体,其中超过20% 的患者曾接受化疗,超过 40% 的患者接受过两种内分泌治疗。
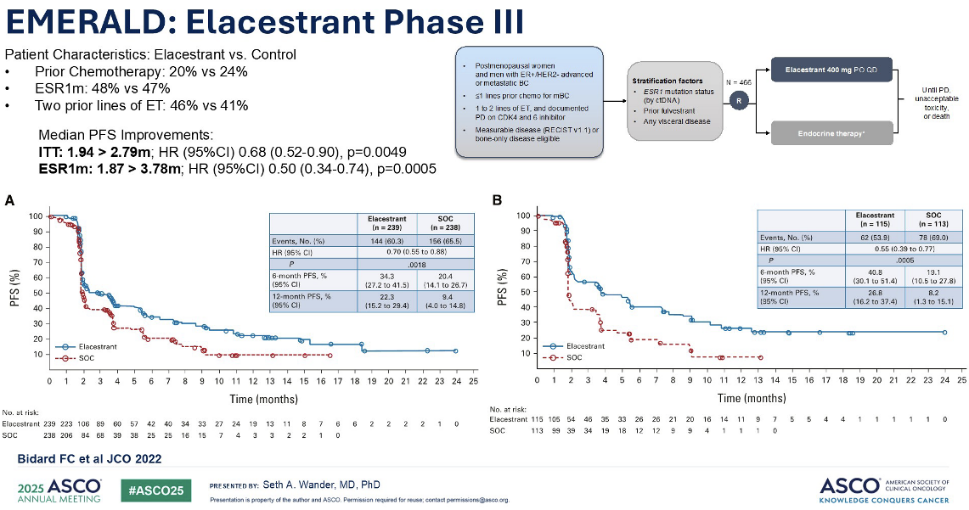
意向治疗(ITT)人群的主要终点曲线在初期呈现急剧下降,随后出现明显的分离和“拖尾效应”。这种模式在后续一系列不同的临床试验中也得到了验证,在二线和三线转移性乳腺癌患者中也可见到类似的治疗轨迹。在 ITT 人群中,艾拉司群的中位无进展生存期(PFS)仅从 1.94个月改善至约2.79个月。然而,当我们聚焦于 ESR1 突变患者时,则观察到了更为显著的临床获益,其中位 PFS 最长可达 3.78个月。
研究者进一步分析发现,如果将患者先前接受 CDK4/6 抑制剂治疗的获益持续时间也纳入考量,则获益更为显著。例如,对于至少接受过一年内分泌治疗的患者,携带 ESR1 突变者在使用艾拉司群单药治疗后,中位 PFS 可高达近 9 个月。
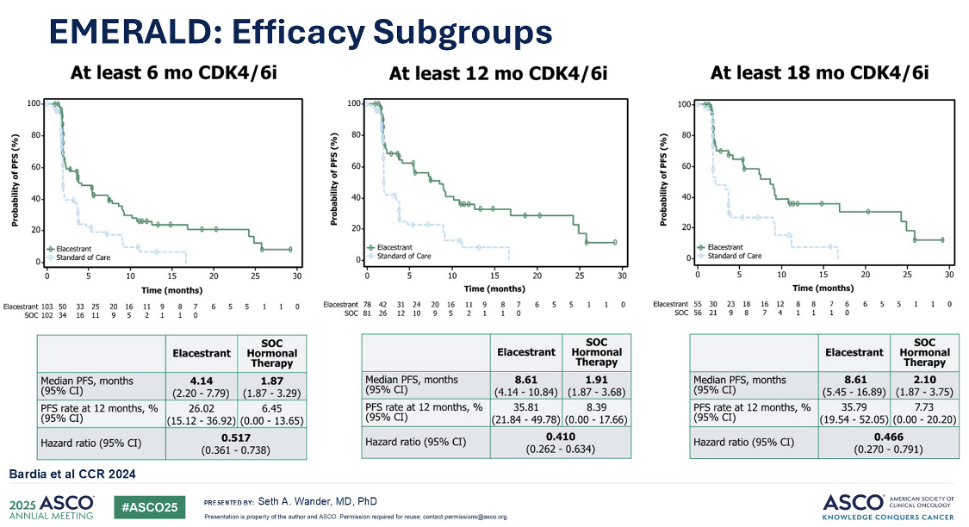
正因艾拉司群的优良表现,美国食品药品监督管理局(FDA)已批准其用于治疗携带 ESR1 突变且对内分泌治疗无效的转移性乳腺癌。在临床实践中,对于艾拉司群的使用,我们通常会优先选择那些曾接受过较长时间 CDK4/6 抑制剂治疗的患者。
接下来,我们将介绍 III 期 AMBRES-3 试验的最新数据,该研究评估了另一种新型口服 SERD 药物Imlunestrant(上市申报中)。这项研究的患者群体略有不同,他们仅接受过一线内分泌治疗,且未接受过化疗;此外,其中 40% 的患者未接受过 CDK4/6 抑制剂治疗。
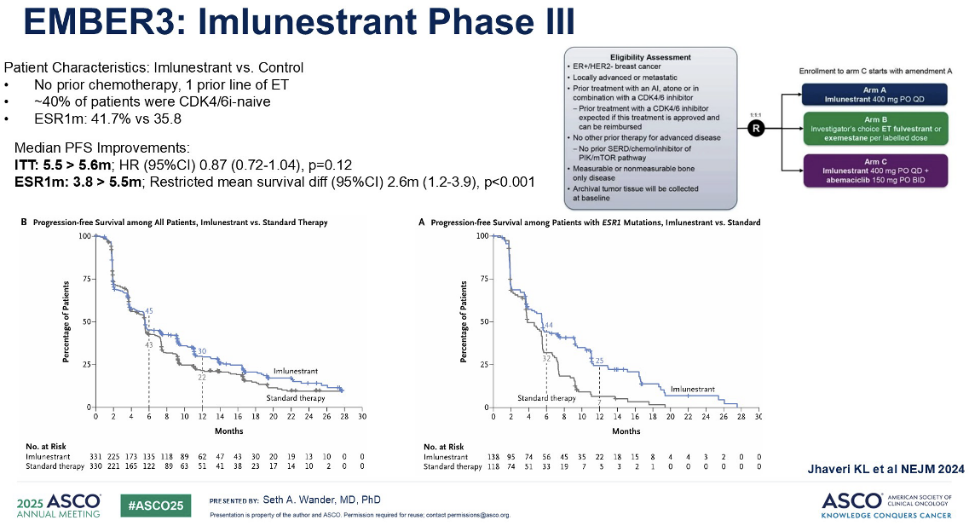
患者被随机分配至接受Imlunestrant或标准内分泌治疗。随后,研究人员增加了第三个治疗组:口服 SERD(Imlunestrant) 联合阿贝西利。再次审视PFS曲线的形状,我们发现其与 EMERALD 研究中观察到的模式非常相似。在ITT人群中未观察到显著获益,但在 ESR1 突变人群中,我们再次看到了显著的获益,中位 PFS 约3.8 ~5.5 个月。
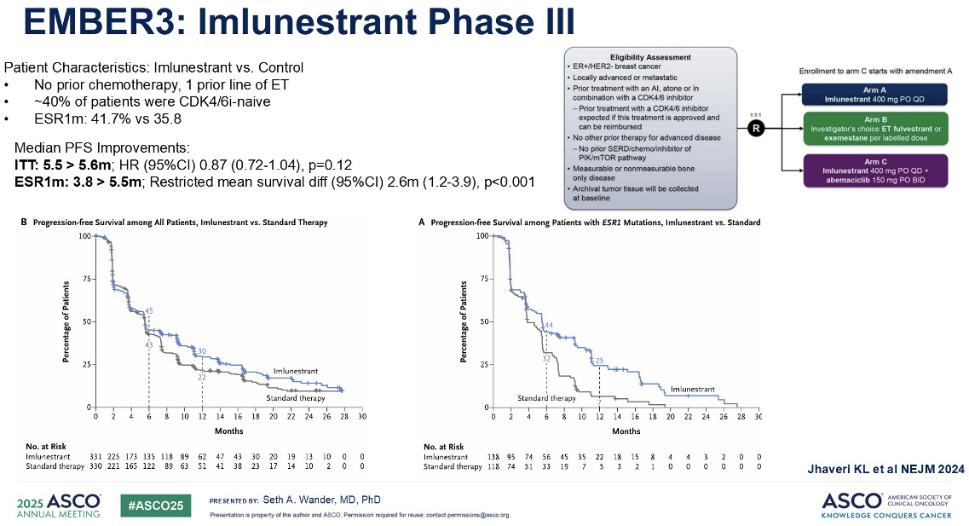
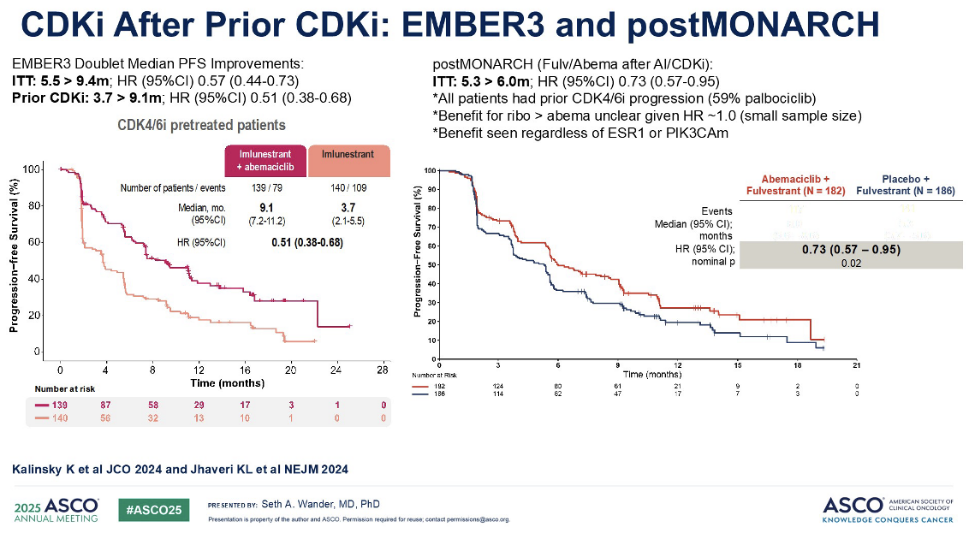
关于口服SERD与阿贝西利的双药治疗, AMBRES-3 研究患者数据提示,使用口服 SERD 联合阿贝西利双药治疗的患者,其中位 PFS 的获益可以超过 9 个月。我认为这在临床上具有非常重要的意义。这一结果与同期进行的postMONARCH研究结果相似,尽管其研究对象略有不同。postMONARCH研究的所有患者都曾接受 CDK4/6 抑制剂治疗,主要为哌柏西利。postMONARCH研究中,研究者评估了氟维司群与阿贝西利的双药治疗,其中位PFS为6个月。与口服 SERD 联合阿贝西利的9个月获益相比,同样具有不错的表现。
随着乳腺癌精准治疗的不断深入,我们迫切需要解决一个关键问题:这些新兴的二代口服抗雌激素药物如何有效地对抗特定的 ESR1 突变?同时,ESR1 突变负荷的动态变化能否为我们提供新的预后洞察?

我们已经开始看到一些引人注目的研究数据,这些数据正逐渐揭示出答案。在一项使用口服选择性雌激素受体降解剂(SERD)Imlunestrant的早期研究中,研究者观察了具有 ESR1 分子应答的患者。这里的“分子应答”被定义为在治疗第一周期第一天与第二周期第一天之间,血浆中 ESR1 突变等位基因比例下降超过 50%的情况。若下降幅度较小,则被视为缺乏分子应答。当我们依据这一指标对近 100 名患者进行分层时,结果显示,在Imlunestrant单药治疗后,患者的PFS存在显著差异,从不足 3 个月延长至近 9 个月。右侧图表进一步展示了Imlunestran对特定 ESR1 变体的影响。我们可以清楚地看到,几乎有四分之三的患者,其 ESR1 等位基因负荷有所下降,而等位基因负荷增加的患者实际上不到 20%。
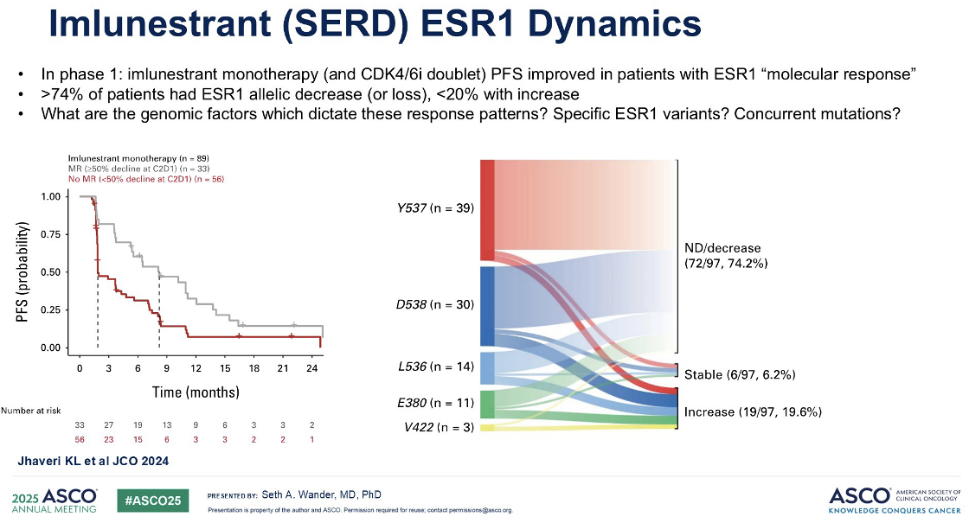
这些观察引出了一个更深层次的问题:究竟哪些基因型因素决定了这些独特的应答模式?这是否与特定的 ESR1 变体本身有关?或者,是否与图中未显示的并发变异有关?
来自 I 期 ELAINE-1研究的数据为此提供了极具启发性的线索。该研究评估了一种新型选择性雌激素受体调节剂(SERM)——拉索昔芬,其在 I 期临床中已表现出优于氟维司群的临床疗效。研究者观察了患者在接受氟维司群或拉索昔芬治疗后,等位基因分数下降的百分比。他们特别关注了每一种不同的 ESR1 变异,例如 D538G、Y537S 等。令人振奋的是,对于每一种 ESR1 变异,拉索昔芬都能够使等位基因分数大幅降低。
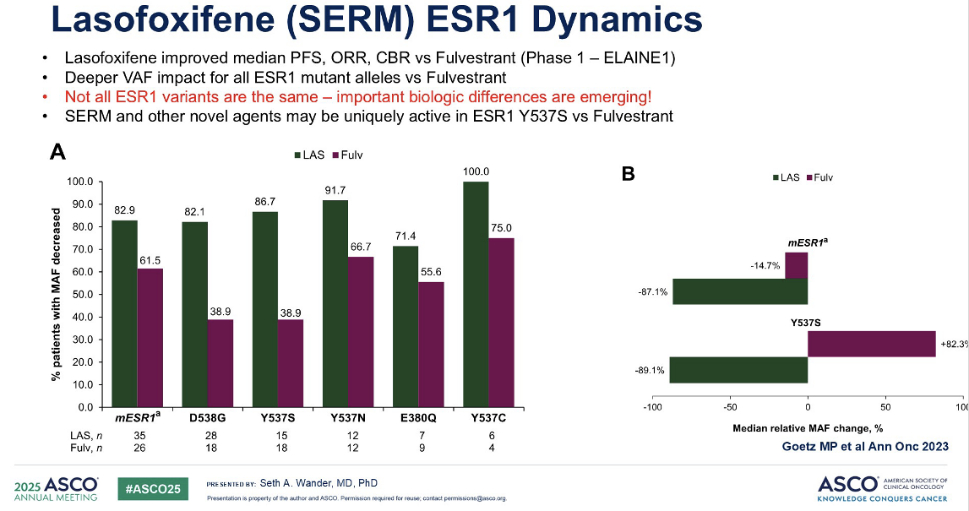
进一步观察整个队列的等位基因分数中位数变化,我们发现氟维司群的等位基因分数平均下降了约 15%,而拉索昔芬的等位基因分数下降幅度则接近 90%。尤其值得注意的是,对于 Y537S 变异——这是一种我们已知治疗难度略大的 ESR1 变异——我们发现氟维司群治疗后等位基因分数平均有所增加,而拉索昔芬则导致等位基因分数急剧下降。这清晰地表明,并非所有 ESR1 变异都具有相同的生物学特性,它们之间存在重要的生物学差异,这些差异可能影响治疗的应答模式。
现在,让我们转向 PI3K/AKT 通路靶向治疗的最新进展。在 SOLAR-1试验中,内分泌难治性患者被随机分配接受氟维司群单药治疗或氟维司群联合 PI3K 抑制剂阿培利司(Alpelisib)治疗。在携带 PIK3CA 突变的患者队列中,我们观察到显著的疗效差异:中位PFS分别从 5.7 个月延长至 11 个月。
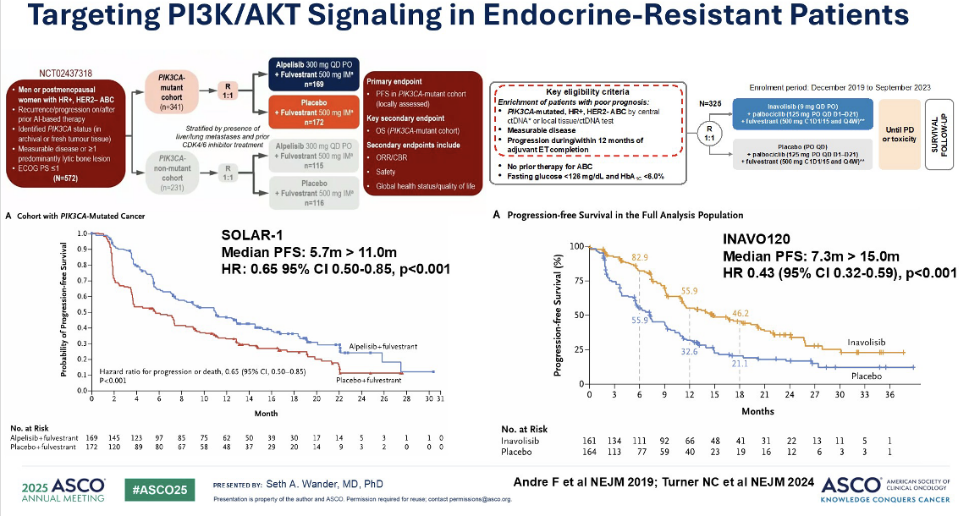
进一步来看INAVO-120 研究的最新数据。这项研究纳入的是具有 PIK3CA 突变的内分泌难治性患者,他们此前曾接受过辅助治疗。这些患者被随机分配至接受氟维司群联合哌柏西利治疗,或氟维司群联合帕哌柏西利以及伊那利塞治疗。目前,在一线转移性患者中,我们观察到显著的疗效提升,中位 PFS 从 7 个月显著提高到 15 个月。
CAPItello-291 试验的数据同样引人注目。该试验评估了首个获批用于二线转移性患者的 AKT 抑制剂——卡匹色替。值得一提的是,这项研究的患者大多数曾接受过 CDK4/6 抑制剂治疗,但并非所有患者都有此治疗史。患者被随机分配接受氟维司群单药或氟维司群联合 AKT 抑制剂卡匹色替治疗。我们发现,中位 PFS 从3.6个月改善至7 .2个月,风险比(HR)为 0.7。这项疗法目前已广泛应用于临床。
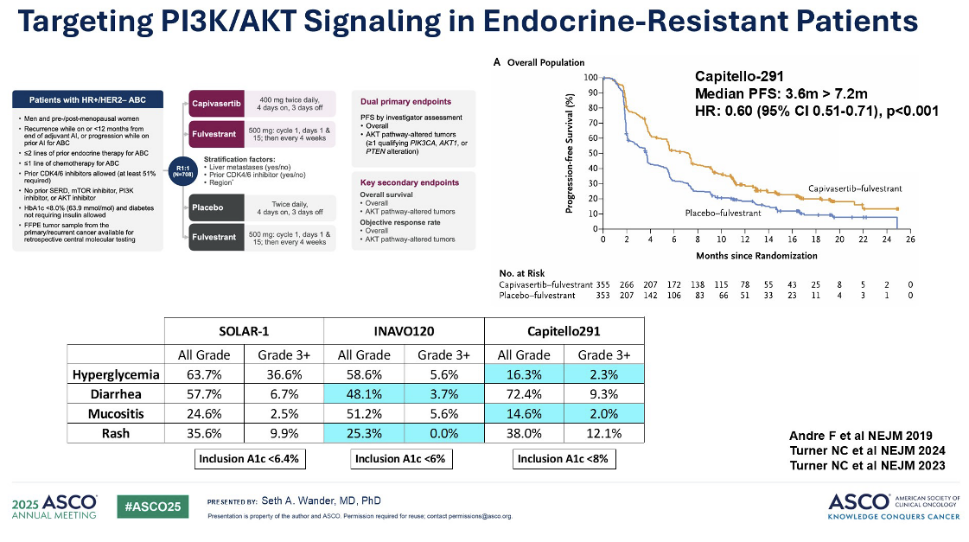
然而,我们也必须注意到伴随这些新药而来的重要毒性反应,例如高血糖、腹泻、结膜炎和皮疹。尽管随着这些新药的问世,我们开始看到3级毒性的发生率有所降低,但仍有改进的空间。
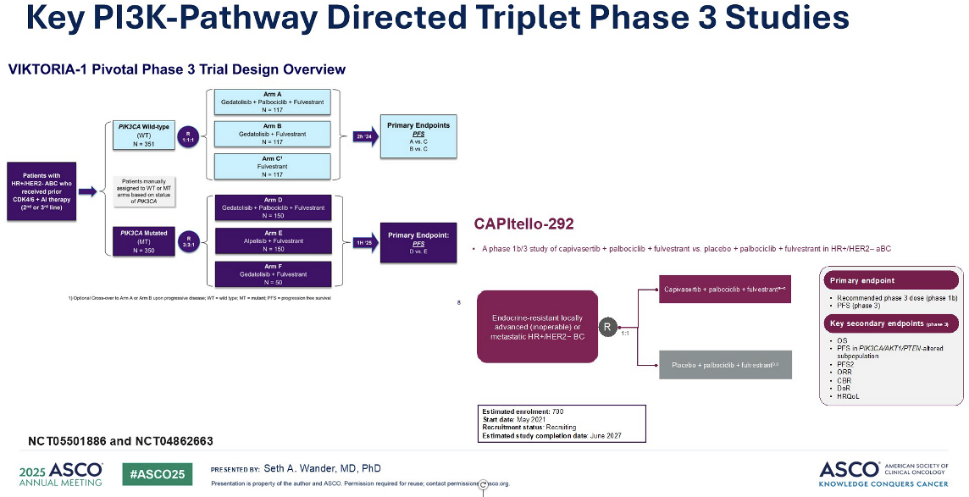
稍后,我将展示一些激动人心的研究成果,这些研究正致力于开发针对该通路且具有更高治疗窗的新一代药物。目前,一些关键的 III 期临床试验正在进行中,它们有望进一步拓展PI3K/AKT通路的治疗潜力。第一项研究是 VIKTORIA-1,该研究探讨了新一代PI3K抑制剂Gedatotisib的联合用药效果。另一项重要的研究是 CAPItello-292,它探讨了氟维司群与CDK4/6 抑制剂和卡匹色替的三联疗法,同样适用于内分泌难治性患者。这些研究有望在现有双药联合疗法的基础上发展出可能耐受性更好、疗效更优的三联疗法,我们将在后续进行更详细的介绍。
面对携带多个治疗靶点的患者,我们应如何制定有效的治疗策略?特别是,对于同时存在 PIK3CA 和 ESR1 突变的患者,我们是否有同时靶向这两种突变的治疗洞察?这无疑是当前临床研究中最为普遍的问题之一,也是肿瘤多学科讨论会和日常邮件咨询中频繁出现的话题。我们正逐渐积累相关数据。

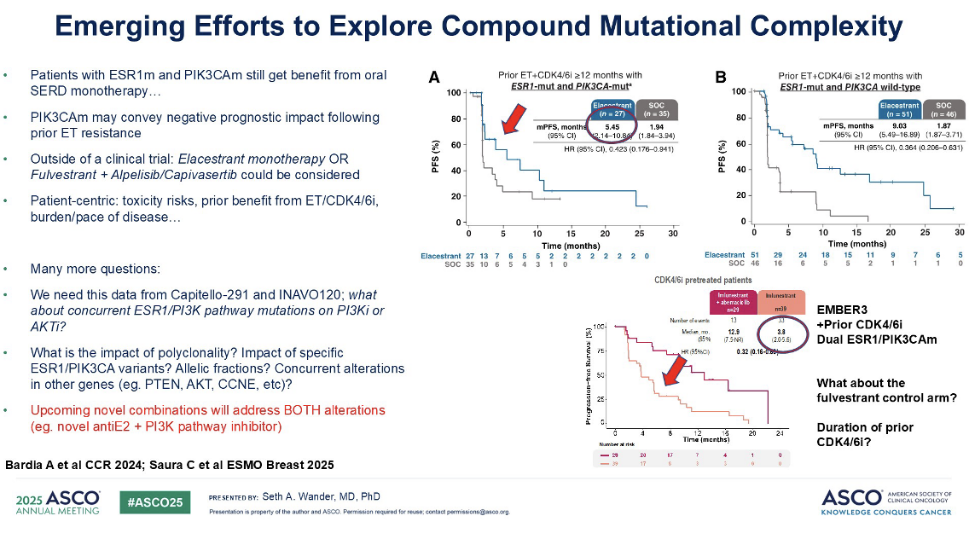
我们可以看到对于既往接受过至少 12 个月 CDK4/6 抑制剂治疗,同时存在 ESR1 和 PIK3CA 共突变的患者,接受艾拉司群治疗的效果。虽然艾拉司群的疗效依然优于氟维司群,但其获益可能不如 PIK3CAwt患者显著。在这种双突变情况下,艾拉司群的PFS大约在 5 到 6 个月左右,而非 PIK3CAwt患者中观察到的 9 个月以上。
我们刚刚也介绍了AMBER3 研究的最新数据。在同样接受过 CDK4/6 抑制剂治疗且同时存在 PIK3CA 和 ESR1 突变的患者中,口服 SERD 单药治疗的疗效约为 4 个月。而双药治疗(口服 SERD 联合阿贝西利)的效果同样显著优于氟维司群对照组。虽然目前尚不清楚氟维司群对照组的具体效果,以及患者既往 CDK4/6 抑制剂治疗的具体持续时间,但这些数据确实显示出,在这些双突变体患者中存在一定的治疗活性,其疗效可能介于 PIK3CAwt和非PIK3CAwt患者之间。
目前,除了参与临床试验,我认为对于同时存在这两种突变的患者,可行的治疗选择包括艾拉司群单药治疗,或者氟维司群联合 PI3K 抑制剂。这是一个高度以患者为中心的讨论过程,我们需要全面考量患者的毒性耐受性、既往 CDK4/6 抑制剂的使用持续时间以及疾病进展的速度。
此外,还有许多重要问题有待深入探讨。例如,INAVO-120 和 CAPItello-291 研究在同时存在 ESR1 和 PIK3CA 突变的患者中,PI3K 和 AKT 抑制剂的疗效如何?这些都是我们在未来研究中需要正视的关键问题。我们将呈现一些令人期待的新型联合疗法,这些方案有望能同时解决 PIK3CA 和 ESR1 突变所带来的治疗挑战,通过整合最佳的二代抗雌激素药物和二代 PI3K/AKT 抑制剂,再次为这类患者群体带来显著的临床获益。
我们应如何继续推进并兑现个性化医疗的承诺?首先,这需要我们通过转化医学研究来识别具有临床干预价值的肿瘤弱点和新的靶点。以 CDK4/6 抑制剂耐药机制为例,这份示意图清晰展示了所有潜在的耐药机制,每一个机制都有可能成为新药开发的靶点。基于这些特定的分子改变,我们需要精心设计并开展相应的临床试验。
让我们将视角进一步放大,思考生存曲线的形状,以及我们如何能够预判患者在这条曲线上的位置。关键在于通过多组学技术,深入解析雌激素受体(ER)的依赖性。我们预测会有一部分患者病情进展迅速,这表明他们实际上可能不完全依赖于 ER 信号通路。对于这类患者,或许最适合的治疗方案是类似抗体药物偶联物(ADCs)。
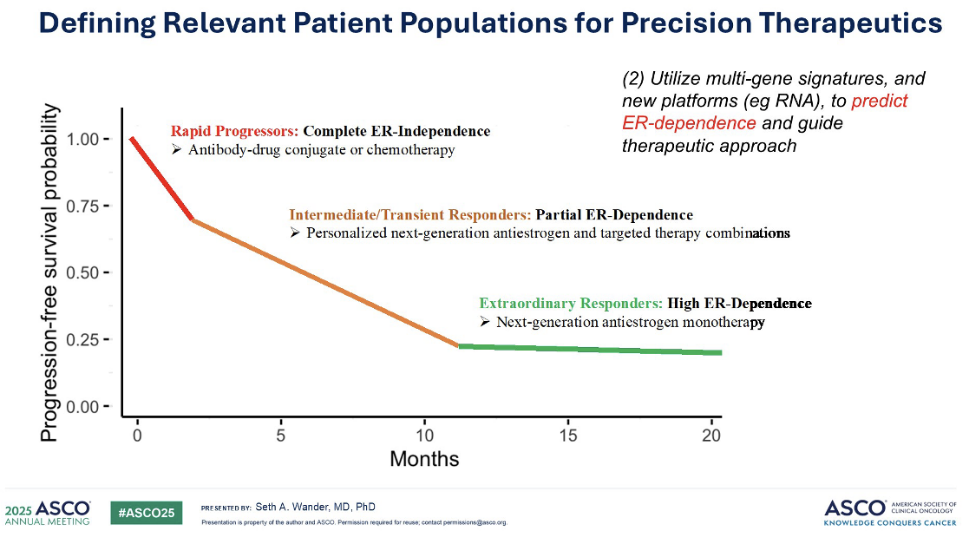
此外,我们还有一些患者表现出中度或短暂的响应,他们部分依赖于 ER 信号通路,但这并不足够。对于这部分患者,我们需要做得更好,这正是双药联合疗法甚至三联疗法发挥作用的地方。精准治疗将为他们带来巨大的改变。值得注意的是,也有一部分患者(约 10% 到 20%)在接受内分泌药物治疗后,能够持续多年并取得显著疗效。我们如何才能准确识别这些患者,从而避免他们承受双药联合化疗所带来的经济和实际毒性?
总而言之,抗雌激素治疗和 CDK4/6 抑制剂的耐药性是一个极其复杂的问题,其背后涉及的基因组图谱复杂多样。我们已有一些口服选择性雌激素受体降解剂(SERDs)对 ESR1 突变患者显示出良好的疗效。我们发现,动态循环肿瘤 DNA(ctDNA)检测能够为我们提供深入了解 ESR1 依赖性药物反应的宝贵信息。一些新的靶向药物正在进入临床实践,包括针对 PIK3CA 通路的药物。肿瘤的基因组复杂性将持续为治疗策略提供重要信息,尤其是在双突变体的治疗方面。
然而,在理解复杂的突变谱方面,仍有更多内容需要深入研究。目前,许多研究正在探索多基因 RNA 和表观遗传学特征。这些特征的解析将显著提高我们预测 ER 依赖性的能力,并在二线和三线治疗中促进更好的个性化治疗方案。当前正在进行的转化研究将继续指导药物的合理开发,并使我们能够解锁更多可行的靶点。我们对这项工作的进展充满期待。

排版编辑:xiaodong











 苏公网安备32059002004080号
苏公网安备32059002004080号


