乳腺癌是全球女性最常见的癌症类型,其发病率也居我国女性恶性肿瘤之首。HER2阳性乳腺癌恶性程度高,往往具有多个肿瘤不良预后特征,如更强的侵袭性、更多的淋巴结侵犯、更大的肿瘤负荷等[1]。抗HER2靶向治疗药物的问世标志着HER2阳性乳腺癌治疗的重要里程碑,其临床疗效已得到显著验证。新辅助治疗后病理完全缓解(pCR)是乳腺癌患者的重要预后指标[2,3],与无病生存(DFS)与总生存(OS)的改善相关[3,4]。研究提示,对于接受曲妥珠单抗的HER2阳性/HR阴性乳腺癌,与non-pCR相比,新辅助后pCR患者疾病复发或进展风险可降85%,死亡风险可降92%[5]。然而,即使实现pCR,患者仍具有一定复发风险。尤其是对于伴有高危复发风险因素(如淋巴结阳性、肿瘤较大等)的患者群体,高达约20%的患者或可在5年内出现疾病进展、复发或死亡[2]。为了进一步降低HER2阳性乳腺癌患者复发风险,奈拉替尼强化辅助治疗策略的价值日益凸显。
本文特别分享一例新辅助治疗后达到pCR的HER2阳性乳腺癌患者的治疗经历。该患者在接受6周期的TCbHP方案新辅助治疗后,进行了左乳腺癌改良根治术。术后病理结果显示pCR。为了进一步巩固治疗效果,防止疾病复发,在完成HP双靶辅助治疗联合辅助放疗后,临床继续采用奈拉替尼强化辅助治疗。目前,患者病情保持稳定,整体状况良好。
病例分享
华中科技大学同济医学院附属同济医院
乳腺妇瘤及淋巴系统肿瘤科
主要从事乳腺癌相关临床诊疗及科研工作
湖北省乳腺甲状腺学会乳腺癌精准治疗分会委员
主持一项省级课题,国家发明专利一项,参与多项国家自然科学基金,发表SCI数篇
病例介绍
患者:女,47岁。
主诉:确诊“左乳腺癌”1周。
家族史:无特殊。既往史:无特殊。个人史:无特殊。
现病史:患者2024年1月3日“发现左乳结节增大1月”在我院就诊。查体见:左乳外上象限可触及大小约6.5*3cm质硬肿物,边界欠清,活动度欠佳,局部皮肤无红肿、无破溃,无波动感,皮温不高,左侧腋窝可扪及一枚淋巴结肿大,约2*1.5cm,质硬,固定。右乳及右腋窝及双侧锁骨上淋巴结未触及肿大淋巴结。
辅助检查
实验室检查:血常规、血生化、乳腺肿瘤标志物未见明显异常。
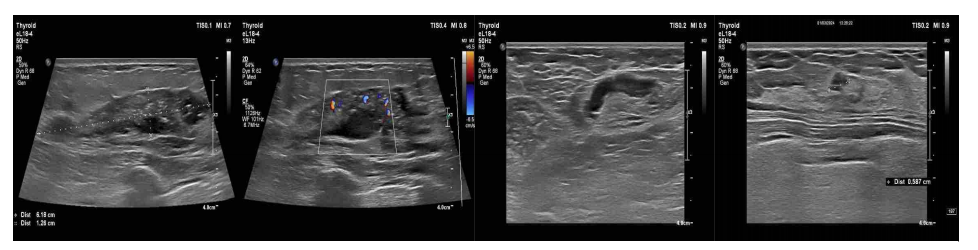
影像学检查:乳腺超声,示:1.左侧乳腺11-2点钟方向实质性病灶伴钙化(BI-RADS 4c类),大小约6.2*1.3cm。2.右侧乳腺实质性病灶(BI-RADS 3类)3.双侧乳腺增生4.左侧腋窝淋巴结增大。
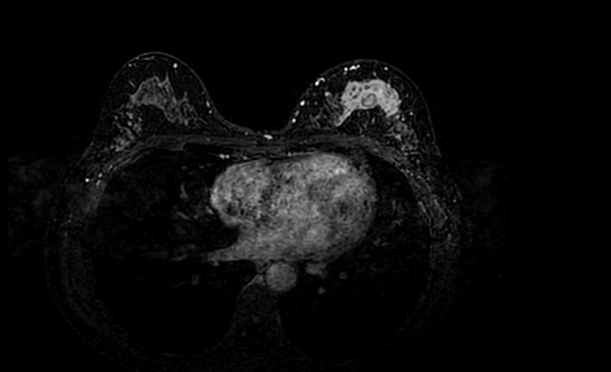
乳腺MR(2024-01-04)示:1.左侧乳腺中上部大片区域性分布的非肿块样异常强化灶,病区最大长径约62mm,前缘距乳头基底部约9mm,BI-RADS Category 5;2.余双侧乳腺散在多发结节状强化灶(约2-5mm),BI-RADS Category 2/3;3.左侧腋窝淋巴结稍增大(约12*8mm),请结合临床;4.双侧乳腺纤维腺体(FGT /c),伴轻-中度背景强化。
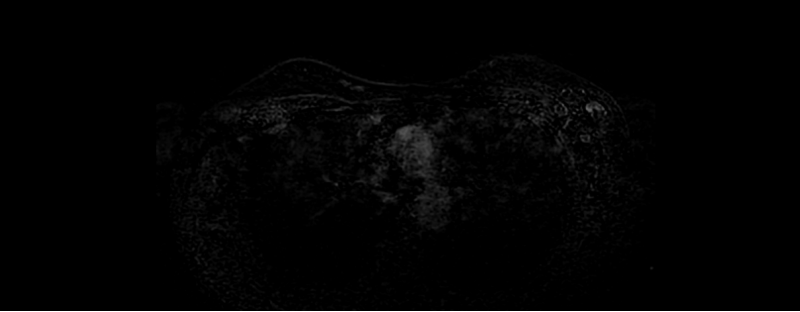
PET-CT示:1.左侧乳头后上方软组织密度增厚影,边界不清,代谢不均匀增高;左侧腋窝淋巴结增多,部分增大,代谢增高;以上考虑肿瘤性病变伴转移。2.左侧锁骨上、肠系膜及腹膜后淋巴结增多,代谢无明显增高,建议观察。3.扫描范围内骨髓轻度代谢增高;右侧头半棘肌局灶性代谢增高;以上请结合临床考虑。4.双侧外阴局部代谢增高影,建议必要时结合专科检查。盆腔少许积液。5.喉咽后壁代谢增高,考虑为炎性改变可能。双侧颌下淋巴结增多,部分左侧淋巴结代谢增高,建议观察。
病理检查:
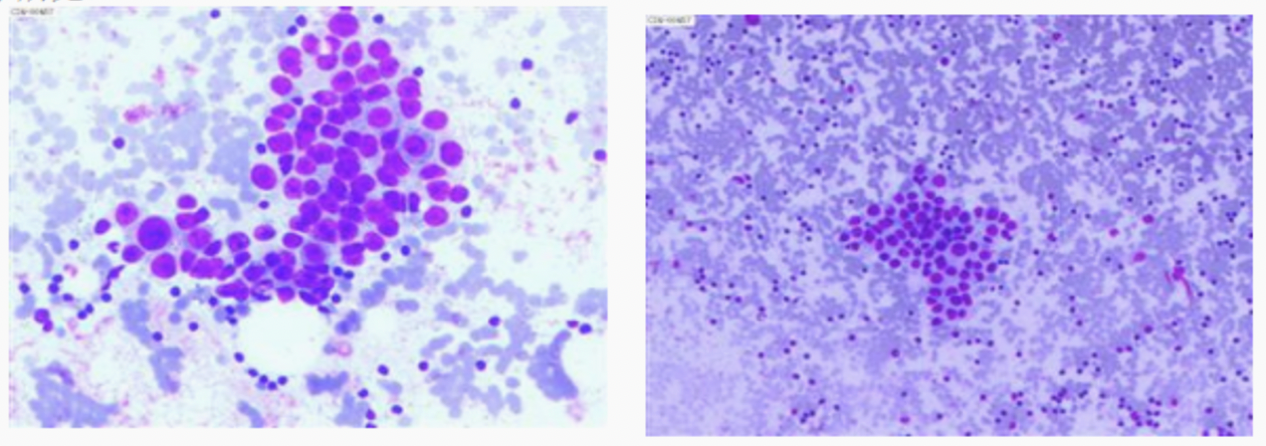
2024年1月5日行左乳空芯针活检,病理示:(左乳肿物空芯针活检组织)乳腺浸润性癌。免疫组化:CK7(+),GATA-3(+),E-Cadherin(+),P120(膜+),CK5/6(-),Calponin(-),P63(-),SOX10(-),SMA(-),CD10(-);AR(约70%中等-强+),ER(-,阳性对照+),PR(-,阳性对照+),Her-2(4B5)(3+,阳性对照+),P53(+,突变型可能),Ki-67(热点区LI约30%)。诊断意见:(左腋下)考虑淋巴结转移性腺Ca。
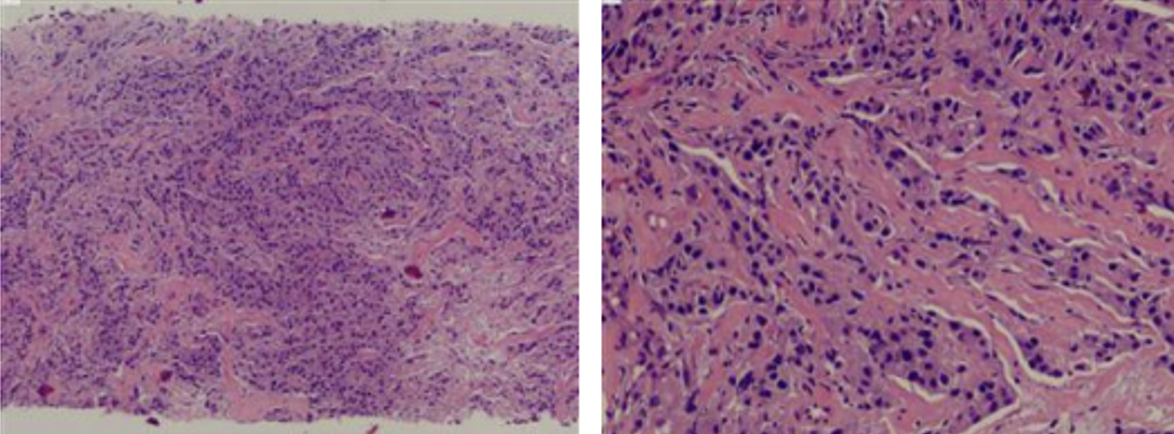
诊断:左乳浸润性癌cT3N1M0 ER(-)PR(-)Her2(3+)Ki-67 30%
治疗经过
新辅助治疗:
于2024.1.13-2024.5.4行1-6周期TCbHP方案新辅助治疗(多西他赛 75mg/m2 ivdrip d1;卡铂 AUC=6;帕妥珠单抗 首次840mg 维持420mg ivdrip d1;曲妥珠单抗 首次8mg/kg 维持6mg/kg ivdrip. d1, Q21d),期间患者治疗顺利,耐受性尚可。6周期新辅助治疗后复查乳腺MRI:1.左侧乳腺“原病变区域”未见明显异常强化灶,结合病史,考虑影像学完全缓解(iCR);2.双侧乳腺散在数个结节状强化灶(约2-3mm),较前变化不大,BI-RADS Category 2/3;3.双侧腋窝淋巴结未见明显肿大;4.双侧乳腺纤维腺体(FGT /c),伴轻度背景强化。
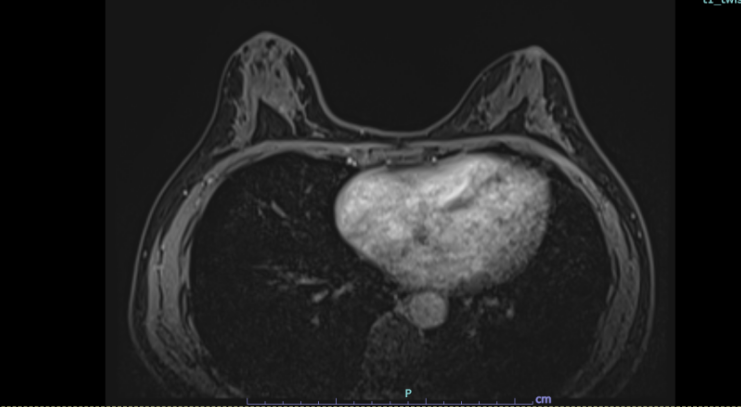
手术治疗:
于2024-5-16行全麻下行左侧乳腺改良根治术,术后常规病理结果(II24-34237):乳腺癌新辅助治疗后病理诊断报告:瘤床位置和大小:左侧,肿瘤或瘤床不明显,广泛取材制片;肿瘤组织学类型和分级:镜下均未见癌;肿瘤实质改变:不能判;肿瘤间质改变:纤维化、少量淋巴细胞浸润、散在少量泡沫细胞、散在少许钙化;乳头/皮肤/基底侵犯:均无;脉管侵犯:无;非肿瘤性乳腺组织:乳腺腺病伴纤维腺瘤样结节形成、终末导管小叶单位基底膜与小叶硬化;新辅助治疗反应的评估(Miller-Payne分级):G5:已无浸润癌细胞。(注:该系统将治疗后的手术标本与治疗前空芯针穿刺标本进行比较)淋巴结:"左侧腋窝"淋巴结13枚,其中1枚未见癌、见治疗后改变(纤维化、少量淋巴细胞浸润),余12枚未见癌、未见治疗后改变。
术后诊断:左乳癌ypT0N0M0
辅助治疗+强化辅助治疗:
2024.05.25-2025.1.11行HP双靶方案辅助治疗(帕妥珠单抗 420mg ivdrip d1;曲妥珠单抗 6mg/kg ivdrip. d1 Q21d),期间于2024-08-08至2024-09-11行胸壁调强放疗(Dt PCTV(胸壁+锁腋+内乳) 5000cGy/25F),过程尚顺利。
2025.2.1开始行奈拉替尼强化辅助治疗至今,采用剂量递增方案,具体用药剂量为:第1周,120mg(3片)/d;第2周,160mg(4片)/d;第3周起,240mg(6片)/d。期间出现腹泻反应,予以洛哌丁胺、益生菌等药物对症处理后可耐受。
专家点评
华中科技大学同济医学院附属同济医院综合肿瘤科主任
中国抗癌协会乳腺癌专业委员会委员
长江学术带乳腺联盟副主委
中国初级卫生保健基金会乳腺肿瘤专委会副主任委员
中国生物医学工程学会肿瘤靶向专业委员会委员
湖北省抗癌协会肿瘤内科治疗专业委员会常委
湖北省抗癌协会肿瘤营养与代谢专业委员会常委
武汉市医学会肿瘤专业委员会常委兼秘书
武汉医学会肿瘤学分会青年委员会主任委员
主持国家自然科学基金两项,发表论文20余篇
突破pCR,HER2阳性乳腺癌复发风险的再审视
HER2阳性乳腺癌约占全部乳腺癌的20%~25%,该类型乳腺癌侵袭性较高,预后差[1]。随着曲妥珠单抗、帕妥珠单抗等抗HER2治疗药物的研发与应用,HER2阳性乳腺癌的预后得以显著改善[6]。如,曲妥珠单抗在新辅助治疗中应用的首次探索——NOAH 研究发现,与单用化疗相比,曲妥珠单抗联合化疗显著提高了HER2阳性乳腺癌患者的 pCR 率(43% vs. 22%,P<0.001) [7-8]。NeoSphere研究则在此基础上进一步证实了新辅助曲帕双靶相较于单靶带来的pCR 率的改善[9]。
多项研究表明,pCR患者较非pCR者拥有更长的无病生存期(DFS)和总生存期(OS)[3,4]。然而,高达20%的pCR患者最终会出现疾病复发[3],尤其是对于合并高危复发风险因素的患者。因此,为了进一步降低HER2阳性乳腺癌复发风险,对复发风险因素的识别至关重要。
超越pCR,HER2阳性乳腺癌复发风险逐一剖析
总的来说,对于新辅助后pCR的患者,确诊时淋巴结转移[2,10]、肿瘤较大[2,10]、年轻[11]、组织学分级较高[10]、ER/PgR阴性[10],及淋巴血管侵犯(LVI)[10]等因素等均为患者非常重要的风险因素。下面将逐一进行介绍。
首先,淋巴结状态是评估HER2阳性早期乳腺癌患者术后复发风险的关键因素。根据《中国抗癌协会与中华医学会肿瘤学分会乳腺癌诊治指南与规范(2025 年)》(以下简称“CBCS指南”) [10],初始淋巴结阳性(任何pN+)都是高风险患者。荟萃分析提示,对于HER2阳性/HR阴性,伴初始淋巴结阳性的患者,即使新辅助治疗后达pCR同样面临较高复发风险[2]:该分析具体数据提示,初始淋巴结阴性(N-)/cT1-2患者的5年复发、转移或死亡风险为9.7%。而若为初始淋巴结阳性(N+),cT1-2患者群体的风险则上升至12.5%。
同时,该分析也提示,肿瘤负荷更高的患者复发风险相应也更高[2]——对于上述提到的同为N+的人群,若肿瘤大小上升至cT3-4,则患者的5年复发、转移或死亡风险进一步上升至17.6%[2](见下图)。
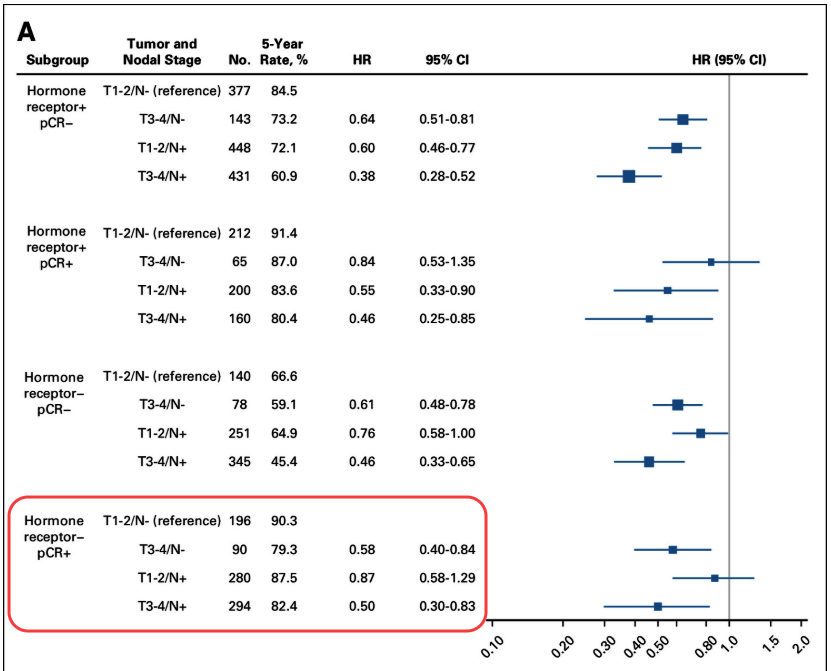 HER2阳性早期乳腺癌5年EFS率(根据激素受体和pCR状态评估)[2]
HER2阳性早期乳腺癌5年EFS率(根据激素受体和pCR状态评估)[2]
在淋巴结阴性的患者群体中,复发风险与肿瘤负荷的相关性同样也成立[12]。研究提示,初始肿瘤负荷≥T2(肿瘤最大径≥2cm)的患者,其复发风险显著高于T1患者[12](65个月的中位随访中,T2期BC的远处复发率为11.4%,而T1期BC的远处复发率为0%)[12]。对此,CBCS指南也同样予以认可,该指南提示,初始淋巴结阴性伴pT>2cm被视为患者中危复发因素[10]。
除了以上人群外,其他多种因素也与HER2阳性乳腺癌的复发风险密切相关,现有回顾性研究证据强有力地提示,以下均为乳腺癌复发风险增加的独立危险因素 [13-16]:
淋巴血管侵犯(LVI+)[13]:确诊的LVI与5年和10年随访中较差的乳腺癌特异性生存(BCSS)(HR 2.5,95%CI 2.1-2.9)和无远处转移生存(DMFS)(HR 2.6,95%CI 2.2-2.9)相关。
组织学分级≥2级[13]:为了确定组织学分级是否为BCSS和DFS的独立预后因素,研究人员进行了多变量分析,并对包括淋巴结(LN)分期、肿瘤大小和血管侵犯(VI)在内的其他预后指标进行了调整。结果证实了组织学分级是生存的独立预测因子(见下表)。
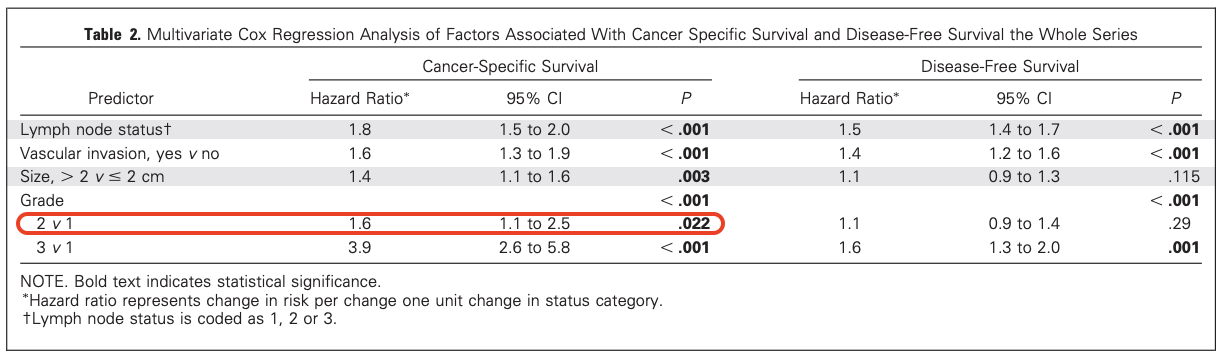
相较于组织学1级,组织学2级与癌症特异性生存期(CSS)缩短显著相关(HR = 1.6, 95% CI: 1.1-2.5, P = 0.022)。年轻[15]:确诊时年轻是原发性乳腺癌的负面预后因素。一项基于人群的研究提示,确诊时的年龄与死亡风险之间存在明确的负相关趋势:年龄越轻,风险增加幅度越大。具体而言,与45-49岁组(参照组,RR=1)相比,40-44岁组的调整后相对风险为1.12(95%CI 0.89-1.40),35-39岁组为1.40(95%CI 1.10-1.78),而诊断年龄小于35岁者,其调整后相对风险高达2.18(95%CI 1.64-2.89)。
雌激素受体(ER)阴性且孕激素受体(PR)阴性[16]:来自我国的真实世界分析提示,三阳性乳腺癌(TPBC,即ER阳性、PR阳性)与更优的DFS显著相关(HR=0.53,95%CI 0.31–0.91,p = 0.02),并表现出OS改善的趋势(HR=0.49,95%CI 0.23–1.06,p = 0.072)。
奈拉替尼强辅治疗,解决pCR下尚未清零的复发隐患
本例患者确诊时已存在腋窝淋巴结转移。尽管在完成6个周期的TCbHP新辅助治疗并接受手术后,术后病理显示已达到pCR,但考虑到其相对年轻的年龄,以及更关键的淋巴结转移史、较大的肿瘤体积和激素受体阴性(HR-)的特征,该患者仍被归类为高复发风险人群。因此,如何进一步降低其复发风险并改善长期生存,成为了临床治疗亟需重点考量的课题。
ExteNET研究为此提供了重要依据,该研究评估了奈拉替尼在接受曲妥珠单抗辅助治疗后的HER2阳性早期乳腺癌患者中的疗效与安全性。研究结果明确显示,在标准曲妥珠单抗辅助治疗之后,继续使用奈拉替尼进行为期一年的强化辅助治疗,能够显著降低疾病复发风险:在意向性治疗(ITT)人群中,2年和5年的疾病复发风险分别降低了33%和27% [17,18]。对于新辅助达到pCR的患者,奈拉替尼治疗同样具有获益趋势。其5年无浸润性疾病生存率(iDFS)绝对获益为 9.8%(HR 0.44; 95% CI 0.06-1.89),8年OS绝对获益为19.6%(HR 0.40; 95% CI 0.06-1.88)[19]。
安全性方面 ,奈拉替尼的整体安全性良好,治疗最常见的不良反应为腹泻[17,18],然而3/4级不良事件发生率较低[17,18]。据悉,腹泻是酪氨酸激酶抑制剂(TKI)类药物在临床应用中最常面临的不良反应[20]。为了优化此不良反应的管理,CONTROL研究针对奈拉替尼强化辅助治疗期间的腹泻预防策略进行了详细评估。研究结果[21]表明,采取两种预防措施均能有效降低奈拉替尼相关腹泻的发生率:一是预防性使用洛哌丁胺(从奈拉替尼首剂起,按特定方案分阶段给药,随后按需维持);二是通过奈拉替尼剂量递增方式给药(从低剂量起始逐步递增至全剂量,同时按需使用洛哌丁胺)。数据显示,在剂量递增组中,≥3级腹泻的发生率最低,仅为13%,且患者的治疗依从性显著提高,治疗持续时间普遍接近原计划的1年,其中至少75%的患者完成了超过11.1个月的治疗。本例患者行奈拉替尼强化辅助治疗至今,期间出现腹泻反应,予以洛哌丁胺、益生菌等药物对症处理后可耐受,总体安全性良好。
总之,尽管pCR与良好的预后密切相关,但乳腺癌新辅助治疗后的pCR并不能完全代表患者的最终预后。辅助治疗的优化策略需要对复发风险进行全面的综合分析,这不仅包括初诊肿瘤的临床分期,还应结合组织学和患者年龄等多维度因素,充分考虑奈拉替尼强化治疗的必要性。通过这种综合评估,才能为患者制定更为精准的个体化治疗方案,从而为患者带来全面且持久的获益。本例高危HER2阳性乳腺癌患者,通过TcbHP新辅助治疗成功获得手术机会并实现pCR。术后基于高复发风险因素(淋巴结阳性、cT3、偏年轻等)采用奈拉替尼强化辅助治疗,降低复发风险,为具有复发风险因素的HER2阳性乳腺癌的全程管理提供了优质示范。
[1]Vasconcelos l, et al. Breast 2016 Oct;29:181-5.
[2]Marion T. van Mackelenbergh, Sibylle Loibl, Michael Untch,et al. Pathologic Complete Response and Individual Patient Prognosis After Neoadjuvant Chemotherapy Plus Anti–Human Epidermal Growth Factor Receptor 2 Therapy of Human Epidermal Growth Factor Receptor 2–Positive Early Breast Cancer.J Clin Oncol. 2023 Jun 1;41(16):2998-3008. doi: 10.1200/JCO.22.02241. Epub 2023 Apr 19.
[3]Jens Huober, Marion van Mackelenbergh, Andreas Schneeweiss, et al.Identifying breast cancer patients at risk of relapse despite pathological complete response after neoadjuvant therapy[J]. npj Breast Cancer (2023)9:23.
[4]中国临床肿瘤学会乳腺癌专家委员会, 中国抗癌协会乳腺癌专业委员会. 人表皮生长因子受体 2阳性乳腺癌临床诊疗专家共识(2021版)[J]. 中华医学杂志, 2021, 101(17): 1226-1231. DOI: 10.3760/cma.j.cn112137-20210318-00679.
[5]Patricia Cortazar, Lijun Zhang, Michael Untch, et al. Pathological complete response and long-term clinical benefit in breast cancer: the CTNeoBC pooled analysis.Lancet.2014 Jul 12;384(9938):164-72. doi: 10.1016/S0140-6736(13)62422-8.
[6]向泓雨, 刘荫华. HER2阳性乳腺癌抗 HER2 治疗研究进展. 肿瘤药学. 2024;14(6):686-694.
[7] GIANNI L, EIERMANN W, SEMIGLAZOV V, et al. Neoadju⁃ vant chemotherapy with trastuzumab followed by adjuvant trastuzumab versus neoadjuvant chemotherapy alone, in patients with HER2-positive locally advanced breast cancer (the NOAH trial): a randomised controlled superiority trial with a parallel HER2-negative cohort [J]. Lancet, 2010, 375(9712): 377-384. DOI: 10.1016/S0140-6736(09)61964-4.
[8]GIANNI L, EIERMANN W, SEMIGLAZOV V, et al. Neoadju⁃ vant and adjuvant trastuzumab in patients with HER2-positive locally advanced breast cancer (NOAH): follow-up of a randomised controlled superiority trial with a parallel HER2- negative cohort [J]. Lancet Oncol, 2014, 15(6): 640-647. DOI: 10.1016/S1470-2045(14)70080-4.
[9]GIANNI L, PIENKOWSKI T, IM Y H, et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial [J]. Lancet Oncol, 2012, 13(1): 25-32. DOI: 10.1016/S1470-2045(11)70336-9.
[10] 中国抗癌协会乳腺癌专业委员会, 上海市抗癌协会.CBCS&CSOBO乳腺癌诊治指南与规范精要本(2025版).
[11]Niels Kroman,Maj-Britt Jensen,Jan Wohlfahrt, et al. Factors influencing the effect of age on prognosis in breast cancer: population based studyCommentary: much still to learn about relations between tumour biology, prognosis, and treatment outcome in early breast cancer. BMJ 2000; 320 doi: https://doi.org/10.1136/bmj.320.7233.474
[12] Jibiki N, et al. Cancer Diagn Progn. 2024 May 3;4(3):326-332.
[13]Emad A. Rakha,Stewart Martin, Andrew H. S. Lee, et al.The prognostic significance of lymphovascular invasion in invasive breast carcinoma. Cancer
. 2012 Aug 1;118(15):3670-80. doi: 10.1002/cncr.26711. Epub 2011 Dec 16.
[14]Emad A. Rakha, Maysa E. El-Sayed, Andrew H.S. Lee, et al. Prognostic Significance of Nottingham Histologic Grade in
Invasive Breast Carcinoma. J Clin Oncol. 2008 Jul 1;26(19):3153-8. doi: 10.1200/JCO.2007.15.5986. Epub 2008 May 19.
[15] Niels Kroman,Maj-Britt Jensen,Jan Wohlfahrt, et al. Factors influencing the effect of age on prognosis in breast cancer: population based studyCommentary: much still to learn about relations between tumour biology, prognosis, and treatment outcome in early breast cancer. BMJ 2000; 320 doi: https://doi.org/10.1136/bmj.320.7233.474
[16] Chen H, et al. Breast. 2024 Jun;75:103733.
[17] Chan A, Delaloge S, Holmes FA, et al. Neratinib after trastuzumab-based adjuvant therapy in patients with HER2-positive breast cancer (ExteNET): a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2016;17(3):367-377.
[18]Martin M, Holmes FA, Ejlertsen B, et al. Neratinib after trastuzumab-based adjuvant therapy in HER2-positive breast cancer (ExteNET): 5-year analysis of a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2017;18(12):1688-1700.
[19]Arlene Chan, Beverly Moy, Janine Mansi, et al. Final Efficacy Results of Neratinib in HER2-positive Hormone Receptor-positive Early-stage Breast Cancer From the Phase III ExteNET Trial. Clin Breast Cancer. 2021 Feb;21(1):80-91.e7. doi: 10.1016/j.clbc.2020.09.014. Epub 2020 Oct 6.
[20]田劭丹, 罗美, 郑智, 等人. 酪氨酸激酶抑制剂相关性腹泻中医药防治专家共识. 世界中医药. 2025;20(3):361-367.
[21] Chan A, Ruiz-Borrego M, Marx G,et al. Final findings from the CONTROL trial: Strategies to reduce the incidence and severity of neratinib-associated diarrhea in patients with HER2-positive early-stage breast cancer. Breast. 2023 Feb;67:94-101.
排版编辑:TanRongbing











 苏公网安备32059002004080号
苏公网安备32059002004080号


