福建省抗癌协会癌痛专业委员会和福建省抗癌协会中西医整合肿瘤专委会青年委员会主办的【十邑论坛】开播啦!论坛于每周四推出,带您用中文听原汁原味的2025年美国临床肿瘤学会(ASCO)研究。本期论坛聚焦2025 ASCO年会上结直肠癌围手术期治疗研究。来自巴黎癌症研究所胃肠病与消化肿瘤学部的Julien Taieb教授带来了题为“优化围手术期的筛选与治疗策略”的报告。【肿瘤资讯】特邀福建省肿瘤医院苏丽玉教授进行深入解读。
福建省肿瘤医院腹部内科
中国抗癌协会肿瘤整体评估专委会委员
福建省抗癌协会癌痛专委会秘书
福建省抗癌协会中西医整合肿瘤专委会青年委员会秘书
Julien Taieb教授的报告聚焦于三项前沿研究(#3503、#3504、#3505),其中两项探讨了循环肿瘤DNA(ctDNA)的应用(#3503、#3504),另一项则关注腹膜癌的治疗(#3505)。它们之间并不容易联系起来。也许是因为腹膜癌病并不释放ctDNA。
ctDNA在结直肠癌辅助治疗中的应用:解析DYNAMIC III研究、N0147研究
ctDNA在结直肠癌(CRC)中的多个阶段都有所应用,从早期诊断或筛查,到分子变异、克隆进化的研究,特别是在EGFR抑制剂“再挑战”治疗的背景下。本次解读聚焦于ctDNA在辅助治疗后的微小残留病灶(MRD)检测与复发监测中的角色。
过去十年间已发表多项研究,如Jeanne Tie教授主导的DYNAMIC III研究,已证实ctDNA是一个极强的预后因子。术后ctDNA阳性结肠癌患者的复发率达60%~90%,而阴性患者的复发率则在9%~30%之间(图1),不同的文献结果可能有所差异。这些研究均采用“肿瘤知情(tumor-informed)”分析法,即通过分析肿瘤组织的基因变异特征,来追踪血液中的相应标志物。
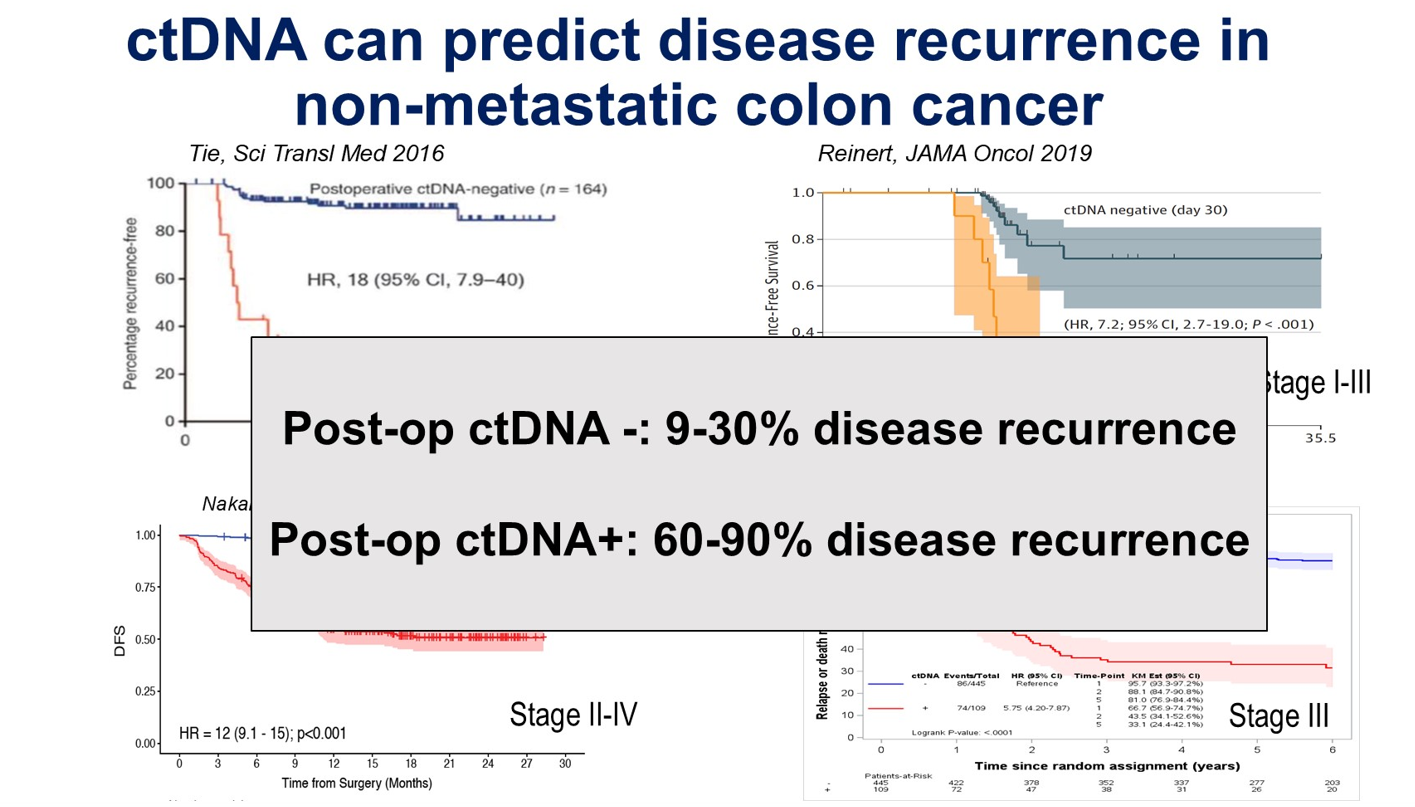
基于ctDNA良好的预后预测价值,学术界开始探索一种全新的治疗模式:从传统依据病理分期决定辅助治疗,转向依据ctDNA检测结果指导治疗。目前,相关的临床试验主要分为两类设计:第一类为检测验证型,如DYNAMIC III研究,将患者随机分配至标准管理组或ctDNA检测组来验证策略的有效性。在ctDNA检测组中,通常对ctDNA阳性患者进行治疗升级,对阴性患者进行治疗降级。第二类为治疗验证型,所有患者均接受ctDNA检测,阳性者随机分配接受标准治疗或强化治疗;阴性者则随机分配接受标准治疗或降级治疗(对于低危II期患者,可能观察等待)。
N0147研究
Frank Sinicrope博士的报告采用了一种不依赖肿瘤基因特征的商业化表观基因组检测技术,在III期结直肠癌根治术后患者中检测出21%的ctDNA阳性率,这完全符合预期范围。N0147研究证实ctDNA检测结果显著影响无病生存期(DFS)和总生存期(OS)。这项分析纳入了2000多例患者,规模令人印象深刻。Frank Sinicrope博士还表示,无论是MSI还是MSS患者、高危或低危结肠癌患者,ctDNA均具有强预后价值(图2);且在ctDNA阳性患者中,表观基因组肿瘤分数(即ctDNA负荷)也具有预后意义。特别值得关注的是,当结合ctDNA与TNM分期风险综合分析时,在曲线中可以看到:即使是ctDNA阴性但高危的患者,仍有40%的复发率。这表明ctDNA虽是良好的预后指标,但可能不足以单独判断患者是否会复发。
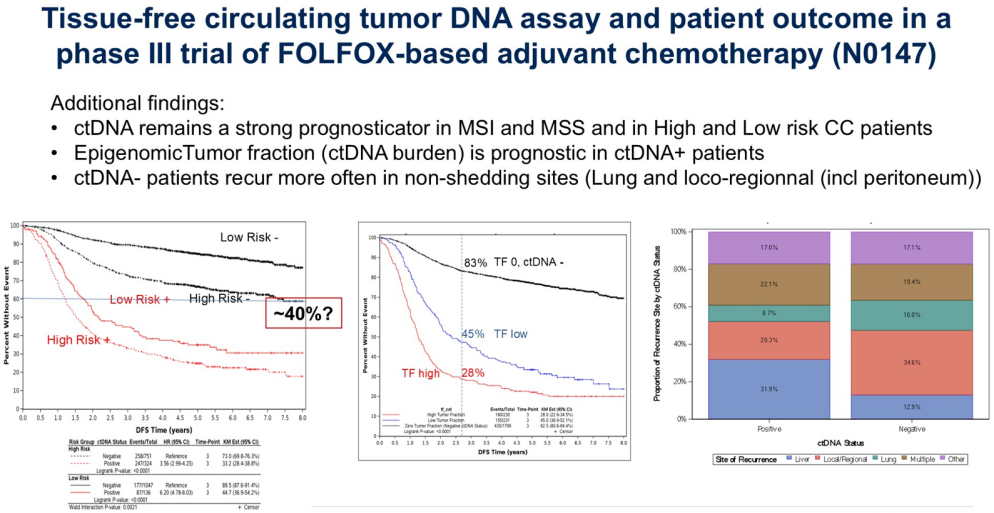
该研究的局限性在于:试验设计年代较早,所有患者均接受了标准化疗双药治疗(无法观察疾病自然史);由于N0147研究设计时ctDNA技术尚未成熟,存在样本前处理条件欠佳的问题;仅设单一时间点检测,缺乏动态评估;属于事后分析(post-hoc),未预设正式统计假设;此外,高危且ctDNA阴性患者仍存在40%复发率。不过其优势和创新点在于:大样本量、长达6年的随访(在ctDNA文献中非常罕见,多数研究仅2~4年随访);首次证实ctDNA负荷与预后的相关性;尤其值得注意的是,本次采用的“肿瘤未知”检测法(tumor-agnostic test)虽理论上灵敏度和特异性较低,但实际展现出良好效果。
DYNAMIC III研究
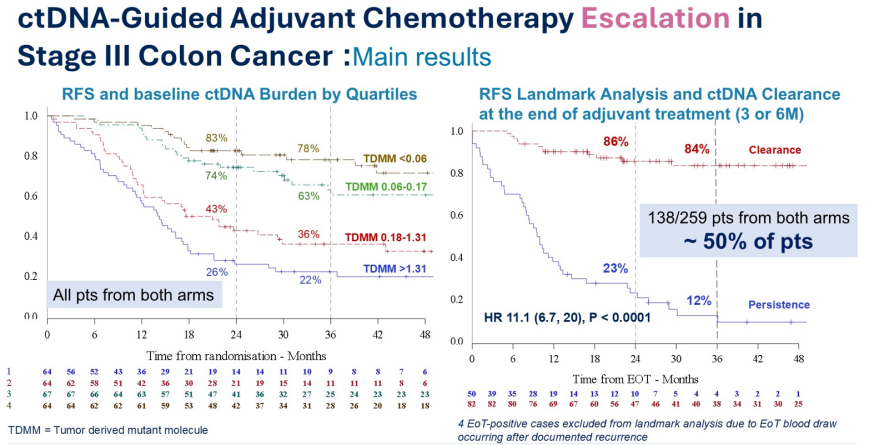
Jeanne Tie教授报告的DYNAMIC III研究显然是一项“检测验证型”试验,其主要终点为2年无复发生存(RFS)率。但需要关注其统计学问题。首先,这是一个非比较性随机的II期研究,但我们没有看到该研究通常应当设定的零假设(H0)和备择假设(H1),这在这种研究设计中应是基本要求。其次,虽然这是一个非比较性II期研究,但我们在报告中却看到大量的组间比较,这在统计学上是不恰当的。第三,我们必须质疑,仅用250例患者就试图探究风险比(hazard ratio)为0.75是否合理?例如,在著名的MOSAIC研究中,为了观察HR为0.78的差异,需要超过2000例患者,所以本研究统计功效严重不足。当我与该研究的统计学家交流时,他也表示,即使研究结果为阳性,其统计功效也只有37%。因此,研究的结论充其量只是提出假设,而不能作为确凿结论。
尽管如此,Jeanne Tie教授也展示了几项非常有趣的发现:通过另一种方法评估,ctDNA负荷依然具有预后价值;此外,非常重要的是,研究中约有50%的患者进行了ctDNA清除(clearance)分析。结果发现:在接受化疗后ctDNA清除的患者中,复发率约为20%;而ctDNA持续阳性的患者,复发率高达90%。这强烈表明,ctDNA清除是一个重要的远期预后指标。
不过,该研究的主要终点并未达到。更大的问题在于,两组患者在多项关键预后因素上存在不平衡,虽然不算极端,但却是累积的不平衡:ctDNA指导组(即治疗强化组)中,有更多右侧肿瘤、N2期、以及肿瘤外沉积(extramural tumor deposit)(图4),而这些因素均为已知的不良预后因素。此外,两组在T4期患者的ctDNA负荷上也存在显著差异——在ctDNA指导组中,T4期ctDNA水平更高,正如Jeanne Tie教授所展示的那样,这本身就具有预后意义。因此,研究结果存在混杂因素,解释上应谨慎。
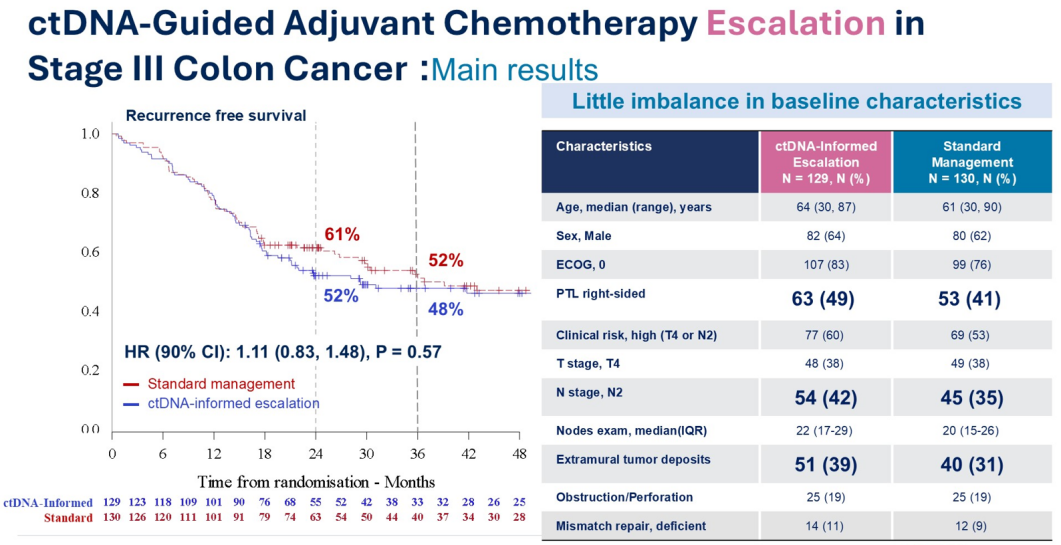
我们也不能正式下结论表明这项研究是明确阴性。其次,研究中对FOLFOXIRI与FOLFOX/CAPOX进行了比较,但该比较是否合理?我认为不合理,因为这几种方案之间并没有进行随机化比较。此外,如果真的想强化治疗,为何FOLFOXIRI方案的治疗时间是3~6个月,而不是所有患者都接受标准的6个月?而CAPOX与FOLFOX组中混合了高危和低危III期患者,相比之下,FOLFOXIRI组仅包含高危患者。所以,这里也存在明显的组间不平衡,FOLFOXIRI组的ctDNA水平几乎是其他组的两倍,这也说明了风险更高。
综上,DYNAMIC III研究证实:一旦复发,情况就会很糟糕。从目前展示的生存曲线来看,治疗升级似乎并不乐观。但我认为,我们也不能就此认定FOLFOXIRI是完全无效的,尽管目前曲线看起来并不鼓舞人心。我们仍需等待即将到来的IROCAS-PRODIGE-GONO-CCTG多中心试验,这项试验是随机设计,比较了FOLFOX与FOLFIRINOX在T4和/或N2期III期结肠癌中的疗效,预计明年会公布结果。
至于ctDNA清除,这确实是一个很有前景的指标,但该研究中数据流失较严重,因此我们必须谨慎解读这些结果,并认为它们尚属假设生成阶段。不过,尽管这些结果尚未定论,它们提示ctDNA清除有可能成为将来辅助治疗临床试验中的研究终点。目前,这一方向正在由ACCENT-CIRCULATE工作组进一步推进。
最后,在MOSAIC研究之后20年,我们或许需要的不仅仅是化疗,才能真正改善III期结肠癌患者的预后。我们现在迫切需要开展平台型临床试验,研究新型靶向治疗、抗体药物偶联物(ADC)、免疫检查点抑制剂,或者这些疗法的联合策略;同时,也可能需要探索新治疗策略,如新辅助治疗或序贯治疗策略。
腹膜癌治疗策略的探讨:解析CAIRO6研究
CAIRO6研究试图回答这样一个问题:对于接受细胞减灭术(CRS)+腹腔热灌注化疗(HIPEC)治疗的结直肠癌腹膜转移患者,围手术期化疗是否能够改善OS?这个问题是否具有现实意义?在我看来,并不是特别有价值。因为无论是ESMO指南还是ASCO指南都明确指出:对于腹膜癌指数(PCI)较低的患者,推荐进行细胞减灭术(CRS);但不推荐在临床试验外进行HIPEC治疗;文献中也未显示使用丝裂霉素C的HIPEC能带来额外获益;而是普遍建议,所有此类患者应首先接受全身化疗。
该研究在七年内(包括COVID疫情期间)纳入了相当数量的患者,所有患者的腹膜癌病负担都很低(PCI极低或局限性腹膜转移)。研究中两组之间没有明显的基线不平衡,但如报告者所说,化疗组副作用更多,这很可能与贝伐珠单抗相关的吻合口瘘风险增加有关;同时,化疗组的腹膜复发更少。虽然无病生存期(DFS)有所改善,但OS没有改善,因此这项研究在统计意义上是阴性的。此外,有趣的是:同时性腹膜转移患者似乎能从围手术期化疗中获益;右半结肠癌患者也有一定获益(图5);但对于非同时性腹膜转移和左半结肠癌患者,围手术期化疗并未显示出优势。
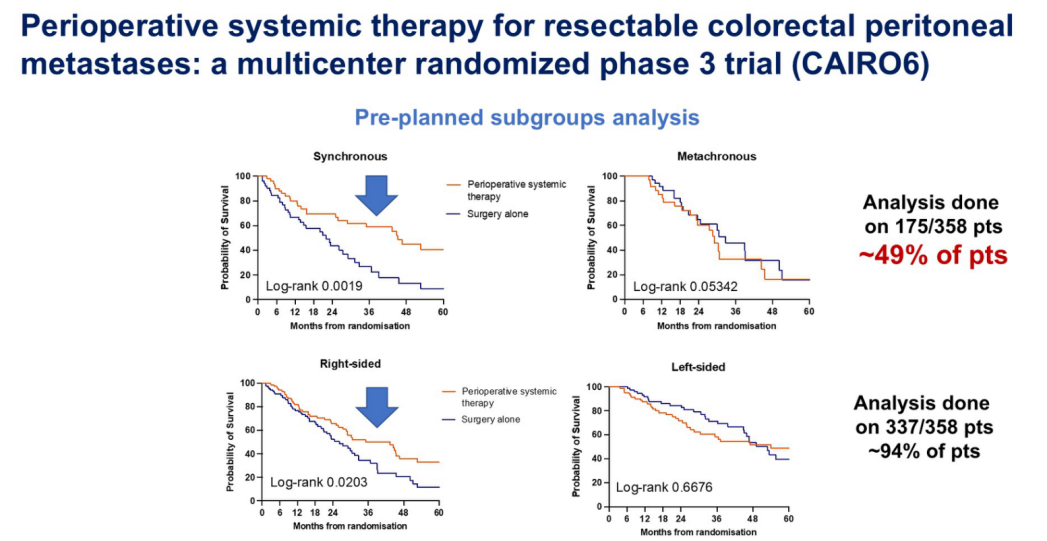
这项研究是否真正回答了它所提出的问题?我认为这项研究在患者选择方面存在不少问题。第一,研究流程图设计非常复杂,在试验组中,有高达25%的患者未能最终接受CRS,这对于评价治疗效果是一个严重的干扰因素。第二,本项研究中将同时性与非同时性腹膜转移患者混合在一起,但这两类患者的预后可能完全不同,因此混合分析会影响结果的准确性。第三,缺乏分子标志物检测。BRAF V600E突变是重要的不良预后标志物。自2014年以来,对于此类研究,进行BRAF V600E突变检测已被视为基本要求。第四,治疗方案方面也存在问题:HIPEC的应用本身就非常有争议,并非所有患者都适合;系统治疗中既可使用FOLFOX也可使用FOLFIRI,两者均联合贝伐珠单抗;然而,对于左半结肠癌且RAS/BRAF野生型的患者,没有提供抗EGFR治疗选项,这在转移性结直肠癌治疗中已是标准做法。此外,研究也未提供有关后续治疗的数据,这使得我们难以解释DFS与OS之间的差距。
因此,尽管研究者付出了巨大努力,但这项研究不会改变当前的临床实践,至少不会改变我的做法。在腹膜癌病的外科治疗中,患者筛选是关键。化疗至少可以作为一种筛选患者的手段。就像我们对结直肠癌潜在可切除肝转移所采取的策略一样,对于同时性腹膜癌病患者,我将继续以化疗作为起始治疗;而对于非同时性腹膜转移患者,是否开始化疗将取决于以下因素:腹膜复发的时间点,是否接受过辅助化疗,以及原发肿瘤的位置(图6)。

排版编辑:xiaodong












 苏公网安备32059002004080号
苏公网安备32059002004080号


