Menin 抑制剂靶向 KMT2A-Menin 蛋白-蛋白相互作用,抑制原始细胞增殖并诱导分化,已证实对以 HOXA 基因簇和 MEIS1 过表达为特征的急性白血病亚型(包括 KMT2A 重排、NPM1突变、NUP98重排和其他基因改变)具有潜在影响。继两种开创性的menin 抑制剂revumenib和ziftomenib 取得了可喜的结果后,其他menin抑制剂,包括bleximenib、enzomenib、BN-104和 HMPL506 也正在临床试验中进行研究。多项试验在2024年美国ASH年会上公布了其初步结果,包括5项单药临床试验和4项联合临床试验。
首都医科大学附属北京朝阳医院和首都医学科学创新中心研究团队近日于Journal of Hematology & Oncology发表综述,系统总结了这些关键临床试验的核心研究成果。该论文由主鸿鹄教授与孙舒博士后担任共同通讯作者,研究工作由首都医科大学临床医学(阶平班)本科生曹格嘉与北京朝阳医院张海啸博士后共同完成(并列第一作者)。

Menin抑制剂单药
在2024年ASH年会上,展示了四种menin抑制剂(revumenib、bleximenib、enzomenib和BN-104)作为急性白血病(AL)单药治疗策略的临床试验结果(表1)。
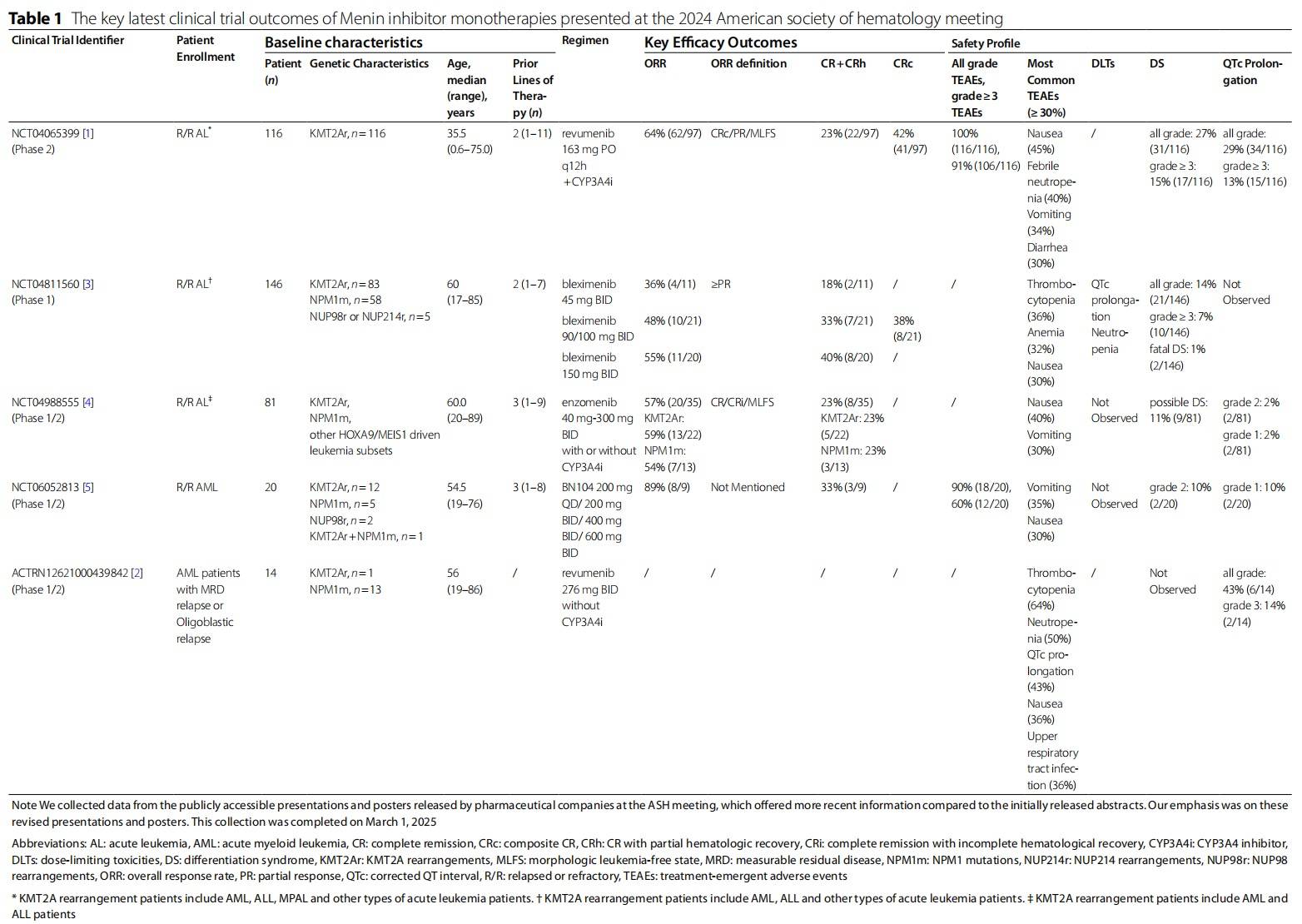
Revumenib是首个获得美国食品药品监督管理局(FDA)批准的menin抑制剂,在复发/难治性KMT2A重排(R/R KMT2Ar)AL患者中显示出64%(62/97)的总缓解率(ORR)和23%(22/97)的完全缓解(CR)+完全缓解伴部分血液学恢复(CRh)率,其中61%(11/18)的CR+CRh缓解者达到微小残留病(MRD)阴性(NCT04065399)。
研究中分别有15%(17/116)和13%(15/116)的患者出现≥3级分化综合征(DS)和QTc间期延长。由由Loo等人报告(ACTRN12621000439842)还评估了Revumenib用于MRD复发的急性髓系白血病(AML)患者的治疗。对于NPM1突变(NPM1m)患者,36%的患者达到MRD阴性。
Bleximenib单药用于存在KMT2Ar、NPM1m或NUP98/NUP214重排的R/R AL患者(NCT04811560),并确定了推荐的2期剂量(RP2D)。在RP2D下,ORR为48%(CR+CRh率为33%),中位至首次缓解时间为1.4个月。14%(21/146)的患者出现DS,其中2例因DS死亡。未观察到QTc间期延长。
Enzomenib单药用于存在KMT2Ar或NPM1m的R/R AL患者,ORR达到57%(CR+CRh率为23%)。研究中未观察到治疗相关QTc间期延长,也未出现因DS导致的死亡。值得注意的是,1例携带CALM-AF10融合(一种menin敏感性改变)的患者达到CR。
此外,Wu等人报道了BN104单药在存在KMT2Ar、NPM1m和NUP98重排的R/R AML患者中的初步结果(NCT06052813)。在剂量递增阶段,ORR和CR+CRh率分别为89%(8/9)和33%(3/9),未观察到≥3级DS和QTc间期延长。
尽管这些menin抑制剂作为单药治疗在R/R AL患者中显示出较高的缓解率,但≥3级不良事件也很常见,包括恶心、呕吐、发热性中性粒细胞减少症和腹泻。表1总结了所有不良事件的发生率,并提供了更多详细信息。
Menin抑制剂联合疗法
在临床前研究中,menin抑制剂与BCL-2抑制剂和FLT3抑制剂具有协同作用,因此联合疗法或能为AL患者带来更好的治疗反应。2024年ASH年会上公布的相关临床试验及其关键结果见表2。
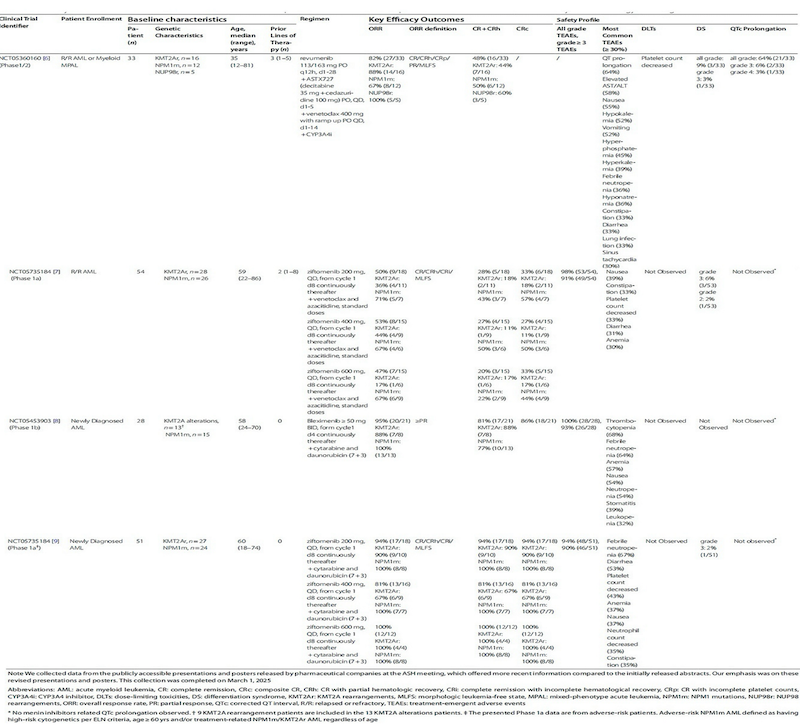
在R/R AML患者中,menin抑制剂、维奈克拉和去甲基化药物联合方案展现出一定的治疗潜力。Revumenib、ASTX727(口服地西他滨/cedazuridine)和维奈克拉的全口服联合方案在该类患者中达到82%(27/33)的ORR和48%(16/33)的CR/CRh率,至首次形态学缓解的中位时间仅有28天。
在达到ORR和CR+CRh的患者中,分别有65%(17/26)和88%(14/16)的患者达到MRD阴性。≥3级DS和QTc间期延长发生率分别为3%(1/33)和9%(3/33)。
另外,ziftomenib联合维奈克拉和阿扎胞苷方案(NCT05735184)在KMT2Ar/ NPM1m患者中也实现了50%(24/48)的ORR和25%(12/48)的CR/CRh率,且未观察到ziftomenib相关QTc间期延长。
尽管这两种方案在携带特定遗传改变的R/R AML亚群中显示出有希望的疗效,但两试验中均观察到骨髓抑制,强调了进一步探索最佳给药计划和剂量策略的必要性。
基于在R/R AML患者中观察到的良好疗效,部分试验正在探索menin抑制剂联合疗法用于新诊断AML患者。
Bleximenib联合强化疗(“7+3”方案)在NPM1m/KMT2Ar患者(NCT05453903)中实现95%(20/21)的ORR和81%(17/21)的CR/CRh,且未观察到QTc间期延长和DS。
Ziftomenib联合“7 + 3”方案在KMT2Ar/NPM1m患者(NCT05735184)中报告了91%(42/46)的ORR和CR/CRh率。在CRc患者中,200 mg ziftomenib剂量下81%(13/16)的患者达到MRD阴性,400 mg剂量下75%(9/12)的患者达到MRD阴性,600 mg剂量下67%(6/9)的患者达到MRD阴性。
该联合方案显示出与单独使用“7+3”相似的安全性特征,且在任何剂量水平下均未观察到ziftomenib相关QTc间期延长。研究者在2%(1/51)的患者观察到3级DS,但病情可控。
总体而言,在使用联合疗法治疗AL的四项临床试验中,观察到的最常见不良事件主要包括骨髓抑制和胃肠道反应。基于以上研究展现卓越的缓解率和可管理的疗效,menin抑制剂联合“7+3”方案或能作为KMT2Ar/NPM1m AML患者有前景的一线治疗方案
总之,2024 ASH年会报道的menin抑制剂结果提供了初步的安全性特征和有希望的缓解率,但仍需进一步评估以提供更有力的证据。
在未来,menin抑制剂或将作为更多联合疗法的一部分扩展到一线治疗,为具有不同共突变或其他特征的AL患者提供精准治疗方案。此外,将menin抑制剂作为异基因移植后的维持治疗、MRD为导向的治疗以及可能在其他血液系统恶性肿瘤中的有价值选择,也正在积极探索中。由此可见,属于Menin抑制剂的时代正在到来。
首都医科大学附属北京朝阳医院血液科主任
教授、博导和博士后导师,首都医学科学创新中心高级研究员
北京大学博士毕业,国际急性早幼粒细胞白血病基金会委员
中国抗癌协会白血病专委会副主任委员
中国生物工程学会细胞分析专委会副主任委员
主鸿鹄教授从事血液病一线临床工作30年
主要学术成就:
第一,创立了“急性早幼粒细胞白血病不化疗的家庭治疗新方案”,根治率>95%【J Clin Oncol (2013) 、N Eng J Med (2014a,2014b)、Lancet Oncol (2018) 、Blood (2016, 2018, 2019) ,J Hematol Oncol (2022) 】
第二,创立了“DAV治疗初诊急性髓系白血病新方案”,缓解率>90%【Lancet Haematol (2022) 】
第三,在国际上首次定义了一种新的白血病类型—RARG重排AML【Leukemia (2018) 、Leuk Res (2019) , Blood Advance (2023) 】以通讯/第一作者发表SCI论文69篇,最新总IF: 1064分,F1000论文1篇。论文发表在《N Eng J Med》(2篇)、《Lancet Oncol》、《Lancet Haematol》、《J Clin Oncol》 、《Blood》(5篇)、《Leukemia》等。国际大会特邀/口头报告12次,主持9个国家级和省部级课题(1个国家重点研发、5个国自然、3个省部级重点课题),总科研经费>4000万。研究成果写入12个国际/中国白血病指南/共识。作为执笔人参与4个中国白血病指南的制定,研究成果2次入围《中国临床肿瘤学年度十大进展》。国际检索及分析机构Healsan Consulting LLC和Stork统计了全球白血病领域在2015-2020年发表的SCI论文,位居白血病领域中国最有影响力学者排行榜位列第二名
Cao, G., Zhang, H., Sun, S. et al. Menin inhibitors from monotherapies to combination therapies: clinical trial updates from 2024 ASH annual meeting. J Hematol Oncol 18, 63 (2025). https://doi-org.ctust.aliya.filescenter.top/10.1186/s13045-025-01718-x
排版编辑:Cherry











 苏公网安备32059002004080号
苏公网安备32059002004080号


