病史摘要:女性患者,78岁,ECOG 1分。2年前因便血于当地医院行结肠镜提示:结肠乳头状腺瘤伴高级别上皮内瘤变。我院病理会诊:结肠腺癌。排除禁忌后在全麻下行腹腔镜辅助乙状结肠癌根治术,术后分期:pT3N1bM0,IIIB期。术后半年内按期行12周期FOLFOX4方案辅助化疗,化疗结束后未规律复查。
症状体征:2周前无明显诱因出现右上腹疼痛不适,查体右上腹压痛,无反跳痛。
诊断方法:上腹部CT提示肝左叶及部分右叶肿块影,周围胆管扩张。CEA 959.8U/L,CA-199 大于10000ng/ml。经皮肝穿刺活检病理:“肝组织” 转移性腺癌。
治疗方法:首先给予8周期西妥昔单抗联合FOLFOX6方案治疗,随后进入西妥昔单抗联合卡培他滨维持治疗,10个月后行腹腔镜胆囊切除+肝脏II、III、IV、V段切除。
临床转归:患者处于无瘤状态,术后定期复查未见肿瘤病灶复发或转移,肿瘤标志物正常。
适合阅读人群:肿瘤科
关键词:高龄1;乙状结肠癌肝转移2;转化治疗3;无瘤状态4
引言
结直肠癌肝转移(colorectal cancer liver metastases)是结直肠癌治疗的重点和难点之一,绝大多数(80%~90%)的肝转移灶初始无法获得根治性切除[1-3]。肝转移也是结直肠癌患者最主要的死亡原因[4]。未经治疗的肝转移患者的中位生存期仅6.9个月,无法切除患者的5年生存率低于5%[5-6]。而肝转移灶能完全切除或可以达到“无疾病证据(no evidence of disease,NED)” 状态患者的中位生存期为35个月,5年生存率可达30%~57%[7-11]。有一部分最初肝转移灶无法根除的患者,经治疗后可以转化为可切除或达到NED状态。我们报道1例高龄乙状结肠癌肝转移转化治疗成功案例,旨在倡导通过多学科团队(multidisciplinary team,MDT)对结直肠癌肝转移患者进行全面的评估,个性化地制定治疗目标,开展相应的综合治疗,以提高肝转移灶手术切除率和5年生存率。
临床资料
一般资料
患者,女性,76岁,ECOG 1分。2年前因“便血1月”于当地医院行结肠镜提示:结肠乳头状腺瘤伴高级别上皮内瘤变,建议上级医院就诊。随后就诊于我院,病理科会诊外院病理切片结果示:结肠腺癌。完善相关检查,排除手术禁忌后在全麻下行腹腔镜辅助乙状结肠癌根治术。术后病理:乙状结肠溃疡型中分化腺癌侵及肠壁全层达其外纤维脂肪组织,肠周淋巴结(2/11)有癌转移,手术上下切缘未见癌组织。术后分期:pT3N1bM0,IIIB期。术后1月开始,行12周期FOLFOX4方案辅助化疗,期间不良反应:骨髓抑制II度,胃肠道反应I度,化疗结束后未定期复查。2周前无明显诱因出现右上腹疼痛不适,疼痛呈持续性隐痛,前来就诊。家族中无相关疾病记载,既往史、个人史无特殊。
检查
复查胸腹增强CT:肝左叶及部分右叶肿块影,周围胆管扩张,结合病史考虑转移。
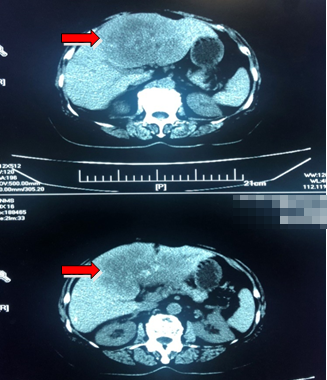
CEA 959.8U/L,CA-199 大于10000 ng/ml
经皮肝穿刺活检病理:“肝组织” 转移性腺癌。
基因检测:KRAS、NRAS、BRAF均为野生型。
免疫组化:MLH1(+)、MSH2(+)、PMS2(+)、 MSH6(+),HER-2未测。
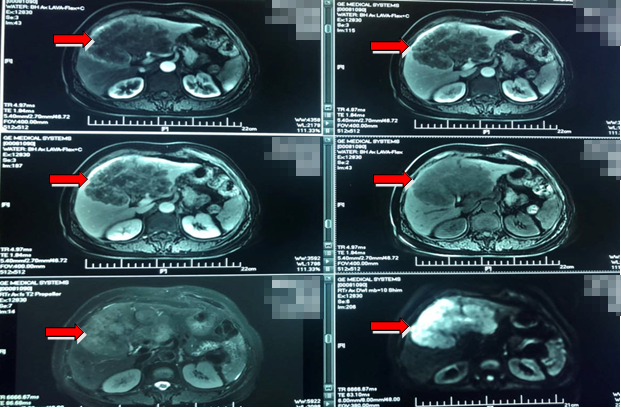
诊断与鉴别诊断
诊断:乙状结肠癌(rT3N1M1,左半结肠,RAS/BRAF野生型,MSS),肝转移。
鉴别诊断:结合结肠癌手术史、肿瘤标志物、胸腹增强CT、腹部MRI、肝穿活检病理和明确诊断。
治疗
治疗决策一:
治疗考量:肿瘤特征:临床、分子。
患者特征:年龄、体力状况、器官功能、意愿。
治疗特征:疗效、安全性、社会经济、QOL、治疗目的。
治疗目的:转化治疗——肝转移病灶潜在可切。
治疗方案:西妥昔单抗联合FOLFOX6方案化疗4周期。
主要不良反应:化疗后骨髓抑制、血小板减少症II级。
处理:海曲泊帕5mg po qd,3天后血小板恢复至正常范围。
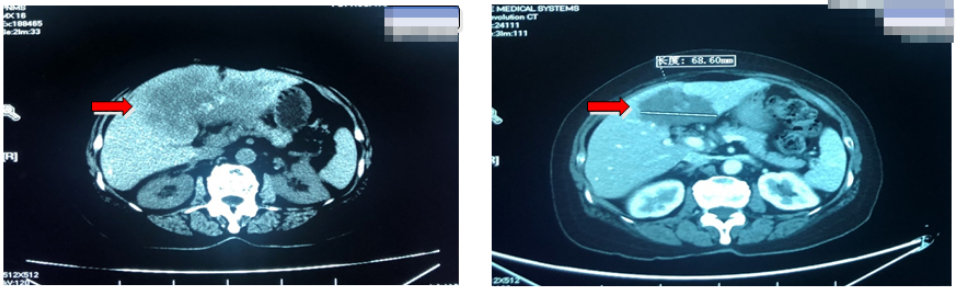
疗效评估:影像学评估:病变缩小大于30%;临床症状:上腹部不适感明显减轻;肿瘤标志物明显下降。
治疗决策二:
再次评估:肝转移负荷明显减轻,肝功能储备良好,结合患者年龄、体力状况、意愿。
治疗目的:根治——肝转移病灶潜在可切转化为可切除。
治疗选择:继续行靶向治疗及化疗(西妥昔单抗联合化疗4周期)。
不良反应:化疗后骨髓抑制、血小板减少症III级,胃肠道反应II级。
处理:海曲泊帕5mg po qd联合特比澳15000U ih qd,5天后血小板恢复至正常范围;胃肠道反应在止吐对症处理后缓解。
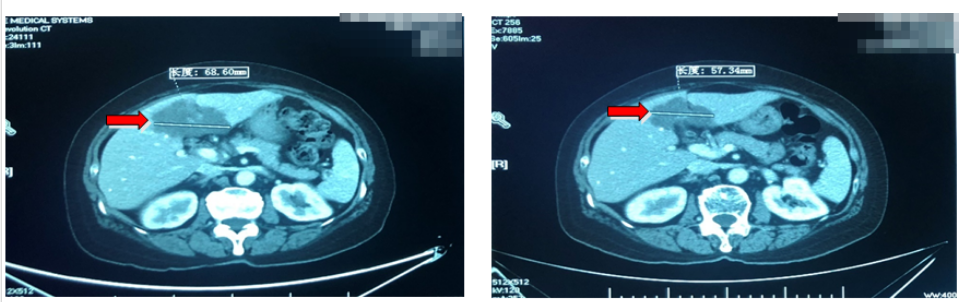
疗效评价(PR):影像学评估:病变持续缩小;临床症状:上腹部不适感几乎消失;肿瘤标志物进一步下降。
治疗选择:维持治疗(西妥昔单抗联合卡培他滨),期间定期复查。
不良反应:化疗后骨髓抑制、血小板减少症I级。
处理:海曲泊帕2.5mg po qd,5天后恢复至正常范围。
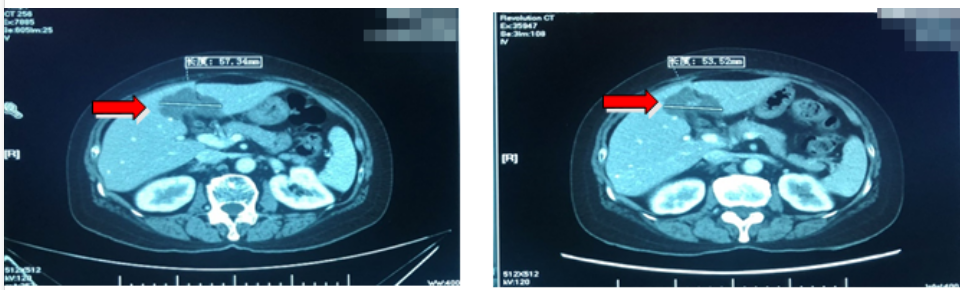
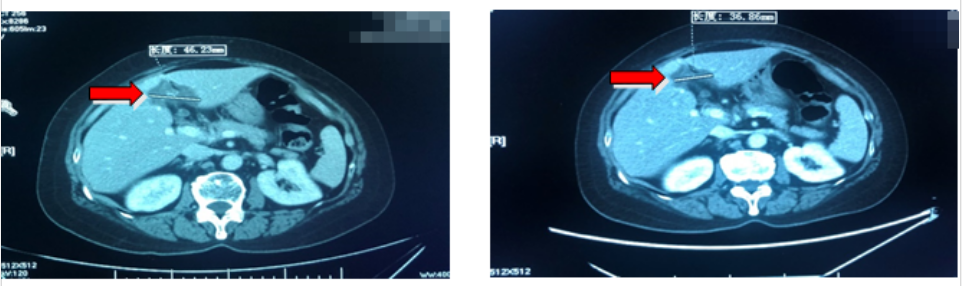
再次疗效评价(PR):影像学评估:病变整体缩小70%;临床症状:无任何不适,肿瘤标志物降至正常范围。
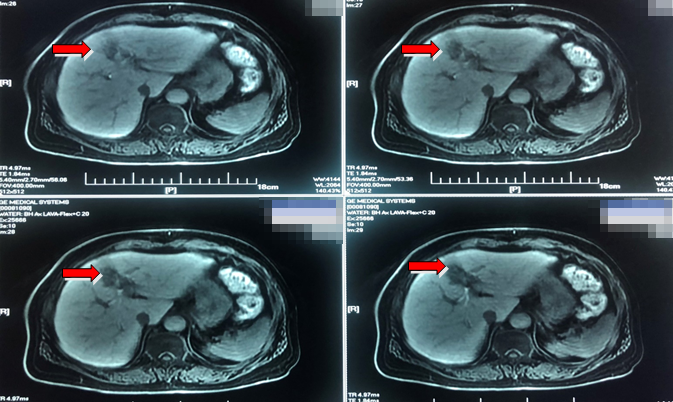
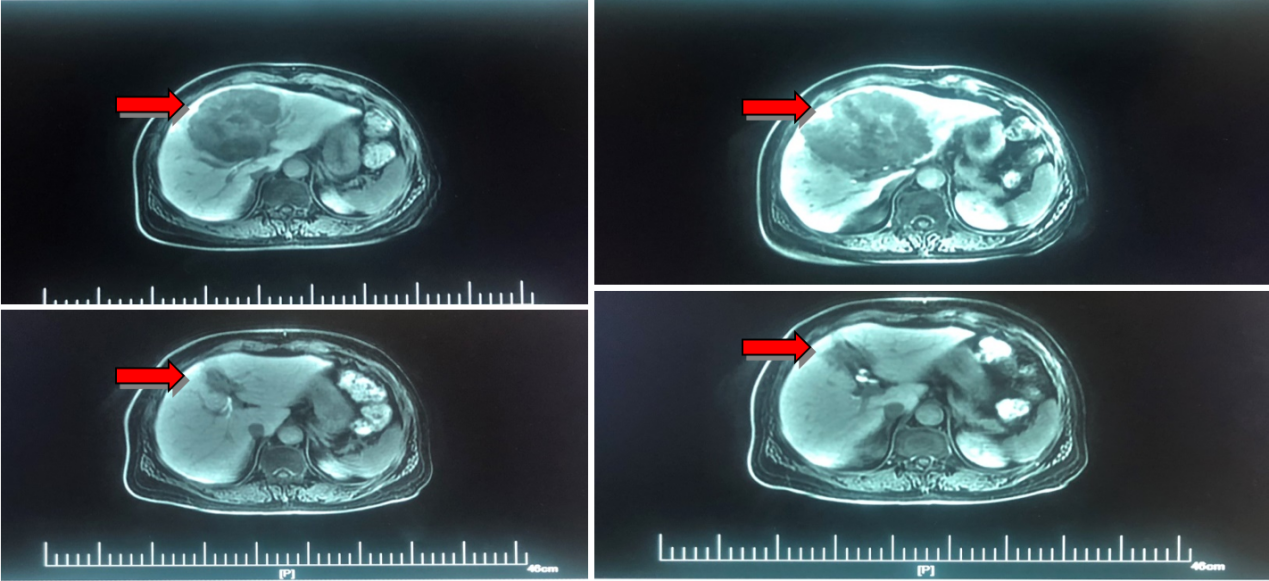
治疗决策三:
经前期西妥昔单抗联合化疗,病灶明显缩小,但肝脏病灶仍未消失,未达到NED。
治疗选择:肝胆外科手术治疗;
手术可行性评估及手术方式:高龄女性,心肺功能正常。无肝炎、肝硬化、肝功能ChildA级、肝脏储备功能正常。肝脏体积正常,能够耐受扩大左半肝切除。手术意愿强烈。根据术前影像学检查,病灶位于第一肝门前方,胆囊床处有肿瘤,且对左侧门静脉分支有侵犯,切除左半肝+第Ⅴ段。
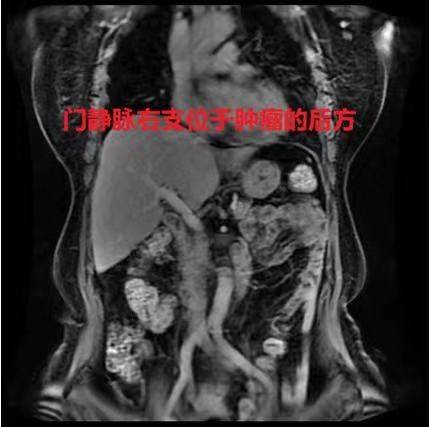
门静脉左支干未受侵,分支进入肿瘤。
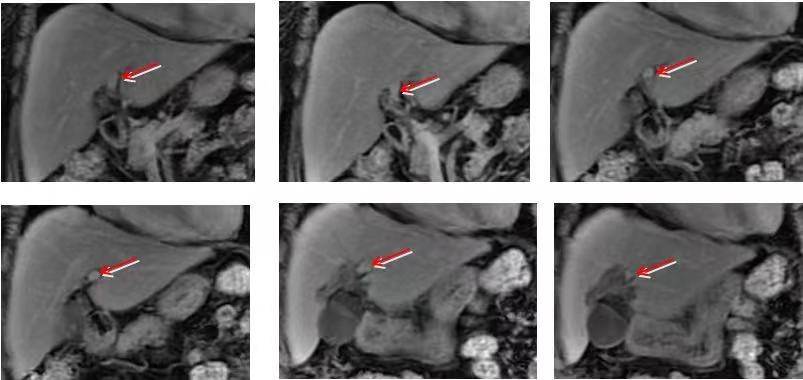
手术方案:腹腔镜胆囊切除+肝脏II、III、IV、V段切除。
术后病理:“II、III、IV、V段”肝组织内有中分化腺癌浸润,侵及局部肝脏被膜,周围肝脏组织呈中度脂肪变性改变,慢性胆囊炎。
治疗结果、随访及转归
术后定期复查未见肿瘤病灶复发或转移,肿瘤标志物正常。目前NED状态,DFS超过2年。
讨论
总体来说,对于这样一位高龄女性,体力状况良好,在进行乙状结肠癌根治手术后2年出现肝转移,是符合疾病表现的,由于基因型RAS/BRAF野生,一线治疗方案选择化疗+抗EGFR单抗,疗效评价达到PR,在一线治疗后进入维持治疗,过程中肝转移病灶转化治疗成功,最终成功手术,达到NED状态,大大提高患者生存预后,是非常难能可贵的。我们也提倡利用MDT手段,为每一位患者争取NED的机会。
这个病人在一线治疗有效后进入维持治疗,根据CSCO指南,有如下两种情况推荐使用维持治疗:(1)对于潜在可切除的患者,接受了转化治疗超过半年以上,且病灶仍无法进行R0切除。(2)一线姑息治疗3-6个月后,疾病有效或稳定的患者,考虑到奥沙利铂的剂量累积的毒性,建议进行维持治疗。这个病人实际上是在8周期转化治疗后,实际可以考虑评估手术指征,但由于这位患者治疗依从性欠佳,强烈拒绝手术,所以未能在第一时间进行MDT讨论评估手术可行性。
这样一例76岁的患者,在术后辅助化疗将近2年时间,出现肝转移灶后,予以西妥昔单抗联合化疗的方案,并在术后达到NED状态。疗效方面来讲,这个患者的治疗是比较成功的。从不良反应来说,这个患者治疗期间主要的不良反应是化疗后骨髓抑制所致的血小板减少症,但经过积极TPO-RA口服药升血小板或联合应用rhTPO,血小板均可在一周内很快升至正常范围,并未导致抗肿瘤治疗推迟或中断,可以说TPO-RA为该患者化疗的正常进行保驾护航,对治疗疗效起到了重要作用。从肿瘤治疗策略来讲,如果维持治疗时间太长,患者的肿瘤可能会发生进展,这样会影响治疗的长期效果。除了少部分RAS或BRAF突变的患者,手术的评估应相对谨慎一点。其他大部分情况下,应该通过影像学评估,及时进行手术。对于那些无法耐受手术的患者,继续维持治疗的策略是合理的。
利益冲突声明:所有作者均声明本研究不存在利益冲突。
[1] Giannis D, Sideris G, Kakos CD, et al. The role of liver transplantation for colorectal liver metastases: a systematic review and pooled analysis[J]. Transplant Rev (Orlando), 2020,34(4):100570.
[2] Taniai N, Akimaru K, Yoshida H, et al. Surgical treatment for better prognosis of patients with liver metastases from colorectal cancer[J]. Hepatogastroenterology,2007,54(78): 1805-1809.
[3] Qin S, Liu GJ, Huang MJ, et al. The local efficacy and influencing factors of ultrasound-guided percutaneous microwave ablation in colorectal liver metastases: a review of a 4-year experience at a single center[J]. Int J Hyperthermia, 2019,36(1):36-43.
[4] Siegel RL, Miller KD, Fedewa SA, et al. Colorectal cancer statistics, 2017[J]. CA Cancer J Clin,2017,67(3):177-193.
[5] Hong YS, Song SY, Lee SI, et al. A phase II trial of capecitabine in previously untreated patients with advanced and/or metastatic gastric cancer[J]. Ann Oncol,2004,15(9):1344-1347.
[6] Stewart CL, Warner S, Ito K, et al. Cytoreduction for colorectal metastases: liver, lung, peritoneum, lymph nodes, bone, brain. When does it palliate, prolong survival, and potentially cure?[J]. Curr Probl Surg,2018,55(9):330-379.
[7] de Jong MC, Pulitano C, Ribero D, et al. Rates and patterns of recurrence following curative intent surgery for colorectal liver metastasis: an international multi-institutional analysis of 1669 patients[J]. Ann Surg,2009,250(3):440-448.
[8] Norén A, Sandström P, Gunnarsdottir K, et al. Identification of inequalities in the selection of liver surgery for colorectal liver metastases in Sweden[J]. Scand J Surg,2018, 107(4):294-301.
[9] Margonis GA, Sergentanis TN, Ntanasis-Stathopoulos I, et al. Impact of surgical margin width on recurrence and overall survival following R0 hepatic resection of colorectal metastases: a systematic review and Meta-analysis[J]. AnnSurg,2018,267(6):1047-1055.
[10] Giuliante F, Ardito F, Vellone M, et al. Role of the surgeon as a variable in long-term survival after liver resection for colorectal metastases[J]. J Surg Oncol,2009,100(7):538-545.
[11] Yang AD, Brouquet A, Vauthey JN. Extending limits of resection for metastatic colorectal cancer: risk benefit ratio[J]. J Surg Oncol,2010,102(8):996-1001.
排版编辑:肿瘤资讯-王俊澔











 苏公网安备32059002004080号
苏公网安备32059002004080号


