入选2023级国家博士后研究人员计划
承担中国博士后面上基金和省自然科学基金各1项
获得了2024年FACO青年旅行基金资助
参与国家重点研发项目和四川省重点研发项目各1项
担任四川省医创会肿瘤生物分会秘书兼委员
参与研究:长期致力于肿瘤的免疫治疗的基础和临床研究,尤其是个体化细胞治疗的基础和临床转化研究。近期。相关研究已入选2024年的ASCO GI、AACR、JSCO、ISDE及CSCO国际会议口头报告及壁报,获得了2025届ESTRO大会的TOP 5%摘要
作为Sub-PI参与几十项I-III期GCP临床研究及IIT临床研究项目
以第一作者及共同第一作者在Br J Cancer ,JITC等杂志发表多篇SCI论文
ASCO 解读文献
Neoadjuvant anlotinib combined with penpulimab for resectable locally advancedesophageal squamous cell carcinoma (ESCC): Updated data from a prospective,phase II trial
安罗替尼联合派安普利单抗新辅助治疗可切除局部晚期食管鳞癌(ESCC):来自前瞻性II期临床研究的最新数据
研究背景
局部晚期食管鳞癌(ESCC)的标准治疗模式为术前新辅助同步放化疗(如CROSS研究、NEOCRTEC5010研究),可显著提升R0切除率并延长患者生存期1,2。然而,同步放化疗方案毒性较大,部分高龄或存在心肺疾病的患者无法耐受其不良反应,进而失去手术机会。此外,即使经新辅助放化疗治疗后手术切除,仍有近半数患者会出现术后复发或远处转移3,4。因此,亟需探索新的低毒性、高疗效的新辅助治疗模式。
免疫检查点抑制剂(ICIs)已在晚期ESCC治疗中取得明确疗效5-8。近年来,ICIs联合抗血管生成靶向药物在肝癌、肾癌等实体肿瘤治疗中展示出良好的协同效应,具有改善免疫微环境并提升抗肿瘤活性的潜力9-13。本研究首次在局部晚期ESCC中探索了去经典放疗和化疗的新的治疗模式,采用盐酸安罗替尼联合派安普利单抗的治疗方案,为那些因不能耐受放化疗副反应而失去手术的患者提供一种新的治疗方式,为这部分患者提供一个能获得根治性手术治疗的机会。
研究方法
本研究是一项前瞻性、单臂、II期临床研究(注册号:ChiCTR2200064848),纳入因自身基础或合并疾病不适合或不愿意行新辅助放化疗的可切除的局部晚期ESCC患者(临床分期为III–IVa期)。本研究采用两阶段Minimax设计,预计总样本量为40例,设定单侧α错误为0.05,当病理完全缓解率(pCR)达到16%为最小疗效阈值,预期pCR为30%,以实现80%的统计学效能。所有患者接受安罗替尼(8 mg口服,第1–14天,每3周一次)联合派安普利单抗(200 mg静脉滴注,每3周一次),共2周期。治疗结束4周后行根治性食管切除术。主要研究终点为pCR;次要终点包括客观缓解率(ORR)、疾病控制率(DCR)、R0切除率、术后并发症、肿瘤退缩等级(TRG)、主要病理缓解(MPR)率及安全性。
研究结果
2023年1月至11月期间,本研究共纳入25例患者,中位年龄67岁,92%的患者存在淋巴结转移,85%因合并基础疾病(如纯红细胞再生障碍、肺功能异常或严重营养不良)而无法接受标准新辅助方案。所有患者均完成疗效评估,ORR为48.0%,DCR达96.0%。最终有21例(84%)顺利实施手术,其中R0切除率为90.5%,pCR为19.0%,MPR率达28.6%。安全性方面,84%的患者出现不良反应,但主要为1~2级轻度事件;≥3级不良反应发生率仅为12.0%,未发生治疗相关死亡事件,整体安全性良好。
研究结论
初步数据显示,安罗替尼联合派安普利单抗的新辅助治疗方案在无法耐受传统放化疗的局部晚期ESCC患者中显示出令人鼓舞的安全性和有效性,为这类特殊患者群体提供了一种新的手术机会和治疗路径。
解读
传统新辅助同步放化疗虽已被国际指南推荐为局晚期ESCC的标准治疗方案,但临床实践中,部分高龄、营养不良或合并多系统基础疾病的患者往往无法耐受其毒性反应,进而错失根治手术机会,甚至影响生存结局。针对这一长期未被满足的临床需求,本研究创新性地提出“免疫+靶向”联合新辅助策略,避免了放化疗带来的高毒性,获得了较好的临床疗效和安全性,为这部分患者提供了新的手术机会。
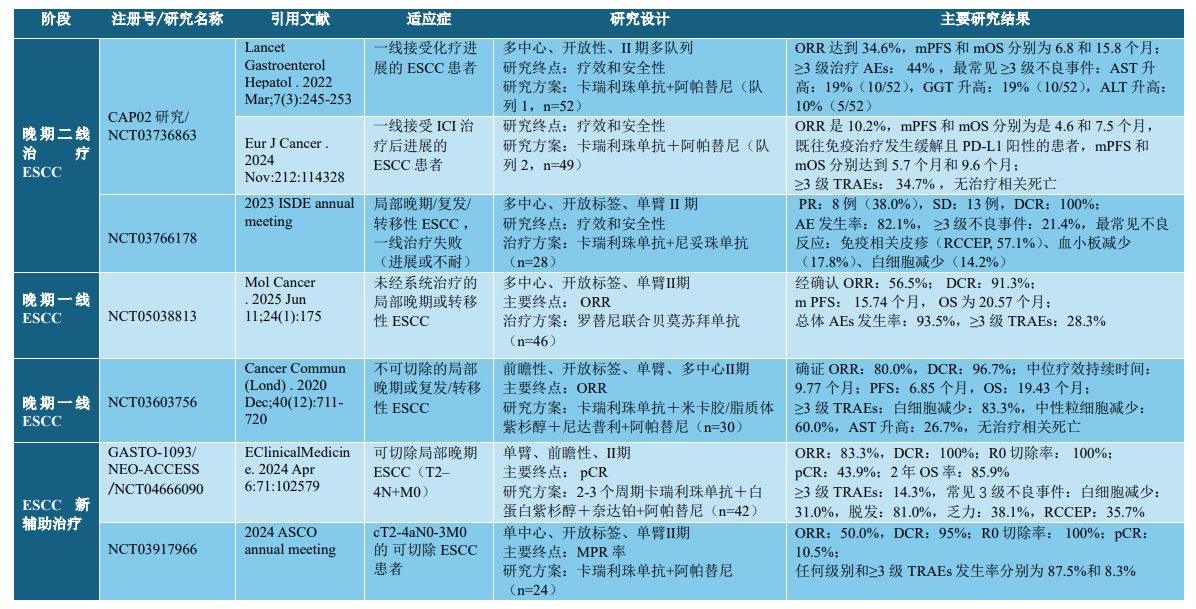
近年来,免疫联合靶向治疗因其作用机制协同、毒性较低14,已在晚期肝癌和肾癌中成为一线推荐方案。基于此,免疫联合靶向的组合在ESCC中也进行了相关的探索(详见表1)。如CAP-02研究(NCT03736863)已证实该策略在二线治疗中的可行性和初步疗效15,16,NCT0360375617和NCT0503811318研究则进一步探索了其在一线治疗阶段的安全性和有效性。本研究作为该治疗体系在新辅助阶段的首次前瞻性验证,为该路径的完整构建填补了关键空白。与既往研究比较,本研究的pCR率虽低于传统放化疗方案(如CROSS方案的25%~30%)及GASTO-1093研究19中四药联合方案的43.9%,但鉴于本研究所纳入人群的特殊性(高龄、合并症、营养差),19%的pCR率依然具有重要临床价值。此外,本方案≥3级不良反应发生率(12%)与GASTO-1093(14.3%)相当,却明显低于中科院肿瘤医院黄镜教授团队的四药联合治疗方案(NCT03603756,≥3级TRAEs达83.3%)17,安全性优势突出。因此,该方案为临床无法耐受传统方案的特殊人群提供了一种全新的可行选择。本研究对临床实践的意义在于:1)扩展手术适应证:为 CRT 禁忌或耐受差ESCC患者提供切实可行的新辅助路径,有望显著提升手术完成率;2)降低围手术期风险:去除放化疗后,围手术期并发症减少,更适合合并多种基础疾病或体能下降的患者。
本研究在临床实践中的重要意义在于,为传统新辅助治疗方案下难以获益的一类特殊人群(如高龄、合并多系统基础疾病或营养不良的患者)提供了一种可行性高、毒性可控的新辅助治疗路径,显著拓宽了术前可切除的适应证范围,并有望改善该人群的远期生存预后。未来,仍需通过前瞻性、随机对照研究进一步验证该治疗策略在临床上的获益。同时,该方案亦可作为治疗平台基础,探索与低剂量放疗或化疗的联合方案,从而在临床疗效与毒性之间实现更加精细化的平衡。此外,整合生物标志物导向的精准分层策略,如PD-L1表达、ctDNA变化、TMB水平等,有助于识别最大获益亚群,实现个体化“量体裁衣”式治疗。值得强调的是,借鉴SANO研究20提出的“主动监测+动态干预”理念,对达到临床完全缓解(cCR)的患者,结合保守治疗与动态评估的策略有望在确保疾病控制的同时,减少过度治疗风险,从而推动“器官保留”治疗模式在这一特殊ESCC人群中的早期临床转化,真正实现生存与生活质量的双重提升。
综上所述,本研究为不能耐受传统新辅助治疗的ESCC患者提供了有效替代方案,并为临床决策和未来精准治疗研究开辟了新的思路和探索空间。
表1:其他ESCC中免疫联合靶向治疗临床研究汇总
【温馨提示】:如果您觉得陈月云医生解读的好,请在下方为她点赞并将文章分享给更多的同道!当然,您也可以在下方留下您的个人见解哦!
1. van Hagen, P., et al. Preoperative chemoradiotherapy for esophageal or junctional cancer. N Engl J Med 366, 2074-2084 (2012).
2. Hong, Y., et al. Neoadjuvant Chemoradiotherapy Followed by Surgery Versus Surgery Alone for Locally Advanced Squamous Cell Carcinoma of the Esophagus (NEOCRTEC5010): A Phase III Multicenter, Randomized, Open-Label Clinical Trial. J Clin Oncol 36.
3. Hong, Y., et al. Long-term Efficacy of Neoadjuvant Chemoradiotherapy Plus Surgery for the Treatment of Locally Advanced Esophageal Squamous Cell Carcinoma: The NEOCRTEC5010 Randomized Clinical Trial. JAMA Surg 156(2021).
4. Joel, S., et al. Neoadjuvant chemoradiotherapy plus surgery versus surgery alone for oesophageal or junctional cancer (CROSS): long-term results of a randomised controlled trial. Lancet Oncol 16(2015).
5. Kojima, T., et al. Randomized Phase III KEYNOTE-181 Study of Pembrolizumab Versus Chemotherapy in Advanced Esophageal Cancer. J Clin Oncol 38, 4138-4148 (2020).
6. Sun, J., et al. Pembrolizumab plus chemotherapy versus chemotherapy alone for first-line treatment of advanced oesophageal cancer (KEYNOTE-590): a randomised, placebo-controlled, phase 3 study. Lancet 398, 759-771 (2021).
7. Luo, H., et al. Effect of Camrelizumab vs Placebo Added to Chemotherapy on Survival and Progression-Free Survival in Patients With Advanced or Metastatic Esophageal Squamous Cell Carcinoma: The ESCORT-1st Randomized Clinical Trial. JAMA 326, 916-925 (2021).
8. Lu, Z., et al. Sintilimab versus placebo in combination with chemotherapy as first line treatment for locally advanced or metastatic oesophageal squamous cell carcinoma (ORIENT-15): multicentre, randomised, double blind, phase 3 trial. BMJ 377, e068714 (2022).
9. Michael S, L., et al. Atezolizumab with or without bevacizumab in unresectable hepatocellular carcinoma (GO30140): an open-label, multicentre, phase 1b study. Lancet Oncol 21(2020).
10. Andrew X, Z., et al. Molecular correlates of clinical response and resistance to atezolizumab in combination with bevacizumab in advanced hepatocellular carcinoma. Nat Med 28.
11. Jie-Hai, Y., et al. Neoadjuvant camrelizumab plus apatinib for locally advanced microsatellite instability-high or mismatch repair-deficient colorectal cancer (NEOCAP): a single-arm, open-label, phase 2 study. Lancet Oncol 25(2024).
12. Brian I, R., et al. Pembrolizumab plus Axitinib versus Sunitinib for Advanced Renal-Cell Carcinoma. N Engl J Med 380(2019).
13. Hongyan, C., et al. Camrelizumab plus apatinib in patients with high-risk chemorefractory or relapsed gestational trophoblastic neoplasia (CAP 01): a single-arm, open-label, phase 2 trial. Lancet Oncol 22.
14. Josep M, L., et al. Immunotherapies for hepatocellular carcinoma. Nat Rev Clin Oncol 19(2021).
15. Xiangrui, M., et al. Camrelizumab plus apatinib as second-line treatment for advanced oesophageal squamous cell carcinoma (CAP 02): a single-arm, open-label, phase 2 trial. Lancet Gastroenterol Hepatol 7(2022).
16. Xiangrui, M., et al. Efficacy and safety of camrelizumab plus apatinib in patients with advanced esophageal squamous cell carcinoma previously treated with immune checkpoint inhibitors (CAP 02 Re-challenge): A single-arm, phase II study. Eur J Cancer 212(2024).
17. Bo, Z., et al. Phase II clinical trial using camrelizumab combined with apatinib and chemotherapy as the first-line treatment of advanced esophageal squamous cell carcinoma. Cancer Commun (Lond) 40(2020).
18. Xiangrui, M., et al. Anlotinib combined with benmelstobart as a chemo-free first-line treatment in advanced esophageal squamous cell carcinoma: an exploratory multicenter, single-arm phase II clinical trial. Mol Cancer 24(2025).
19. Zixiang, W., et al. Camrelizumab, chemotherapy and apatinib in the neoadjuvant treatment of resectable oesophageal squamous cell carcinoma: a single-arm phase 2 trial. EClinicalMedicine 71(2024).
20. Berend J, v.d.W., et al. Neoadjuvant chemoradiotherapy followed by active surveillance versus standard surgery for oesophageal cancer (SANO trial): a multicentre, stepped-wedge, cluster-randomised, non-inferiority, phase 3 trial. Lancet Oncol 26(2025).











 苏公网安备32059002004080号
苏公网安备32059002004080号


