病史摘要:患者,女性,59岁,2022年7月(57岁)诊断为左乳腺癌肝转移,cT2N1M1,分子分型为激素受体阳性(HR阳性)、HER2阴性,基因检测提示HER2突变,予以蒽环序贯紫衫类药物治疗后肝脏病灶消失,行姑息行左乳切除。术后患者接受多线治疗包括:周期蛋白依赖性激酶4/6抑制剂、抗血管药物、氟维司群和抗体偶联药物失败。肝脏再次活检基因检测提示HER2基因突变。
症状体征:患者无明显不适症状。左乳切除术后改变,余未见明显阳性体征。
诊断方法:患者初诊时CT提示乳腺癌肝转移。2023年9月上腹部MRI提示肝转移灶较前增大。后患者行穿刺病理诊断为(肝脏穿刺)浸润或转移性癌。外周血及肝转移灶肿瘤组织二代测序显示HER2突变。
治疗方法:患者多线治疗后选择白蛋白结合型紫杉醇联合吡咯替尼方案治疗,具体:白蛋白紫杉醇 200mg d1,d8 q3w;吡咯替尼240mg qd。
临床转归:患者多线治疗失败后,接受6个周期白蛋白结合型紫杉醇联合吡咯替尼方案治疗,最佳疗效为部分缓解(PR),肝脏病灶较前缩小明显。
适合阅读人群:乳腺内科;乳腺外科;肿瘤科;
关键词:乳腺癌;HER2基因;基因突变;吡咯替尼
引言
乳腺癌已成为威胁女性健康最常见的恶性肿瘤。对于HER2阳性乳腺癌,抗HER2联合治疗是重要的治疗方案之一。但是对于HER2阴性的乳腺癌,可能也会存在HER2基因的突变。不同于HER2的表达和扩增,HER2突变不能通过免疫组化或者荧光原位杂交技术检测到,往往经肿瘤组织或者外周血的二代测序检测到突变。我们报道1例HER2突变的HER2阴性晚期乳腺癌患者,经吡咯替尼联合治疗有效。旨在提高对HER2阴性乳腺癌可能存在HER2突变的认识,为此类患者抗HER2治疗提供新的治疗思路。
临床资料
一般资料
患者于2022年3月因发现左乳肿块、肝脏占位行乳腺和肝脏穿刺。病理诊断为(左乳)乳腺浸润性小叶癌。免疫组化:HER-2 (0), Ki-67(约+35%), ER (中等阳性,+40%), PR(-)。(肝占位穿刺标木)腺癌浸润或转移,结合免疫组化考虑为乳腺小叶癌转移。免疫组化:HER-2 (-),ER(80%+,中),PR(-),AR(90%+),Ki-67(20%)。2022年3月起行白蛋白紫杉醇(400mg, q3w)序贯脂质体多柔比星(57mg,q3w)化疗8周期。治疗后估肝转移灶消失,于2022年9月14日行左乳单切+前哨+腋清手术,术后病理示:(左乳)乳腺浸润性小叶癌,伴淋巴结转移性癌。化疗后MP评级:3级。肿瘤大小:3.2×1.0×2.0cm。免疫组化结果:Her2-B(0),ER (强阳,90%),PR(强阳,3-5%),AR(中度阳,90%),Ki-67(20%+)。(阳性淋巴结/淋巴结总数):(9/24)。术后予达尔西利+依西美坦治疗:具体:达尔西利125mg 口服 d1-21,依西美坦25mg口服 qd。2023年5月检查肝脏再次出现转移灶,评估疾病进展(PD)。
既往体健,24岁结婚,育有1女,平素月经规律,53岁绝经。否认乳腺癌、卵巢癌等肿瘤家族史。体格检查:ECOG 1分,生命体征平稳,头面部、皮肤系统、眼部、耳部、鼻部、咽喉部、口腔、呼吸系统、心血管系统、腹部、脊柱/四肢均无殊,淋巴结未触及。左乳切除术后改变,对侧未触及明显肿块。双肺未闻及明显干湿性啰音,心脏听诊未闻及病理性杂音,腹平软,无压痛,未及异常包块,移动性浊音阴性。神经系统检查(-),其余无殊。
检查
影像学检查:2023年9月27日胸盆增强CT诊断:左乳癌术后改变,术区未见明显异常占位。两肺多枚微小结节,较前大致相仿,建议随诊。两肺少量纤维灶,较前大致相仿。子宫肌瘤可能,较前相仿。部分胸腰椎椎体高密度结节,建议复查。附见:肝内稍低密度结节,请结合腹部检查。2023年9月27日上腹部增强MRI诊断:肝脏多发转移瘤(肝内见多发结节影,呈稍长T1较长T2信号,边界尚清,增强后环状强化,大者约3.0cm,)。L2信号异常,转移可能。
病理检查:乳腺肿瘤组织二代测序显示ARID1A基因7号外显子无义突变c.2368C>T(丰度6.48%)、CDH1基因10号外显子p.P461fs移码突变c.1380dup(丰度7.41%)、ERBB2基因21号外显子p.L869R错义突变c.2606T>G(丰度14.04%)、ERBB3基因23号外显子p.E928G错义突变c.2783A>G(丰度6.86%)。患者2023年10 月行超声引导下肝穿刺活检术,病理诊断为(肝脏穿刺)浸润或转移性癌。免疫组化:Her2(BC)(0)、ER(+,2%)、PR(-)、Ki-67(+,20%)、AR(+++,90%)、GATA3(弥漫强+)。外周血及肝转移灶肿瘤组织二代测序显示ERBB2(HER2) p.L869R突变(丰度49.6%)。
诊断与鉴别诊断
结合患者病史、实验室检查、影像学及病理检查诊断为(左乳)乳腺恶性肿瘤(浸润性小叶癌)cT0N0M1、肝继发恶性肿瘤、骨继发恶性肿瘤。
治疗
患者筛选入组“安罗替尼联合氟维司群治疗HR阳性、HER2阴性继发性内分泌治疗耐药的局部晚期或转移性乳腺癌患者有效性与安全性临床试验”。2023年6月-2023年8月行2周期安罗替尼联合氟维司群治疗,具体:安罗替尼 10mg 口服 d1-d14 q3w,氟维司群500mg 肌注 q4w。2周期后疗效评估疾病进展(PD)。
患者筛选入组“评价 XYD-9668-198 抗体偶联剂在晚期实体瘤患者中的安全性、 耐受性、 药代动力学特征及初步有效性的开放、多中心I/II期临床研究”,2023年8月18日起予以予XYD-9668-198药物(0.2mg/kg)2周期治疗。2周期后疗效评估疾病进展(PD)。
2023年10月6日患者行肝脏介入治疗,经导管灌注药物:白蛋白结合型紫杉醇0.2g,并注入载药微球6ml(载法玛新50mg)及碘油5ml。
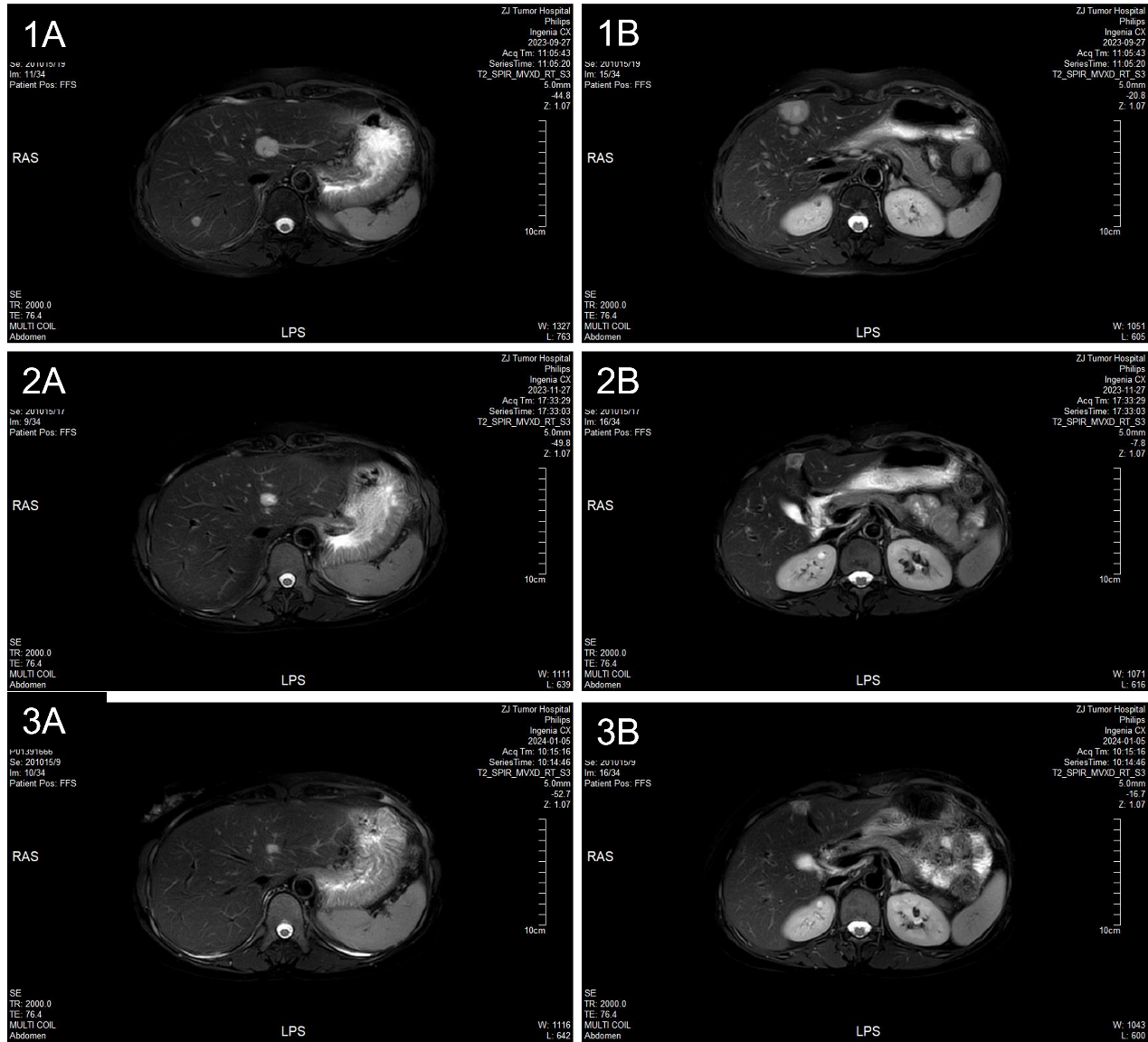
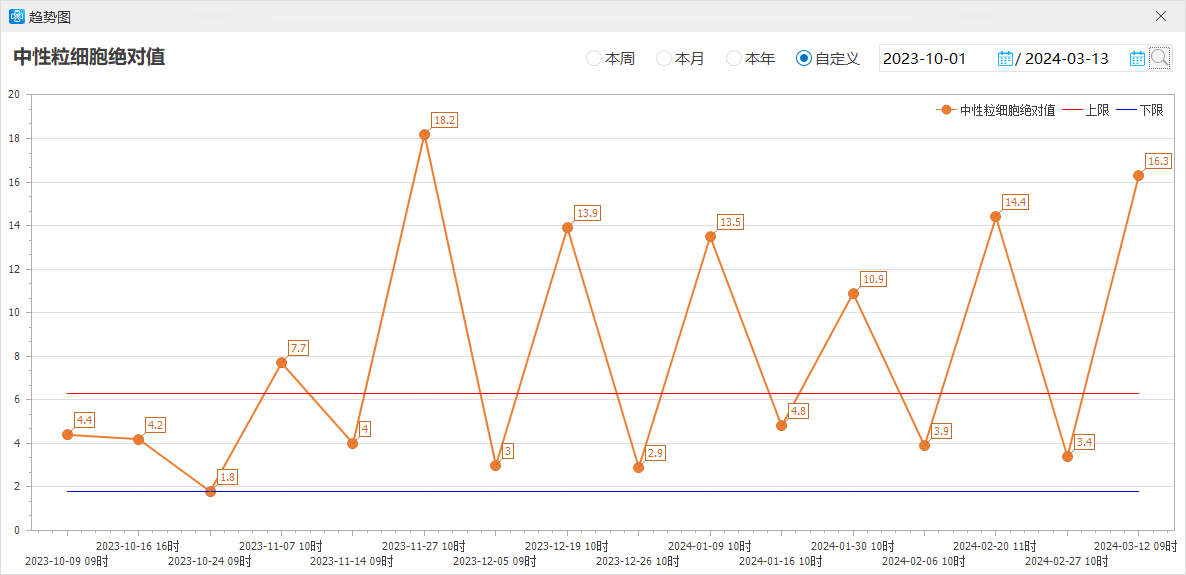
2023年10月17日起予以行白蛋白紫杉醇+吡咯替尼治疗,具体方案:白蛋白紫杉醇 200mg 静滴 d1,d8 q3w,吡咯替尼240mg 口服 qd。具体疗效见图1。患者治疗过程中出现中性粒细胞计数降低,故后续每周期第8天白蛋白紫杉醇化疗后24小时予以硫培非格司亭6mg皮下注射预防性升白治疗,期间中性粒细胞计数变化见图2。
治疗结果、随访及转归
目前患者一般状况良好,已接受6个周期白蛋白结合型紫杉醇联合吡咯替尼治疗,2024年2月16日复查超声、胸盆增强CT和上腹部MRI提示肿瘤最佳疗效为部分缓解(PR),未见进展征象,末次随访时间为2024年2月16日,无进展生存期超过4个月,将继续随访患者的无进展生存及总生存。
讨论
HER2 基因激活突变是各种癌症类型的致癌驱动因素,可以通过对肿瘤活检组织或循环游离 DNA进行二代测序来确定这些突变[1]。其中,浸润性小叶癌的突变频率高于浸润性导管癌(5.7% vs. 1.4%)[2, 3],在转移灶中的突变频率高于原发灶[4],在HER2阴性的患者中突变频率高于HER2阳性患者[5, 6],存在HER2体系突变的患者生存预后更差[7, 8]。HER2突变会过度激活HER3/PI3K/AKT/mTOR轴,从而导致激素受体阳性乳腺癌对他莫昔芬、氟维司群以及周期蛋白依赖性激酶4/6抑制剂产生耐药性[4, 9, 10]。
HER2基因突变可发生在在酪氨酸激酶域和细胞外域[11]。有学者研究了13个HER2突变的功能表征,其中7个突变是激活突变,包括G309A、D769H、D769Y、V777L、P780ins、V842I和R896C。L755S突变会产生对拉帕替尼耐药性,但这些突变都对奈拉替尼敏感[12]。另一项研究发现在携带至少一个HER2突变的9名患者中共发现12个突变,频率为L755S(25.00%)、V777L(25.00%),S310Y(16.67%)、L869R(16.67%),S310F(8.33%)和D769H(8.33%)[13]。HER2 L869R突变是一种对奈拉替尼敏感的功能增益突变,它与同样存在于乳腺癌中的突变型HER3 E928G二聚化后,会扩大HER2信号传导。[14, 15]。
HER2突变乳腺癌的治疗方式现在还没有指南明确推荐,主要还是集中于病例报告和小样本临床研究探索。
(1)不可逆的酪氨酸激酶抑制剂奈拉替尼为基础的治疗是HER2突变型乳腺癌的可选治疗选择[16, 17]。有病例报告描述了一名携带HER2 L755S突变的转移性乳腺癌患者,奈拉替尼单药治疗后出现疾病缓解,并显著改善了患者的功能状态[18]。对于内分泌治疗后出现HER2突变导致内分泌耐药的患者,加用奈拉替尼可以克服耐药[9, 19]。奈拉替尼和氟维司群对激素受体阳性HER突变的患者具有良好的抗肿瘤治疗活性[20, 21]。在SUMMIT研究中,57例HER2突变的患者接受了奈拉替尼+氟维司群+曲妥珠单抗的三药联合治疗, 客观缓解率为39%,中位无进展生存期为8.3个月[22]。
(2)HER2 L755S突变对奈拉提尼治疗耐药后,对泛HER酪氨酸激酶抑制剂波齐替尼(单独使用或与氟维司群联合使用)治疗敏感。与奈拉替尼相比,波齐替尼能更有效地降低肿瘤生长、减少多器官转移和抑制mTOR通路激活[23]。
(3)有研究报道HER2基因突变、非扩增的转移性乳腺癌患者可能会从吡咯替尼中获益[24]。一例具有 2个HER2激活突变(D769H和V777L)的转移性浸润性小叶癌患者,对吡咯替尼联合恩美曲妥珠单抗的治疗表现出显著和持久的反应[25]。靶向HER2的抗体偶联药物单药治疗在HER2突变的乳腺癌患者中也显示出令人鼓舞的结果[26]。
(4)部分HER2突变(S310F、V777L、778insGSP和L755S)患者在抗HER2治疗基础上加用依维莫司也能取得疗效[27]。本例患者选择的是白蛋白紫杉醇联合吡咯替尼治疗,患者在治疗过程中有中心粒细胞计数降低,预防性升白治疗保证了用药期间的安全和足剂量按时的治疗。
本病例的报道主要是引起对HER2突变的重视,尤其是在没有HER2扩增或过表达的浸润性小叶癌患者,在内分泌治疗耐药或其他治疗进展后建议行HER2突变检测,为后续治疗探寻潜在靶点。本病例展现了白蛋白紫杉醇联合吡咯替尼治疗方案的有效性和安全性。并且在化疗过程中,患者接受了长效升白针的预防治疗,确保了化疗的顺利进行。这一规范化的管理也是一项精细且至关重要的医疗实践,提示临床医生在探寻刚好的治疗方案的同时,应注重患者管理,以求最大化的达成治疗目标。
利益冲突声明 所有作者均声明本研究不存在利益冲突
[1] Cocco E, Lopez S, Santin A D, et al. Prevalence and role of HER2 mutations in cancer [J]. Pharmacol Ther, 2019, 199: 188-96.
[2] Kurozumi S, Alsaleem M, Monteiro C J, et al. Targetable ERBB2 mutation status is an independent marker of adverse prognosis in estrogen receptor positive, ERBB2 non-amplified primary lobular breast carcinoma: a retrospective in silico analysis of public datasets [J]. Breast Cancer Res, 2020, 22(1): 85.
[3] Lien H C, Chen Y L, Juang Y L, et al. Frequent alterations of HER2 through mutation, amplification, or overexpression in pleomorphic lobular carcinoma of the breast [J]. Breast Cancer Res Treat, 2015, 150(2): 447-55.
[4] Croessmann S, Formisano L, Kinch L N, et al. Combined Blockade of Activating ERBB2 Mutations and ER Results in Synthetic Lethality of ER+/HER2 Mutant Breast Cancer [J]. Clin Cancer Res, 2019, 25(1): 277-89.
[5] Cocco E, Javier Carmona F, Razavi P, et al. Neratinib is effective in breast tumors bearing both amplification and mutation of ERBB2 (HER2) [J]. Sci Signal, 2018, 11(551).
[6] Petrelli F, Tomasello G, Barni S, et al. Clinical and pathological characterization of HER2 mutations in human breast cancer: a systematic review of the literature [J]. Breast Cancer Res Treat, 2017, 166(2): 339-49.
[7] Wang T, Xu Y, Sheng S, et al. HER2 somatic mutations are associated with poor survival in HER2-negative breast cancers [J]. Cancer Sci, 2017, 108(4): 671-7.
[8] Si P, Chen T, Fang B, et al. HER2 exon 27 mutations predict worse survival of breast cancer patients, especially in HER2-negative patients [J]. Cancer Med, 2017, 6(12): 2832-9.
[9] Nayar U, Cohen O, Kapstad C, et al. Acquired HER2 mutations in ER(+) metastatic breast cancer confer resistance to estrogen receptor-directed therapies [J]. Nat Genet, 2019, 51(2): 207-16.
[10] Razavi P, Chang M T, Xu G, et al. The Genomic Landscape of Endocrine-Resistant Advanced Breast Cancers [J]. Cancer Cell, 2018, 34(3): 427-38 e6.
[11] Ding Q, Chen H, Lim B, et al. HER2 somatic mutation analysis in breast cancer: correlation with clinicopathological features [J]. Hum Pathol, 2019, 92: 32-8.
[12] Bose R, Kavuri S M, Searleman A C, et al. Activating HER2 mutations in HER2 gene amplification negative breast cancer [J]. Cancer Discov, 2013, 3(2): 224-37.
[13] Corne J, Quillien V, Godey F, et al. Plasma-based analysis of ERBB2 mutational status by multiplex digital PCR in a large series of patients with metastatic breast cancer [J]. Mol Oncol, 2024.
[14] Hanker A B, Brewer M R, Sheehan J H, et al. An Acquired HER2(T798I) Gatekeeper Mutation Induces Resistance to Neratinib in a Patient with HER2 Mutant-Driven Breast Cancer [J]. Cancer Discov, 2017, 7(6): 575-85.
[15] Cousin S, Khalifa E, Crombe A, et al. Targeting ERBB2 mutations in solid tumors: biological and clinical implications [J]. J Hematol Oncol, 2018, 11(1): 86.
[16] Medford A J, Dubash T D, Juric D, et al. Blood-based monitoring identifies acquired and targetable driver HER2 mutations in endocrine-resistant metastatic breast cancer [J]. NPJ Precis Oncol, 2019, 3: 18.
[17] Ma C X, Bose R, Gao F, et al. Neratinib Efficacy and Circulating Tumor DNA Detection of HER2 Mutations in HER2 Nonamplified Metastatic Breast Cancer [J]. Clin Cancer Res, 2017, 23(19): 5687-95.
[18] Ben-Baruch N E, Bose R, Kavuri S M, et al. HER2-Mutated Breast Cancer Responds to Treatment With Single-Agent Neratinib, a Second-Generation HER2/EGFR Tyrosine Kinase Inhibitor [J]. J Natl Compr Canc Netw, 2015, 13(9): 1061-4.
[19] Kourie H R, Chaix M, Gombos A, et al. Pharmacodynamics, pharmacokinetics and clinical efficacy of neratinib in HER2-positive breast cancer and breast cancer with HER2 mutations [J]. Expert Opin Drug Metab Toxicol, 2016, 12(8): 947-57.
[20] Ma C X, Luo J, Freedman R A, et al. The Phase II MutHER Study of Neratinib Alone and in Combination with Fulvestrant in HER2-Mutated, Non-amplified Metastatic Breast Cancer [J]. Clin Cancer Res, 2022, 28(7): 1258-67.
[21] Smyth L M, Piha-Paul S A, Won H H, et al. Efficacy and Determinants of Response to HER Kinase Inhibition in HER2-Mutant Metastatic Breast Cancer [J]. Cancer Discov, 2020, 10(2): 198-213.
[22] Jhaveri K, Eli L D, Wildiers H, et al. Neratinib + fulvestrant + trastuzumab for HR-positive, HER2-negative, HER2-mutant metastatic breast cancer: outcomes and biomarker analysis from the SUMMIT trial [J]. Ann Oncol, 2023, 34(10): 885-98.
[23] Kalra R, Chen C H, Wang J, et al. Poziotinib Inhibits HER2-Mutant-Driven Therapeutic Resistance and Multiorgan Metastasis in Breast Cancer [J]. Cancer Res, 2022, 82(16): 2928-39.
[24] Yi Z, Rong G, Guan Y, et al. Molecular landscape and efficacy of HER2-targeted therapy in patients with HER2-mutated metastatic breast cancer [J]. NPJ Breast Cancer, 2020, 6: 59.
[25] Tian H, Qu M, Zhang G, et al. Dramatic Response to Pyrotinib and T-DM1 in HER2-Negative Metastatic Breast Cancer With 2 Activating HER2 Mutations [J]. Oncologist, 2023, 28(7): e534-e41.
[26] Mu Y, Meng Y, Du Y, et al. Clinical characteristics and treatment outcomes of HER2 mutation and HER2 fusion in 22 patients with advanced breast cancer [J]. Thorac Cancer, 2023, 14(34): 3381-8.
[27] Ma J, Li X, Zhang Q, et al. A novel treatment strategy of HER2-targeted therapy in combination with Everolimus for HR+/HER2- advanced breast cancer patients with HER2 mutations [J]. Transl Oncol, 2022, 21: 101444.
排版编辑:肿瘤资讯-黄洋洋











 苏公网安备32059002004080号
苏公网安备32059002004080号

