病史摘要:患者女,45岁,因“发现左乳肿块1月余”收入院。
症状体征:患者左侧乳房外下乳晕旁一个2.0×1.5cm的肿物,质地硬,边界不够清晰,表面不光滑,但可以活动。右侧乳房没有触及明显的肿物。在腋窝、颈部和锁骨上也未触及明显肿大的淋巴结。这些体征可能提示乳腺方面的问题,需要进一步的检查和评估以确认诊断。
诊断方法:经影像学检查诊断为左乳癌及多发骨转移,且肝组织病理学分析支持其乳腺来源。
治疗方法:2016年1月21日,患者接受左乳癌的改良根治手术。手术后,进行了TC方案的四周期化疗,并辅以他莫昔芬进行内分泌治疗。然而,随后出现了肝转移和骨转移,继续进行晚期内分泌维持治疗。
临床转归:患者的病情长时间维持稳定,PFS(无进展生存期)长达49个月。这表明患者对治疗方案有良好的反应,并且该治疗方案在控制疾病进展方面取得了显著的效果。
适合阅读人群:乳腺科,肿瘤科
关键词:乳腺癌;肝转移;骨转移;内分泌治疗
前言
乳腺癌是全球女性最常见的恶性肿瘤之一,而激素受体(HR)阳性乳腺癌则是其中最常见的亚型,约占全部乳腺癌的70%。内分泌治疗一直是HR+乳腺癌治疗的关键。在这方面,我们报道了一例HR(+)、HER2(-)晚期乳腺癌的案例,该患者接受了一线CDK4/6抑制剂联合内分泌治疗;期间因发生中性粒细胞减少,硫培非格司亭(PEG-rhG-CSF)的预防性治疗,最最终的综合治疗下,患者取得了显著的PFS(无进展生存期)和OS(总生存期)改善。这一治疗策略的成功应用使患者能够尽可能早地获得长期生存的益处。
临床资料
一般资料
患者女,45岁,既往史:否认“肝炎、结核”等传染病史,否认“高血压、心脏病、糖尿病”病史,否认输血史,否认食物过敏源史。预防接种随社会。无不良烟酒。婚育史:孕3产1,未绝经。家族史:无恶性肿瘤家族史,体表面积:1.65m2。2016年1月21日:行左乳癌改良根治术。术后行TC方案四周期化疗,患者在治疗过程中出现中性粒细胞减少,在化疗结束后给予硫培非格司亭(PEG-rhG-CSF)防止患者出现感染风险。他莫昔芬辅助内分泌治疗。后出现肝转移,骨转移,进行晚期内分泌维持治疗。
检查
2016年1月7日双乳X线检查显示左侧乳腺属于BI-RADS 5类,右侧乳腺则显示为增生症。
双乳超声检查显示左侧乳腺体层呈低回声,为BI-RADS 4c类,右侧乳腺符合乳腺增生症的特征。腋下及锁骨上淋巴结未见明显异常肿大,内脏未显示转移征象。血常规、肝肾功能以及肿瘤标志物检查均未显示明显异常。
术后病理报告显示左侧乳腺为浸润性导管癌,肿物大小为2.0×1.5×1.0cm,组织分级为Ⅱ级。乳头及基底均呈阴性,腋窝淋巴结无转移。免疫组化显示ER(雌激素受体,95%+)、PR(孕激素受体,80%+)、HER-2(2+)以及ki-67(10%+)。FISH检测结果显示HER-2未扩增。术后诊断为左侧乳癌 pT1N0M0 I期 Luminal A型。
2019年3月行头部、胸部和上腹部的增强CT检查,结果显示肝右叶前段存在占位,考虑为转移瘤。然而在头颅及双肺未见明确转移灶。此外,左1前肋显示骨质破坏,不排除骨转移可能性。进行全身骨扫描显示全身多发骨转移。另进行左胸壁、右乳以及淋巴引流区的超声检查,未发现异常。
肝穿刺病理结果显示肝组织内存在腺癌润;免疫组化检查结果支持其来源于乳腺,ER(70%,中阳)、PR(50%,中阳)、HER-2(1+)、ki-67(30%+)以及GATA3(+)。
诊断与鉴别诊断
已有术后病理及穿刺病理,诊断明确,无需鉴别。
治疗
在2016年1月21日,该患者完成了左侧乳腺癌的改良根治性手术。术后,她接受了包括环磷酰胺(600mg/m²,第一天给药)和多西他赛(75mg/m²,第一天给药)在内的TC化疗方案,根据她的体表面积1.65m²,完成了四个周期的治疗。此外,患者还进行了辅助内分泌治疗,每天口服一次他莫昔芬20mg。
在接受四个周期的TC方案化疗期间,患者经历了中性粒细胞减少的副作用。化疗结束后,为了降低感染风险,她接受了硫培非格司亭(PEG-rhG-CSF)的预防性治疗。中性粒细胞减少症是由骨髓抑制性化疗引起的一种常见不良反应,与患者的感染风险及生命危险紧密相关。这种情况可能导致化疗剂量的减少或治疗延迟,降低治疗效果,增加严重感染或死亡的风险。通常,标准剂量的化疗会导致中性粒细胞减少持续6至8天,且约20%至30%的患者因发热性中性粒细胞减少症(FN)需要住院治疗。在中国,如果中性粒细胞减少症持续时间超过21天,感染发生率会显著增加。FN患者中,超过60%的人会出现感染或隐性感染,超过20%的人会发展为菌血症,FN的死亡率相对较高,实体瘤、淋巴瘤和白血病患者的FN致死率分别为8.0%、8.9%和14.3%[1]。
在晚期乳腺癌的治疗中,患者采用了一线内分泌治疗联合CDK4/6抑制剂Palbociclib。Palbociclib的给药剂量为每日125mg,连续21天,休息7天,疗程/28天。同时患者接受了全面的治疗方案,其中包括在每个治疗周期的首日注射氟维司群500毫克,以及每28天进行一次唑来膦酸4毫克的静脉注射。除此之外,为了进一步降低疾病复发的可能性,患者还采取了预防性措施,进行了双侧卵巢切除手术。
治疗结果、随访及转归
治疗后,患者肿瘤病灶明显缩小,定期在医院复查,一般情况良好。如图1、表1。
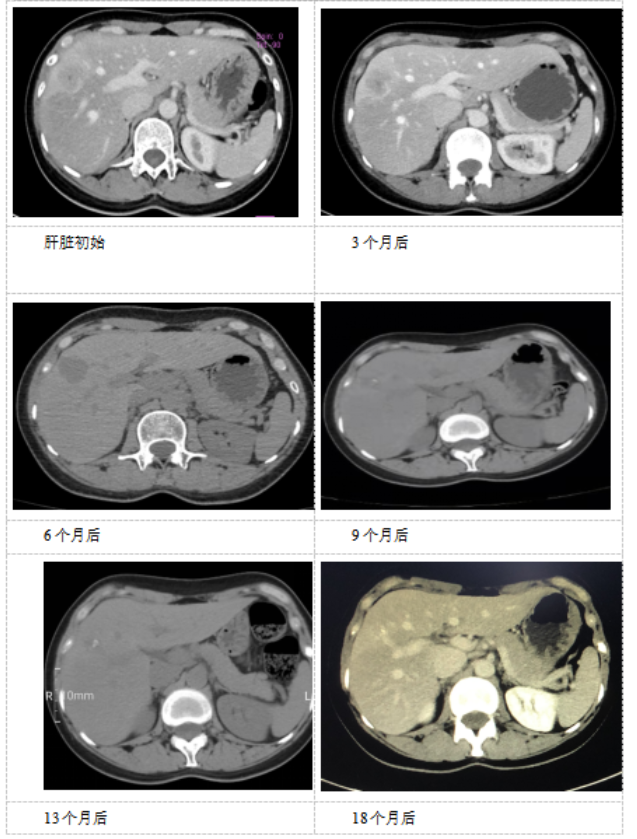
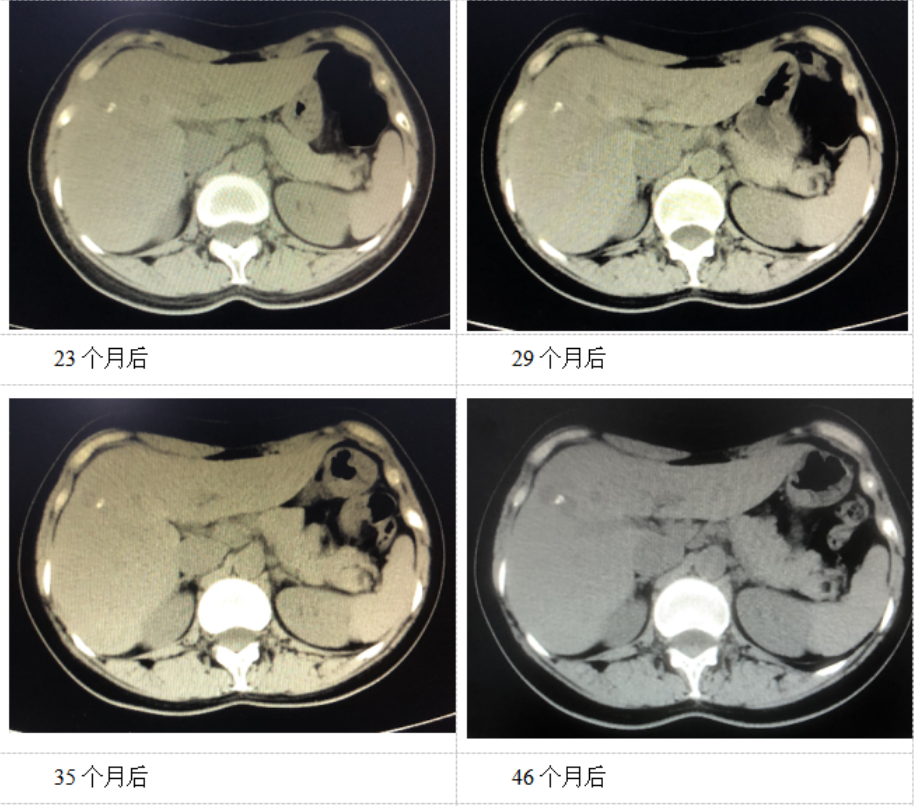 图1. 患者腹部CT影像
图1. 患者腹部CT影像
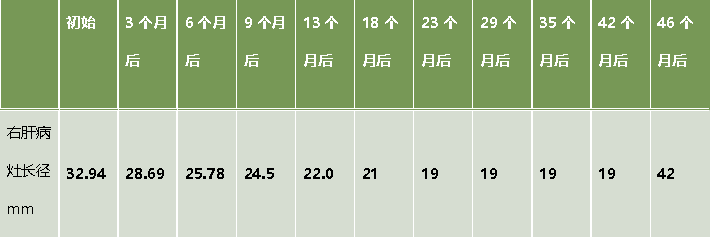 表1. 患者肝脏病灶大小
表1. 患者肝脏病灶大小
讨论
乳腺癌在全球范围内是女性最常见的恶性肿瘤类型,其中约70%的病例为激素受体(HR)阳性乳腺癌,这一亚型是乳腺癌中最普遍的[2]。对于HR+乳腺癌,内分泌治疗历来是治疗的核心,而近些年,CDK4/6抑制剂、抗体药物偶联物(ADC)、免疫检查点抑制剂等创新药物也陆续投入使用,尤其是它们与内分泌治疗的联合应用,在乳腺癌的新辅助、辅助及晚期治疗中取得了显著的成效[3]。
特别是在HR阳性乳腺癌的晚期治疗领域,CDK4/6抑制剂加内分泌治疗组合已经成为首选的一线治疗方案。根据欧洲医学会(ESMO)和中国抗癌协会(CBCS)的指南,这一方案被推荐为晚期内分泌敏感患者的首选治疗。当涉及到CDK4/6抑制剂联合内分泌治疗的选择时,PARSIFAL研究的结果表明,使用氟维司群或芳香酶抑制剂,无论是在无进展生存期(PFS)还是总生存期(OS)方面,均未显示出显著差异。考虑到氟维司群需要通过肌肉注射给药,因此建议对芳香酶抑制剂敏感的患者群体优先考虑使用CDK4/6抑制剂联合芳香酶抑制剂进行治疗。
尽管内分泌治疗取得了显著进展,但治疗过程中的耐药问题仍然是一个挑战。内分泌耐药可能与生长因子信号通路(如PI3K/Akt/mTOR)或雌激素受体途径(如ESR1突变)的改变有关,研究表明,靶向PI3K或ESR1可能有助于逆转内分泌耐药。对于在CDK4/6抑制剂治疗后失效的晚期HR+/HER2-乳腺癌患者,多种ADC药物表现出明显优势[3]。然而,如何选择不同靶点的ADC药物,以及在更换ADC药物后的疗效和毒性累积等问题,还需要进一步的研究。此外,新型靶向药物如PI3K抑制剂、AKT抑制剂和新型口服SERD等的联合应用也展现出巨大的研究潜力。未来,随着对乳腺癌分子机制的深入理解,以及新药物和治疗策略的不断开发,我们有望为HR阳性乳腺癌患者提供更加个性化和有效的治疗选择。同时,也需要进一步的研究来探索不同药物的最佳联合方案,以及如何克服治疗耐药性,从而进一步提高患者的生活质量和生存期。
另外,在患者接受治疗的过程中,由于化疗药物对骨髓造血功能的抑制作用,中性粒细胞减少症(CIN)是一种常见的副作用。这种症状不仅会增加患者感染的风险,还可能导致化疗剂量的减少或治疗的延迟,进而影响患者的治疗效果和预后。特别是在发生了中性粒细胞减少伴发热(FN)的情况下,患者的并发症风险会显著增加,需要及时的医疗干预。为了预防这种风险,患者接受了硫培非格司亭(PEG-rhG-CSF)的预防性治疗。通过这项治疗和监测措施,患者的治疗进程得到了优化,生存期和生活质量得到了显著改善。
[1] 中国乳腺癌内分泌治疗专家共识专家组.中国乳腺癌内分泌治疗专家共识(2015年版)[J].中国癌症杂志,2015,25(09):755-760.
[2] 中国乳腺癌内分泌治疗专家共识专家组.中国乳腺癌内分泌治疗专家共识(2015年版)[J].中国癌症杂志,2015,25(09):755-760.
[3] 张立,王涌,郭宇.内分泌治疗耐药的激素受体阳性晚期乳腺癌的治疗研究进展[J].肿瘤,2018,38(01):78-83.
[4] Zheng QF, Wang SS. [Treatment strategies for patients with resistant advanced breast cancer to CDK4/6 inhibitors]. Zhonghua Yi Xue Za Zhi. 2023 Sep 12;103(34):2652-2656. Chinese. doi: 10.3760/cma.j.cn112137-20230517-00815. PMID: 37675539.
排版编辑:肿瘤资讯-Olivia











 苏公网安备32059002004080号
苏公网安备32059002004080号


