乳腺癌是我国女性发病率最高的恶性肿瘤,严重威胁着女性的生命健康。人表皮生长因子受体2(HER2)是乳腺癌的重要驱动基因之一。与其他分子分型的乳腺癌比,HER2阳性乳腺癌具有更高的浸润性、更早的复发和转移时间,患者的预后往往较差。令人欣慰的是,随着抗HER2靶向治疗的不断发展,HER2阳性乳腺癌患者的预后已经得到了显著改善。但即便是接受新辅助治疗的早期乳腺癌患者,45%~66%仍术后残留浸润性病灶[1],即便患者在接受新辅助治疗后达到病理完全缓解(pCR),仍有5%~10%的患者在术后3年内会出现疾病复发[2]。为了进一步改善患者生存,临床团队考虑采用奈拉替尼强化辅助治疗策略来进一步降低患者复发转移风险。本文特别分享一例具有高复发风险的HER2阳性乳腺癌患者的治疗经历。该患者在接受了6周期的TCbHP方案新辅助治疗后,顺利完成了右乳癌改良根治术。术后病理结果显示pCR。但鉴于患者术前基线评估肿瘤负荷较大,且存在腋窝淋巴结转移,术前分期cT2N2M0,为了进一步降低疾病复发的风险,该患者在完成术后12周期的HP双靶辅助治疗及局部放疗后,继续接受为期1年的奈拉替尼强化辅助治疗。目前,患者仍在坚持治疗中,病情稳定,一般情况良好。
病例分享
中国医科大学航空总医院 乳腺外科
南昌大学外科学硕士
北京健康促进会中青年委员
中国医药教育协会肿瘤化学治疗专业青年委员
参与国家自然科学基金及省部级基金多项,发表SCI论文4篇,中文核心论文3篇。长期从事肿瘤科研、临床工作,专注乳腺疾病综合治疗。擅长乳腺良、恶性疾病个体化、规范化治疗;乳腺恶性肿瘤全程管理
病例介绍
患者:女,年龄69岁。
主诉:发现右乳腺肿物2月余。
家族史:无特殊。
既往史:既往健康。高血压病2级,很高危组,血压最高170/85mmHg,平素血压控制满意,口服琥珀酸美托洛尔缓释片 47.5mg qd + 苯磺酸左氨氯地平 2.5mg qd治疗。否认2型糖尿病等慢性疾病史。否认肝炎、否认结核病等传染病史。否认手术史。否认外伤史。否认输血史。否认药物过敏史、否认食物过敏史、否认其他接触物过敏史。
个人史:无特殊。
现病史:患者2月余前无意间发现右乳腺肿物。查体见:双侧乳房柔软,右乳11-12点方向,距乳头3.0cm可触及肿物,约2.5×3.0cm,质中,表面欠光滑,与周围组织界限不清楚,活动度差,无明显压痛,挤压乳头未见明显液体流出;右侧腋窝可触及2-3枚淋巴结,已融合,不可推动,大小约2×2cm,双侧锁骨上未触及肿大淋巴结。
乳腺超声结果示(2023-11-15):双乳结构层次清晰,于右乳可见一低回声结节,结节位于约11-12点位,距乳头约3. 1cm处,大小约2.3×2.7×1.8cm,边界欠清,形态不规则,呈角样改变,内可见多发点状强回声,结节周围导管无扩张(图1)。
乳腺MRI结果示(2023-11-20):双乳呈散在纤维类腺体型,双乳实质背景呈轻度强化,双乳皮肤无增厚,乳头无凹陷。右乳上象限中央区见大小约2.14×2.61×1.75cm长T1稍长T2信号肿块影,边界欠清,可见浅分叶,DWI呈高信号,ADC值减低约0.95个单位,动态增强扫描病变不均匀强化,时间-信号强化曲线呈Ⅲ型早期强化晚期廓清型,病变周围血管影稍增多、增粗。左乳腺未见明显异常强化病灶(图2);右侧腋窝多发肿大淋巴结,较大者约2.03×2.56cm,增强后呈明显欠均匀强化。左侧腋窝未见明显肿大淋巴结影(图3)。
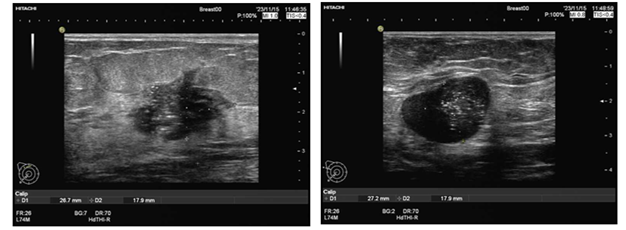 图1 乳腺超声结果(2023-11-15)
图1 乳腺超声结果(2023-11-15)
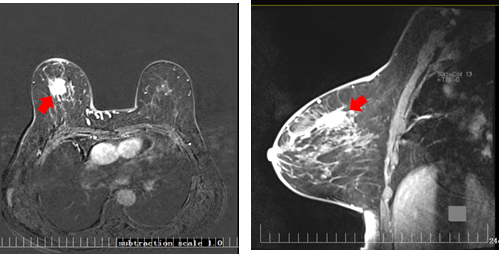 图2 乳腺MRI结果(2023-11-20)
图2 乳腺MRI结果(2023-11-20)
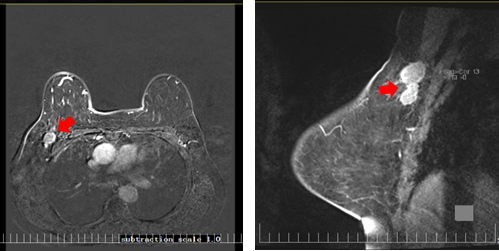 图3 乳腺MRI结果(腋窝淋巴结)(2023-11-20)
图3 乳腺MRI结果(腋窝淋巴结)(2023-11-20)
(右乳)穿刺活检结果示:乳腺浸润性癌,伴中级别导管原位癌;见可疑脉管内癌栓。右侧腋窝淋巴结穿刺可见转移癌。免疫组化结果:ER(-),PR(-),HER-2(3+,对照组3+),Ki-67(+30%),ECadherin(+),P120(膜+),GATA3(+),SOX-10(-),EMA(弱+),MUC1(弱+),Calponin(-), CD10(-),CK5/6(-),P63(-),SMA(-),CD31(内皮细胞+)。
临床诊断:
右乳癌(cT2N2M0,ⅢA期),分子分型:HER2阳性型
腋窝淋巴结继发恶性肿瘤
肺结节
肾上腺腺瘤
甲状腺肿物
脂肪肝
宫腔息肉
高血压
治疗经过
一、新辅助治疗:
2023年11月23日-2024年3月18日,行6周期TCbHP方案新辅助治疗,具体药物为:白蛋白紫杉醇(0.25g,D1,8)+洛铂(30mg,D1,8)+曲妥珠单抗(首次剂量560mg,维持剂量420mg,D1,Q3W)+帕妥珠单抗(首次剂量840mg,维持剂量420mg,D1,Q3W)。
治疗期间复查乳腺MRI(2024-02-15)示:双乳呈散在纤维类腺体型,双乳实质背景呈轻度强化,双乳皮肤无增厚,乳头无凹陷。右乳12点病变大小约1.4×2.3×1.0cm,较基线变化明显,病灶呈长T1稍长T2信号,边界欠清,可见浅分叶,DWI呈高信号,ADC值减低,动态增强扫描病变不均匀强化,病变周围血管影稍增多、增粗。左乳腺未见明显异常强化病灶(图4)。右侧腋窝多发小淋巴结,较大病灶为0.6cm,较基线变化明显。左侧腋窝未见明显肿大淋巴结影(图5)。
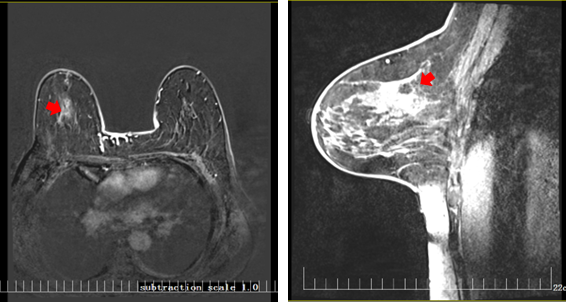 图4 乳腺MRI结果(2024-02-15)
图4 乳腺MRI结果(2024-02-15)
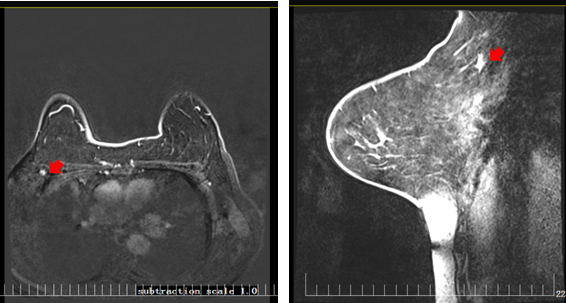 图5 乳腺MRI结果(腋窝淋巴结)(2024-02-15)
图5 乳腺MRI结果(腋窝淋巴结)(2024-02-15)
乳腺超声(2024-03-08)示:双乳结构层次清晰。于右乳可见一低回声结节,结节位于约11-12点位,距乳头约3.2cm处,大小约0.4×0.8×0.5cm,边界不清,形态不规则,边缘可见毛刺样改变,内可见多发点状强回声,纵横比>1, 结节周围导管无扩张。CDFI:周边可见少量血流信号。右侧腋下可见淋巴结,内部呈多发点状强回声,大小约0.8×0.5cm,内未见明显血流信号。左侧腋窝未见明显肿大淋巴结(图6)。
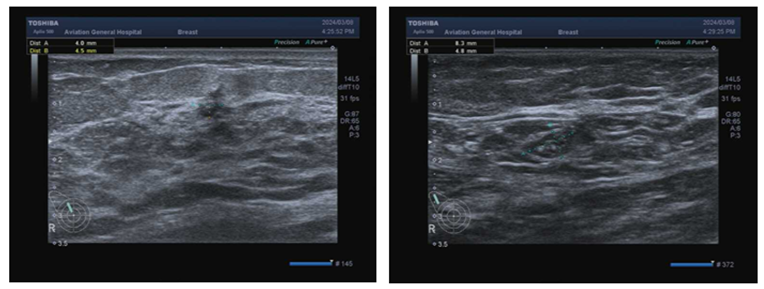 图6 乳腺超声结果(2024-03-08)
图6 乳腺超声结果(2024-03-08)
二、手术治疗:
2024年4月10日,患者行右乳单纯切除术+腋窝淋巴结清扫。
术前穿刺活检结果示:HR-/HER2+,术前分期为(cT2N2M0,ⅢA期)。
术后病理示:乳房内未见肿瘤细胞;乳腺内及乳头、皮肤均未见癌;未见明确脉管癌栓及神经侵犯;腋窝淋巴结未见转移癌(0/25),其中2枚见化疗反应;送检各组淋巴结未见转移癌(0/5)。(肩胛下血管旁)0/1、(胸长神经旁软组织)0/3、(胸小肌下方及腋尖软组织)0/1、(肌间软组织、胸小肌外侧缘软组织)为纤维脂肪组织,未见转移癌。MP分级:G5级;RCB分级:0级。
疗效评估:tpCR。
三、辅助治疗:
2024年4月29日-2024年11月25日,行12周期的HP双靶方案辅助治疗,具体用药方案为:曲妥珠单抗(420mg,D1,Q3W)+帕妥珠单抗(420mg,D1,Q3W)。
2024年5月20日起,给予局部放疗,25次,2Gy/次。
四、强化辅助治疗:
2024年12月16日,开始为期1年的奈拉替尼强化辅助治疗,采用剂量递增方案,具体用药剂量为:第1周,120g(3片)/d;第2周,160mg(4片)/d;第3周起,240mg(6片)/d。
用药第一个月,患者不良反应为腹泻,采用洛哌丁胺治疗,转归良好。
目前患者治疗近半年,一般情况良好。
专家点评
中国医科大学航空总医院 乳腺外科主任
北京乳腺病防治学会内科专业委员会常委
北京乳腺病防治学会姑息与康复专业委员会常委
北京健康促进会乳腺癌防治专家委员会常委
中国老年保健医学研究会女性健康分会常务委员
北京乳腺病防治学会国际与合作专业委员会委员
中国抗癌协会肿瘤外科微创专业委员会常委
北京中西医慢病防治促进会乳腺癌精准防治全国专家委员会常务委员
中国医疗保健国家交流促进会乳腺癌分会委员
中国医药教育协会乳腺疾病专业委员会委员
北京肿瘤学会乳腺外科专业委员会委员
北京性腺轴疾病防治研究会监事北京市卫生健康委员会健康科普专家
北京围手术期医学研究会乳腺外科专业委员会委员
北京市卫生健康委员会健康科普专家
北京癌症防治学会乳癌个体化诊疗及MDT专业委员会委员
专业特长:
1、擅长疾病:擅长乳腺疾病诊治,尤擅长以手术为主的乳腺癌综合治疗
2、擅长技术:独创环乳晕美容切口处理良性肿瘤、恶性肿瘤、男性乳腺发育、浆细胞性乳腺炎取得极佳的美容效果
不容忽视——HER2阳性乳腺癌的高复发风险
抗HER2治疗为基础的药物治疗,已经成为HER2阳性早期乳腺癌的基础方案。有效的新辅助治疗,可以获得更高的pCR。多项研究表明,pCR患者较非pCR者拥有更长的无病生存期(DFS)和总生存期(OS)[3,4]。然而,高达20%的pCR患者最终会出现疾病复发[4]。一项探索pCR乳腺癌患者复发风险因素的回顾性研究结果显示[4],初始肿瘤负荷及组织学类型可作为预测pCR患者复发风险的重要指标。与其他患者相比,三阴性乳腺癌(TNBC)和 HER2+/HR-乳腺癌的DFS显著缩短(TNBC vs HER2-/HR+:HR=1.49,95% CI 1.03-2.17,p=0.036 ;HER2+/HR- vs HER2-/HR+:HR=1.61,95% CI 1.06-2.45,p=0.027)。确诊时淋巴结转移、肿瘤较大、cT3/4、小叶癌为pCR患者最不利的危险因素,肿瘤负荷亦是非常重要的风险因素。
本例患者在确诊时已出现腋窝淋巴结继发恶性肿瘤。在接受了6个周期的TCbHP新辅助治疗后,患者顺利完成了手术治疗,术后病理显示达到pCR。鉴于患者术前基线评估肿瘤负荷较大,且存在右侧腋窝淋巴结转移,术前分期cT2N2M0,病情较晚,患者存在较高复发转移风险。尽管目前国内外对术后pCR人群强化辅助治疗用药并无相关指南推荐和研究数据,为进一步降低患者的复发转移风险、改善其长期生存,遵循个体化治疗原则,临床考虑在完成辅助治疗后对该患者进行强化辅助治疗。
双管齐下——奈拉替尼强化辅助治疗的临床获益
ExteNET研究评估了奈拉替尼在接受了曲妥珠单抗辅助治疗后的HER2阳性早期乳腺癌患者中的疗效和安全性。研究结果显示,在接受曲妥珠单抗辅助治疗后,继续使用奈拉替尼进行为期1年的强化辅助治疗,可以显著降低侵袭性复发风险:意向性治疗(ITT)人群的2年、5年疾病复发风险分别降低了33%和27%[5,6]。而对于在完成曲妥珠单抗辅助治疗后6个月内开始奈拉替尼治疗的患者,即使是HR阴性也能取得显著的临床获益。相比HR阳性患者,HR阴性患者的复发时间更早,复发风险更高,总体预后更差。数据显示,HR+/HER2+乳腺癌患者的5年生存率为91.5%,而HR-/HER2+乳腺癌患者的5年生存率为85.7%[7]。此外,研究发现,在达到pCR的cT3/4 HER2阳性乳腺癌患者中,HR阴性亚组的复发和死亡风险更高[4]。临床应尽早开始强化辅助治疗,以降低患者的复发风险。
多国家、前瞻性、非干预性研究——ELEANOR研究纵向观察奈拉替尼术后强化辅助治疗的临床应用。期中分析显示[8],截止2023年8月5日,300例入组患者中286例患者至少有一次奈拉替尼治疗记录(主要分析集【MAS】),288例奈拉替尼经治患者至少进行了一次基线后安全性评估(安全性分析集【SAF】)。其中,110例(47.6%)接受新辅助治疗的患者达到pCR,并接受了新辅助后抗HER2治疗。数据截止时,59例患者(20.5%)仍在接受奈拉替尼强化辅助治疗,142例患者(49.3%)完成了治疗,87例(30.2%)患者提前停止了奈拉替尼治疗。奈拉替尼强化辅助治疗的中位持续时间为11.9个月。
安全性方面,奈拉替尼的整体安全性良好,3/4级不良事件发生率较低[5,6],治疗最常见的不良反应为腹泻[5,6]。腹泻也是酪氨酸激酶抑制(TKI)类药物在临床治疗过程中最常见的不良反应之一。它不仅可能降低患者的生活质量,还可能成为临床安全用药的制约因素。为了有效管理这一不良反应,CONTROL研究进一步探索了奈拉替尼强化辅助治疗过程中采用预防性给予止泻药物或剂量递增方式预防腹泻。研究结果表明[9],预防性给与洛哌丁胺(在首剂奈拉替尼给药时开始洛哌丁胺预防性用药:第1~14天,4mg/次 tid;第15~56天,4mg/次 bid;第57-365天,按需使用)或通过剂量递增给药模式(奈拉替尼第1~7天:120 mg/d;第8~14天:160 mg/d;此后240 mg/d;洛哌丁胺按需使用)可有效降低奈拉替尼治疗相关的腹泻发生率。其中,奈拉替尼剂量递增治疗组≥3级腹泻的发生率最低(仅13%),患者治疗持续时间一般接近计划的1年,至少75%患者接受奈拉替尼治疗超过11.1个月。
ELEANOR研究结果亦显示[10],与ExteNET研究相比,预防性止泻和/或使用剂量递增方式预防腹泻可以明显降低≥3级腹泻的发生比例(20.3% vs 39%)。我国首个关于奈拉替尼强化辅助治疗的真实世界研究——NER-Tree研究正在中国29家中心中开展[11]。研究纳入了500例完成曲妥珠单抗为基础的辅助治疗并计划接受1年奈拉替尼强化辅助治疗的HER2阳性早期乳腺癌患者。所有患者将接受奈拉替尼强化辅助治疗12个月,并随访12个月。截止2023年9月21日,共250例患者被纳入分析,84例(33.6%)患者接受了新辅助治疗,其中33例(39.3%)患者达到pCR,所有患者均接受了辅助治疗。该研究将为奈拉替尼治疗中国早期HER2阳性乳腺癌患者提供更多数据支持。
基于上述研究数据,本例患者在完成12周期曲帕双靶辅助治疗后,临床团队继续为其制定了为期1年的奈拉替尼强化辅助治疗方案,并采用剂量递增给药模式以优化治疗体验。在用药的第一个月,患者出现了腹泻症状,经洛哌丁胺治疗后症状明显改善。截至目前,患者病情稳定,整体状况良好,我们将继续关注患者的病情变化,为患者高质量、长生存保驾护航。
[1] Geyer CE Jr, Untch M, Huang CS, et al. Survival with Trastuzumab Emtansine in Residual HER2-Positive Breast Cancer. N Engl J Med. 2025;392(3):249-257. doi:10.1056/NEJMoa2406070.
[2]Valenza C, Trapani D, Loibl S, Chia SKL, Burstein HJ, Curigliano G. Optimizing Postneoadjuvant Treatment in Patients With Early Breast Cancer Achieving Pathologic Complete Response. J Clin Oncol. 2024 Jul 10;42(20):2372-2376.
[3]中国临床肿瘤学会乳腺癌专家委员会, 中国抗癌协会乳腺癌专业委员会. 人表皮生长因子受体 2阳性乳腺癌临床诊疗专家共识(2021版)[J]. 中华医学杂志, 2021, 101(17): 1226-1231. DOI: 10.3760/cma.j.cn112137-20210318-00679.
[4]Jens Huober, Marion van Mackelenbergh, Andreas Schneeweiss, et al.Identifying breast cancer patients at risk of relapse despite pathological complete response after neoadjuvant therapy[J]. npj Breast Cancer (2023)9:23.
[5]Chan A, Delaloge S, Holmes FA, et al. Neratinib after trastuzumab-based adjuvant therapy in patients with HER2-positive breast cancer (ExteNET): a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2016;17(3):367-377.
[6]Martin M, Holmes FA, Ejlertsen B, et al. Neratinib after trastuzumab-based adjuvant therapy in HER2-positive breast cancer (ExteNET): 5-year analysis of a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2017;18(12):1688-1700.
[7] What You Should Know About HER2+ Breast Cancer Survival Rates
[8] Bartsch R, Harbeck N, Wrobel D, et al. Interim analysis of 300 patients with HER2+/HR+ early breast cancer enrolled in the multi-national, prospective, observational, non-interventional study ELEANOR treated with extended adjuvant neratinib in clinical routine. 2024ESMO BC,116p.
[9] Chan A, Ruiz-Borrego M, Marx G,et al. Final findings from the CONTROL trial: Strategies to reduce the incidence and severity of neratinib-associated diarrhea in patients with HER2-positive early-stage breast cancer. Breast. 2023 Feb;67:94-101.
[10] Bartsch R, Harbeck N, Wrobel D, et al. Interim analysis of 300 patients with HER2+/HR+ early breast cancer enrolled in the multi-national, prospective, observational, non-interventional study ELEANOR treated with extended adjuvant neratinib in clinical routine. 2024ESMO BC,116p.
[11] Zhang J, Liu H, Liu X, et al. A multicenter, prospective, non-interventional study to investigate the treatment patterns of neratinibin Human Epidermal Factor Receptor 2 positive (HER2+) early breast cancer in China: NER-Tree study .An interim analysis on patient characteristics and pretreatment patterns. Annals of Oncology.2024ESMO BC,118p.
排版编辑:TanRongbing











 苏公网安备32059002004080号
苏公网安备32059002004080号


