尽管辅助内分泌治疗(ET)可显著降低早期激素受体阳性(HR+)乳腺癌患者的复发风险,但约30%-44%的患者因副作用提前终止治疗。通过基因组学进行分类不能使临床医生有望通过个体化治疗策略避免治疗不足或过度。
近期,一项发表于Clinical Cancer Research上的研究[1]提示,通过调整乳腺癌指数(BCI)模型,可在未经辅助治疗的HR+淋巴结阴性(N0)患者中识别出10年远处复发风险极低(<5%)的群体。这一发现为临床决策提供了重要依据,使部分患者可能缩短内分泌治疗周期。【肿瘤资讯】在此对文章进行整理,以飨读者。
研究背景
在诊断后的10年内,高达44%的绝经后HR+早期乳腺癌患者会出现疾病复发[2]。25多年来,辅助ET一直是降低这一人群复发风险的标准治疗[3,4]。1998年,EBCTCG的一项荟萃分析显示,与使用1年或2年他莫昔芬相比,使用5年他莫昔芬的患者复发率显著降低,生存率也有所提高[3]。随后,芳香化酶抑制剂的辅助使用得到了ATAC和BIG 1-98试验的支持,这些试验表明,与他莫昔芬相比,芳香化酶抑制剂可降低复发率并改善无病生存率[5,6]。
然而,辅助内分泌治疗可能并不适用于所有患者[2,7]。此外,治疗可能伴随的风险包括:芳香化酶抑制剂可能引发骨毒性及心血管事件,而他莫昔芬可能增加子宫癌和深静脉血栓的风险。两种药物的耐受性通常较差[3,5,6,8]。Hershman等人的研究发现,约30%开始内分泌治疗的患者提前停药,另有30%继续治疗的患者未能完全依从[9]。另一项针对老年患者的研究表明,超过36%的患者提前终止治疗,其中60%是由于毒性[10]。因此,需要经过验证的生物标志物来指导临床决策,并通过识别复发风险极低的患者,使他们可以安全地避免辅助内分泌治疗的不良反应,从而实现个性化治疗。
BCI是一种基于基因表达的标志物,可提供预测性[11-14]和预后性[13-16]结果,以帮助早期、HR+乳腺癌患者在辅助治疗(5年后)的临床决策中延长内分泌治疗。BCI的预测成分包括HOXB13/IL17BR(H/I)比值,这是一种内分泌反应生物标志物,可预测延长内分泌治疗的获益可能性[11,13,16,17]。BCI的预后评分报告了总体(诊断后0-10年)和晚期(诊断后>5年)远处复发的个体化风险,该评分通过结合BCI(H/I)和分子分级指数(MGI)的算法计算得出,MGI通过5个细胞周期基因检测增殖途径[14,16,18]。BCI被纳入美国国立综合癌症网络(NCCN)和美国临床肿瘤学会(ASCO)的临床实践指南,用于辅助治疗延长的临床决策[4,19]。
此前,BCI已被证明可以识别乳腺癌特异性生存(BCSS)良好的患者[20]。当前研究分析了前瞻性、随机的斯德哥尔摩STO-3研究的未治疗组,以确定一个额外的BCI临界值,以识别即使不接受任何辅助系统治疗,10年远处复发风险极低的患者群[16]。该临界值在斯德哥尔摩STO-3的治疗患者中以及荷兰癌症登记处(NCR)未接受任何辅助内分泌治疗的患者队列中得到了前瞻性验证。
研究方法
研究设计与纳入人群
斯德哥尔摩STO-3试验:纳入1976-1990年接受手术±他莫昔芬的HR+ N0患者(未治疗组283例,治疗组317例)。
荷兰癌症登记(NCR):纳入2003-2009年≥70岁、未接受ET或化疗的HR+ N0患者(n=1245)。
BCI检测与风险分层
BCI评分通过RT-qPCR检测肿瘤组织基因表达(HOXB13/IL17BR比值及分子分级指数),新增截断值3.0定义极低风险组(10年复发风险<5%)。
风险分层:极低风险(BCI<3.0)、低风险(3.0≤BCI<5.1)、中风险(5.1≤BCI<6.5)、高风险(BCI≥6.5)。
统计学分析
主要终点为10年远处复发率,采用Kaplan-Meier分析、Cox比例风险模型及Fine-Gray竞争风险模型。
研究结果
患者特征
从荷兰癌症登记处(NCR)收集了1284名患者的肿瘤样本。排除39个肿瘤含量不足或不符合资格标准的样本后,最终数据集包括1245名未接受任何辅助内分泌治疗(ET)的患者。
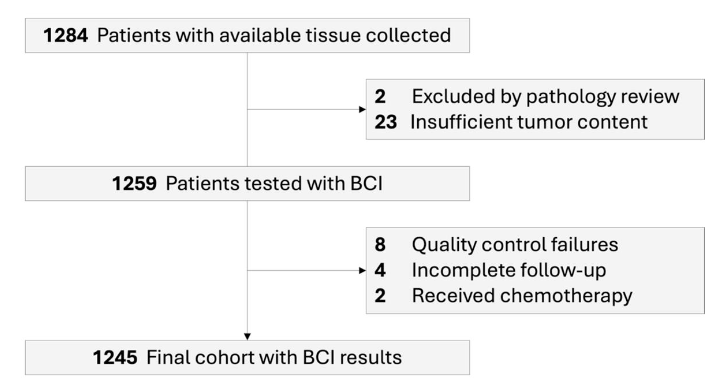
斯德哥尔摩队列的大多数患者年龄小于70岁(未治疗组96.8%;治疗组96.2%);而NCR队列的所有患者年龄均≥70岁。与NCR队列(55.0%)相比,斯德哥尔摩队列中T1肿瘤患者的比例更高(未治疗组81.3%;治疗组81.7%)。斯德哥尔摩和NCR队列的中位随访时间分别为17年和12.6年。
BCI最小风险临界值的确定
使用斯德哥尔摩队列的未治疗患者(n = 283)来细化预后风险分层,以识别即使在未接受任何辅助ET的情况下,远处复发风险极低的低风险患者亚群。选择一个新的BCI临界值3.0,以确保10年远处复发风险低于5%;低于此临界值的患者构成最小风险组。 在斯德哥尔摩未治疗队列(n = 283)中,49名(17.3%)、107名(37.8%)、74名(26.1%)和53名(18.7%)患者分别被分类为最小风险、低风险、中等风险和高风险。相应的10年远处复发风险分别为2.3%(95% CI,0.0-6.6)、15.5%(95% CI,7.9-22.5)、19.8%(95% CI,9.5-28.9)和35.9%(95% CI,20.4-48.4)(表1)。
表1 斯德哥尔摩和NCR队列中四个BCI风险组的预后表现
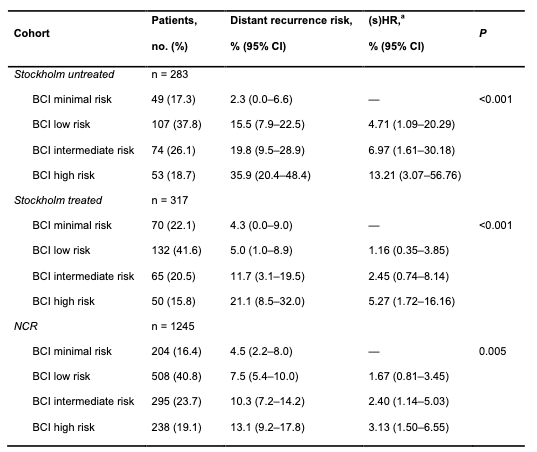
调整后的BCI模型对远处复发具有显著的预后意义(P < .001),与最小风险相比,低风险、中等风险和高风险的HR分别为4.71(95% CI,1.09-20.29)、6.97(95% CI,1.61-30.18)和13.21(95% CI,3.07-56.76)(表1)。
BCI最小风险临界值的验证
使用斯德哥尔摩队列的治疗患者(n = 317)来评估ET在BCI风险组中的获益。BCI将70名(22.1%)、132名(41.6%)、65名(20.5%)和50名(15.8%)患者分别分类为最小风险、低风险、中等风险和高风险,相应的10年远处复发风险分别为4.3%(95% CI,0.0-9.0)、5.0%(95% CI,1.0-8.9)、11.7%(95% CI,3.1-19.5)和21.1%(95% CI,8.5-32.0)(表1)。HR分别为1.16(95% CI,0.35-3.85)(低风险)、2.45(95% CI,0.74-8.14)(中等风险)和5.27(95% CI,1.72-16.16)(高风险)(P < .001)(表1)。
在斯德哥尔摩队列中,被分类为低风险、中等风险和高风险的患者从他莫昔芬治疗中获得了绝对获益,远处复发风险分别降低了10.5%、8.1%和14.8%。相比之下,被分类为最小风险的患者未从辅助他莫昔芬治疗中获益(-2.0%)。 EBCTCG分析显示,在HR+ HER2-乳腺癌中,长期持续复发风险远超10年(23)。斯德哥尔摩队列的长期随访(中位随访时间17年)也允许估算15年远处复发风险。如预期,最小风险组的15年风险对于未治疗和治疗患者分别为4.7%(95% CI,0.0-10.8)和5.8%(95% CI,0.1-11.2),高于10年风险。
BCI最小风险临界值的独立验证
调整后的BCI模型在NCR队列的患者中进行了外部验证。该队列中无患者接受辅助ET或辅助化疗。在整体队列(n = 1245)中,204名(16.4%)、508名(40.8%)、295名(23.7%)和238名(19.1%)患者分别被分类为最小风险、低风险、中等风险和高风险(图2A,表1)。相应的10年远处复发风险分别为4.5%(95% CI,2.2-8.0)、7.5%(95% CI,5.4-10.0)、10.3%(95% CI,7.2-14.2)和13.1%(95% CI,9.2-17.8)(图2A,表1)。sHR分别为1.67(95% CI,0.81-3.45)(低风险)、2.40(95% CI,1.14-5.03)(中等风险)和3.13(95% CI,1.50-6.55)(高风险)(P = .005)(图2A,表1)。
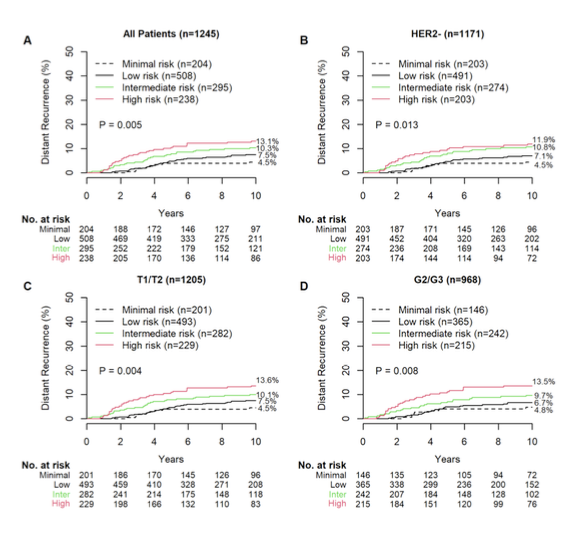
调整模型的预后性能评估
进一步在相关临床亚组中评估了调整后模型的预后性能。在HER2-疾病患者(n = 1171)中,最小风险、低风险、中等风险和高风险的10年远处复发风险分别为4.5%(95% CI,2.2-8.0)、7.1%(95% CI,5.0-9.6)、10.8%(95% CI,7.4-14.8)和11.9%(95% CI,7.9-16.8)(图2B)。sHR分别为1.58(95% CI,0.76-3.28)(低风险)、2.48(95% CI,1.18-5.21)(中等风险)和2.93(95% CI,1.37-6.25)(高风险)(P = .013),死亡为竞争风险事件。 在T1-T2疾病患者(n = 1205)中,最小风险、低风险、中等风险和高风险的10年远处复发风险分别为4.5%(95% CI,2.2-8.1)、7.5%(95% CI,5.4-10.1)、10.1%(95% CI,6.9-14.0)和13.6%(95% CI,9.5-18.4),死亡为竞争风险事件(图2C)。sHR分别为1.65(95% CI,0.80-3.41)(低风险)、2.31(95% CI,1.09-4.87)(中等风险)和3.22(95% CI,1.54-6.73)(高风险)(P = .004)。 在2/3级疾病患者(n = 968)中,最小风险、低风险、中等风险和高风险的10年远处复发风险分别为4.8%(95% CI,2.1-9.2)、6.7%(95% CI,4.4-9.6)、9.7%(95% CI,6.3-13.9)和13.5%(95% CI,9.4-18.5)(图2D)。sHR分别为1.39(95% CI,0.60-3.20)(低风险)、2.05(95% CI,0.89-4.76)(中等风险)和3.10(95% CI,1.37-7.01)(高风险)(P = .008)。 为了调查BCI是否在传统临床病理因素之外提供了独立的预后信息,进行了单变量和多变量Fine-Gray模型分析。肿瘤大小和BCI风险评分在单变量和多变量分析中均对10年远处复发具有显著的预后意义。因此,BCI风险评分在标准预后因素之外提供了额外的独立预后信息,sHR为2.19(1.28-3.74;似然比χ2 = 7.98;P = .004)。
研究讨论
本研究首次通过BCI识别出约20%的HR+ N0患者,其10年远处复发风险<5%,且无法从辅助ET中获益。与70基因检测(MammaPrint)相比,BCI直接以远处复发(而非乳腺癌特异性生存)为终点,更贴近临床需求。此外,NCR队列的高龄患者虽因竞争风险(高死亡率)可能低估复发率,但统计模型已校正这一偏倚。
局限性包括NCR队列缺乏停药原因记录及年轻患者数据不足。未来需验证BCI在年轻人群中的适用性及长期复发风险。
从该研究可见,调整后的BCI模型为HR+ N0乳腺癌患者提供了个体化治疗决策工具。对极低风险患者,可考虑缩短ET疗程以降低副作用负担,尤其适用于耐受性差或合并症较多的老年患者。
[1]Marie-France Jilderda, Yi Zhang, Valerie Rebattu, et al. Identification of Early-Stage Breast Cancer with Minimal Risk of Recurrence by Breast Cancer Index. Clin Cancer Res. 2025 Mar 27. doi: 10.1158/1078-0432.CCR-24-3836.
[2]Early Breast Cancer Trialists' Collaborative G, ., Davies C, Godwin J, Gray R, Clarke M, Cutter D, et al. Relevance of breast cancer hormone receptors and other factors to the efficacy of adjuvant tamoxifen: patient-level meta-analysis of randomised trials. Lancet 2011;378(9793):771-84 doi 10.1016/S0140-6736(11)60993-8.
[3]Early Breast Cancer Trialists' Collaborative Group. Tamoxifen for early breast cancer: an overview of the randomised trials. Early Breast Cancer Trialists' Collaborative Group. Lancet 1998;351(9114):1451-67 doi 10.1016/S0140-6736.
[4]National Comprehensive Cancer Network (NCCN). NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines). Breast cancer. Version 4.2024. 2024.
[5]Arimidex Tamoxifen Alone or in Combination Trialists' Group, Forbes JF, Cuzick J, Buzdar A, Howell A, Tobias JS, et al. Effect of anastrozole and tamoxifen as adjuvant treatment for early-stage breast cancer: 100-month analysis of the ATAC trial. Lancet Oncol 2008;9(1):45-53 doi 10.1016/S1470-2045(07)70385-6.
[6]Breast International Group 1-98 Collaborative Group, Thurlimann B, Keshaviah A, Coates AS, Mouridsen H, Mauriac L, et al. A comparison of letrozole and tamoxifen in postmenopausal women with early breast cancer. N Engl J Med 2005;353(26):2747-57 doi 10.1056/NEJMoa052258.
[7]Early Breast Cancer Trialists' Collaborative Group. Aromatase inhibitors versus tamoxifen in early breast cancer: patient-level meta-analysis of the randomised trials. Lancet 2015;386(10001):1341-52 doi 10.1016/S0140-6736(15)61074-1.
[8]Davies C, Pan H, Godwin J, Gray R, Arriagada R, Raina V, et al. Long-term effects of continuing adjuvant tamoxifen to 10 years versus stopping at 5 years after diagnosis of oestrogen receptor-positive breast cancer: ATLAS, a randomised trial. Lancet 2013;381(9869):805-16 doi 10.1016/S0140-6736(12)61963-1.
[9]Hershman DL, Kushi LH, Shao T, Buono D, Kershenbaum A, Tsai WY, et al. Early discontinuation and nonadherence to adjuvant hormonal therapy in a cohort of 8,769 early-stage breast cancer patients. J Clin Oncol 2010;28(27):4120-8 doi 10.1200/JCO.2009.25.9655.
[10] Lemij AA, de Glas NA, Derks MGM, Bastiaannet E, Merkus JWS, Lans TE, et al. Discontinuation of adjuvant endocrine therapy and impact on quality of life and functional status in older patients with breast cancer. Breast Cancer Res Treat 2022;193(3):567-77 doi 10.1007/s10549-022-06583-7.
[11]Bartlett JMS, Sgroi DC, Treuner K, Zhang Y, Piper T, Salunga RC, et al. Breast Cancer Index Is a predictive biomarker of treatment benefit and outcome from extended tamoxifen therapy: final analysis of the Trans-aTTom study. Clin Cancer Res 2022;28(9):1871-80 doi 10.1158/1078-0432.CCR-21-3385.
[12]Noordhoek I, Treuner K, Putter H, Zhang Y, Wong J, Meershoek-Klein Kranenbarg E, et al. Breast Cancer Index predicts extended endocrine benefit to individualize selection of patients with HR(+) early-stage breast cancer for 10 years of endocrine therapy. Clin Cancer Res 2021;27(1):311-9 doi 10.1158/1078-0432.CCR-20-2737.
[13]Sgroi DC, Carney E, Zarrella E, Steffel L, Binns SN, Finkelstein DM, et al. Prediction of late disease recurrence and extended adjuvant letrozole benefit by the HOXB13/IL17BR biomarker. J Natl Cancer Inst 2013;105(14):1036-42 doi 10.1093/jnci/djt146.
[14]Zhang Y, Schroeder BE, Jerevall PL, Ly A, Nolan H, Schnabel CA, et al. A novel Breast Cancer Index for prediction of distant recurrence in HR(+) early-stage breast cancer with one to three positive nodes. Clin Cancer Res 2017;23(23):7217-24 doi 10.1158/1078- 0432.CCR-17-1688.
[15]Bartlett JM, Xu K, Wong J, Pond G, Zhang Y, Spears M, et al. Prognostic performance of Breast Cancer Index (BCI) in postmenopausal women with early-stage HR+ breast cancer in the TEAM trial. Abstract 138MO. Annals of Oncology 2022;33:S602 doi 10.1016/j.annonc.2022.07.173.
[16]Zhang Y, Schnabel CA, Schroeder BE, Jerevall PL, Jankowitz RC, Fornander T, et al. Breast Cancer Index identifies early-stage estrogen receptor-positive breast cancer patients at risk for early- and late-distant recurrence. Clin Cancer Res 2013;19(15):4196- 205 doi 10.1158/1078-0432.CCR-13-0804.
[17]Bartlett JMS, Sgroi DC, Treuner K, Zhang Y, Ahmed I, Piper T, et al. Breast Cancer Index and prediction of benefit from extended endocrine therapy in breast cancer patients treated in the Adjuvant Tamoxifen-To Offer More? (aTTom) trial. Ann Oncol 2019;30(11):1776-83 doi 10.1093/annonc/mdz289.
[18]Sgroi DC, Sestak I, Cuzick J, Zhang Y, Schnabel CA, Schroeder B, et al. Prediction of late distant recurrence in patients with oestrogen-receptor-positive breast cancer: a prospective comparison of the breast-cancer index (BCI) assay, 21-gene recurrence score, and IHC4 in the TransATAC study population. Lancet Oncol 2013;14(11):1067-76 doi 10.1016/S1470-2045(13)70387-5.
[19]Andre F, Ismaila N, Allison KH, Barlow WE, Collyar DE, Damodaran S, et al. Biomarkers for adjuvant endocrine and chemotherapy in early-stage breast cancer: ASCO Guideline update. J Clin Oncol 2022;40(16):1816-37 doi 10.1200/JCO.22.00069.
[20]Kaklamani VG, Poage GM, Fornander T, Nordenskjold B, Stål O, Zhang Y, et al. Genomic stratification with BCI of ER+ early breast cancer patients with limited long-term risk of breast cancer death. Journal of Clinical Oncology 2018;36(15_suppl):516- doi 10.1200/JCO.2018.36.15_suppl.516.
审批码:KIS0044386
排版编辑:肿瘤资讯-CYX











 苏公网安备32059002004080号
苏公网安备32059002004080号


