新辅助治疗为人表皮生长因子受体2(HER2)阳性乳腺癌患者带来了显著的预后改善,但仍有45%~66%的早期乳腺癌患者在新辅助治疗后存在浸润性病灶,并面临较高的复发和死亡风险[1]。如何优化此类患者的辅助治疗策略,降低术后复发和转移风险,一直是临床探索的重点。本文特别分享了一例HER2阳性早期乳腺癌患者的治疗经历。该患者新辅助治疗6周期后,在全麻下接受了左乳癌改良根治术。术后病理检查结果显示存在少量残留病灶。为了进一步降低复发和死亡风险,临床给予恩美曲妥珠单抗(T-DM1)辅助治疗,并配合辅助放疗。然而,在治疗过程中,由于患者副反应到了TDM-1停药指征,患者因惧怕血小板降低拒绝继续T-DM1辅助治疗。经过临床团队的综合讨论,决定改用奈拉替尼强化辅助治疗,为期1年。目前,患者仍在治疗过程中,病情稳定,且耐受性良好。
病例分享
宁波市第二医院乳腺外科病区
肿瘤学博士
宁波市高级人才
宁波市医学会乳腺疾病分会青委
浙江省医师协会乳腺肿瘤专业委员会青委
天津市医疗健康委员会乳腺疾病专委会委员
病例介绍
患者:女。
主诉:发现左乳肿物半年余。
家族史:无特殊。
既往史、个人史:既往体健,无其他基础疾病。
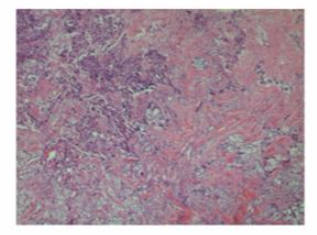
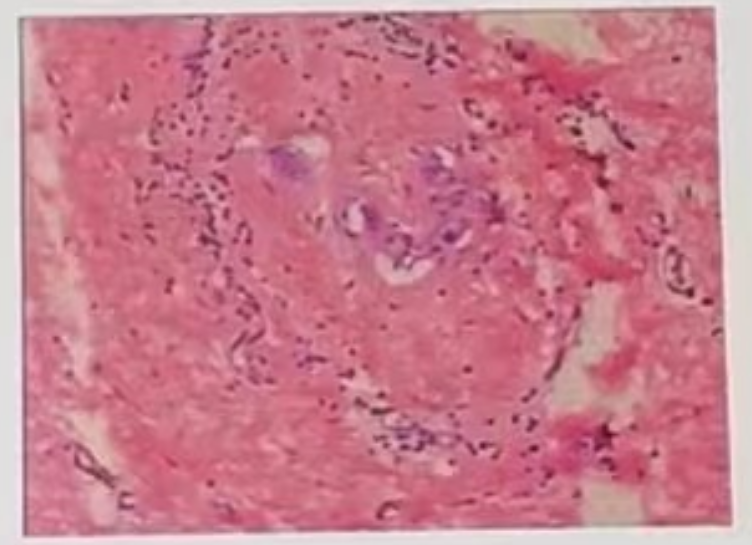
现病史:患者半年前发现左乳肿物,当时未予重视,肿块缓慢增大,2周前于我院行左乳肿物穿刺活检,病理提示(图1):(左乳腺肿块)浸润性导管癌,Ⅱ级,部分为导管原位癌,未见明确脉管及神经侵犯,免疫组化:AR(+约60%弱-中等), ER(克隆号SP1):(-), Ki-67(+约35%), CK5/6(-), D2-40(-), E-Cadherin(+), PR(克隆号1E2):(-), P120(膜+), Her2 BC(4B5)(3+), p63+CKpan(-/+), GATA-3(+), P53(克隆号DO-7):(正常着色), Mammaglobin(+), Calponin(-)。查体示:双乳对称,左侧乳腺下象限距离乳头2.0cm可触及一4.5×3.0cm肿块,质硬,边界欠光滑,界限欠清,无压痛,酒窝征阴性,桔皮征阴性;右侧乳腺未触及明显肿块;双侧乳头无凹陷,无溢液,左乳腋下可触及肿大淋巴结,质硬,较大者2.5cm,活动;右侧腋窝及双侧锁骨上未及明显肿块,余浅表淋巴结未及肿大。
实验室检查:血常规、血生化、心肺功能均未见异常。肿瘤标志物:糖类抗原15-3:19.30 U/Ml(正常范围≤19.0 U/Ml)。
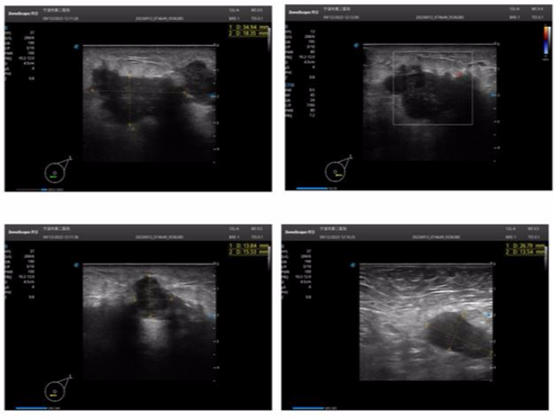
影像学检查:乳房、腋下、锁骨上超声示(图2):双侧乳腺组织可见片状不规则分布,局部组织增厚,结构紊乱,左侧乳腺下象限可见大小约为35×18mm、14×15mm的低回声,界不清,形态欠规则,呈蟹足状,周边成角,CDFI:内未见明显血流信号;左侧腋下见数个低回声,大者约27×13mm,界清,形态尚规则,淋巴门结构不清,未见血流信号,右侧腋下移行扫查未见明显肿大淋巴结回声;双侧锁骨上未见明显肿大淋巴结。
乳腺X线示(图3):两侧乳腺呈纤维腺体不均质致密型(c类),腺体大致对称分布,呈斑片状及类结节状不均密度增高影分布,边界模糊,层次欠清楚,左乳内下象限见团块影,边缘不规则,范围约32×20mm,内见簇状分布细小钙化影,余双乳腺体内目前未见明确占位,右乳内侧象限可见数枚粗点状、细点状钙化影。双乳皮肤乳头正常。所示两侧腋下未见明显肿大的淋巴结影。

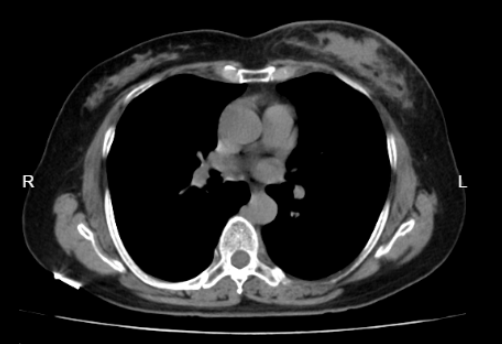
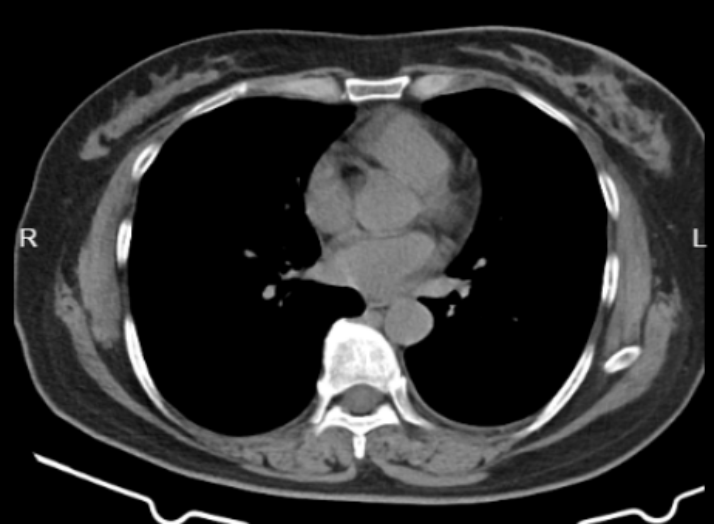
胸部CT示(图4):左乳占位伴左腋下多发肿大淋巴结;两肺纹理略增多,右肺上叶胸膜下区可见钙化影,余肺实质密度均匀,未见明显异常密度占位影;两肺门结构尚清,纵隔居中,其内未见明显肿大淋巴结影;两侧胸腔、心包腔内未见明显积液影;心影无殊。
腹部超声、头颅MRI、全身骨扫描均未提示转移。
临床诊断:左乳腺癌cT2N2M0 HER2(+)。
治疗经过
一、新辅助治疗:
2023年9月23日-2024年1月7日,行6周期的TCbHP方案治疗,具体治疗药物及剂量为: 曲妥珠单抗(首次496mg,后续372mg)+帕妥珠单抗(首次840mg,后续420mg)+多西他赛120mg+卡铂650mg 每三周重复。治疗过程顺利,患者耐受可。
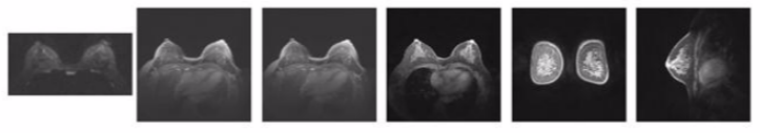
治疗期间每2周期评估疗效,可见病灶退缩明显。2024年1月9日,复查乳腺MRI(图5)示:两侧乳腺为纤维腺体不均质致密型(c类),腺体两侧分布欠对称,腺体呈团片状、类结节不均信号影,部分略浓聚,左乳内下象限段局部片状异常信号影,边界不清,范围约为30×25mm,弥散未见明显受限,增强早期少许类环样强化,MIP序列强化持续、部分强化轻度退出,周边血管略丰富;余双乳内多发斑片、类结节样渐进性强化,双乳皮肤乳头正常。所示两侧腋下未见明显肿大的淋巴结影。
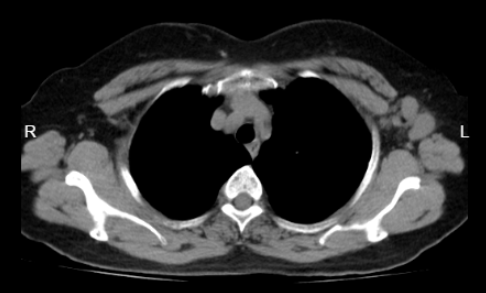
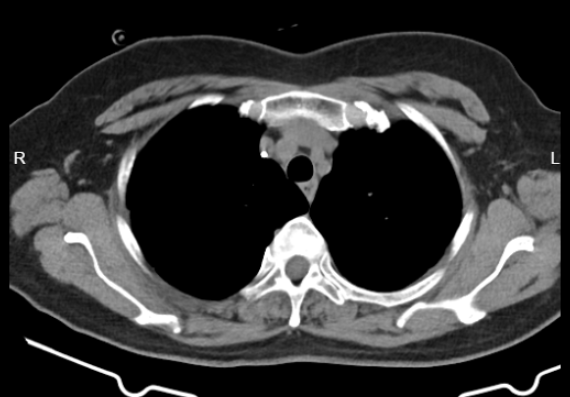
胸部CT示(图6):左乳占位及左腋下多发肿大淋巴结较前明显缩小;右肺上叶钙化灶,中叶少许慢性炎症考虑,较2023-09-12片相仿,建议必要时复查。
术前腹部超声、头颅MRI均未提示转移。
疗效评价:PR。
二、手术治疗:
2024年01月22日,排除手术禁忌后,患者于全麻下行左乳癌改良根治术。术后病理示: (左)乳腺浸润性导管癌,组织学Ⅱ级,Miller-Payne分级:4级,腋窝淋巴结(6/15)枚见化疗反应,免疫组化:p63+CKpan(-/+),ER(克隆号SP1):(+),PR(克隆号1E2):(+),Her2 BC(4B5)(无法评判),Ki-67(+<5%)。
术后诊断:左乳腺癌 yPT1miN0M0。
疗效评价:未达到病理学完全缓解(non-pCR)。
三、术后放疗及强化辅助治疗:
2024年2月22日,开始进行T-DM1辅助治疗,具体方案:T-DM1 200mg 每三周重复。辅助治疗期间完成左侧胸壁+内乳淋巴结、锁骨上下淋巴结引流区放疗。治疗过程中,患者的血小板下降明显,需要预防性血小板生成素(TPO)维持,血小板计数控制在55×109/L左右。
2024年10月17日,在完成第11周期的TDM-1辅助治疗后,患者血小板计数低至10×109/L,TPO联合血小板生成素受体激动剂(TPO-RA)治疗不能好转,于血液科住院,输血联合激素冲击治疗后血小板计数回升至20×109/L。由于副反应到了TDM-1停药指征,患者因惧怕血小板降低拒绝继续T-DM1辅助治疗。
2024年12月5日,患者复查血小板计数升至:35×109/L,结合术前免疫组化结果,于2024年12月12日开始给予奈拉替尼口服强化辅助治疗——奈拉替尼起始剂量为每日3片,此后每周递增1片,直至达到每日6片的目标剂量,并持续维持至1年治疗周期结束。并预防性使用洛哌丁胺止泻治疗。
目前,患者耐受较好,2024年1月28日复查血小板计数:92×109/L。
专家点评
宁波市第二医院医院乳腺外科主任
浙江省医师协会乳腺肿瘤专业委员会副主任委员
浙江省抗癌协会乳腺癌分会副主任委员
中国医药教育协会浙江乳腺癌分会常委
浙江省抗癌协会理事会理事
宁波市医学会乳腺疾病分会顾问
乳腺癌是女性最常见的恶性肿瘤之一。我国女性乳腺癌的发病高峰年龄较欧美国家要提前约10年,主要集中于45~54岁[2],大多处于绝经前期。这一群体对生活质量和生存预后的期望更高,因此,在治疗策略上需要更加精准化、个体化。
荆棘载途,新辅助治疗后non-pCR患者具有高复发转移风险
在临床中,15%~20%的早期浸润性乳腺癌为HER2阳性[3]。HER2高表达是乳腺癌预后不良的重要预测因素之一。既往研究发现,在不同分子亚型的乳腺癌中,HER2阳性乳腺癌患者的术后局部复发和远端转移风险最高,约为20.2%[4]。而抗HER2治疗的突破始于首个单克隆抗体曲妥珠单抗的问世。此后,随着新的治疗策略和模式的不断发展,患者的生存率得到了显著提高。近年来,多项研究显示,HER2阳性早期乳腺癌患者在接受新辅助治疗后,若达到病理学完全缓解(pCR),可显著延长总生存期(OS)和无疾病生存期(DFS),故包括NCCN指南和CSCO指南在内的权威指南均推荐,具有新辅助治疗指征的HER2阳性早期乳腺癌患者应接受曲妥珠单抗联合化疗等方案进行新辅助治疗[5,6]。本例患者确诊后,立即启动了6周期的TCbHP方案新辅助治疗,治疗过程顺利,病灶退缩明显。随后,患者进行了左乳癌改良根治术,术后病理显示non-pCR。
尽管TCbHP新辅助治疗可以提高患者的pCR率,但约15%的患者会在3~5年内复发或死亡[7]。CSBrS-015研究是一项在中国人群中分析早期HER2阳性乳腺癌接受新辅助治疗的近期疗效及毒副反应情况的多中心真实世界研究。结果显示,接受曲帕双靶+化疗新辅助治疗的患者,pCR率可达57.9%,但仍有部分患者未能获得pCR[8]。而相比pCR患者,non-pCR患者的预后结果更差[9]。一项评估曲帕双靶新辅助治疗疗效的研究结果显示[10],中位随访3.2年后,non-pCR组的3年DFS显著低于pCR组(91% vs 95%,p=0.03),OS也呈现出类似趋势。另一项回顾性研究数据亦表明[11],pCR患者的5年DFS率约为96.8%,而non-pCR患者仅为59.7%(Log‑rank p=0.0083)。这些数据强调了pCR在预测患者长期预后中的重要性,并提示需要进一步优化针对non-pCR患者的治疗策略,以改善其生存结局。
拨云见日,奈拉替尼强化辅助治疗助力non-pCR患者长生存
现有研究已证实,T-DM1能够显著改善HER2阳性早期乳腺癌患者的无浸润性疾病生存(IDFS)。KATHERINE研究的最新结果显示[12],中位随访时间为8.4年,与曲妥珠单抗辅助治疗相比,T-DM1辅助治疗可显著降低患者的浸润性疾病或死亡风险(HR 0.54;95%CI 0.44~0.66)。T-DM1辅助治疗组的7年IDFS率为80.8%,而曲妥珠单抗组为67.1%,绝对获益为13.7%。在OS方面,T-DM1也显示出显著优势,死亡风险比为0.66(P=0.003),7年OS率绝对获益为4.7%(89.1% vs84.4%)。然而,尽管T-DM1辅助治疗为患者带来了显著的生存获益,但对于新辅助治疗后non-pCR的患者,复发风险仍然较高。数据显示[12],接受T-DM1辅助治疗的non-pCR患者,3年IDFS率为88.4%,仍有约12%的患者复发;而到7年时,IDFS率进一步下降(80.8%),复发比例再度升高(近20%)。这表明,即使接受了T-DM1辅助治疗,新辅助治疗后non-pCR的HER2阳性早期乳腺癌患者仍面临较高的复发风险。
为进一步降低患者的复发风险,“强化辅助治疗”应运而生。ExteNET研究创新性地采用了“大小分子序贯”的治疗策略,探索了HER2阳性乳腺癌术后患者在完成1年曲妥珠单抗辅助治疗后,序贯使用奈拉替尼进行强化辅助治疗的疗效及安全性。研究结果显示[13,14],奈拉替尼强化辅助治疗显著提高了意向性治疗(ITT)人群的2年、5年IDFS率,疾病复发风险分别降低了33%和27%。在HR+/≤1年且接受新辅后non-pCR人群中,奈拉替尼的疗效更为显著。对于新辅助治疗后non-pCR患者,奈拉替尼治疗的5年复发风险降低了40%,8年OS率高达91.3%,绝对获益9.1% (HR=0.47;95%CI:0.23~0.92)[15]。在脑转移防控方面,KATHERINE研究显示,中位随访8.4年,接受T-DM1辅助治疗的non-pCR患者中,脑转移发生率为7%[12]。而ExteNET研究中,奈拉替尼治疗组的脑转移5年累积发生率仅0.7%(对照组为2.1%)[15]。作为小分子酪氨酸激酶抑制剂(TKI),奈拉替尼更易透过血脑屏障,可显著降低脑转移的发生风险,为患者长期生存保驾护航。基于此,多部指南均推荐non-pCR的HER2阳性乳腺癌患者在T-DM1或曲妥珠单抗+帕妥珠单抗辅助治疗结束后序贯奈拉替尼进行后续强化治疗[6,16]。
安全升级,真实世界数据再证奈拉替尼强化辅助治疗的临床获益
安全性是影响临床决策的关键因素之一。在ExteNET研究中,奈拉替尼已展现出良好的耐受性[13-15]。一项欧洲开展的奈拉替尼真实世界研究ELEANOR研究进一步证实了这一结论。在该研究中,112例(48.5%)新辅助治疗后non-pCR的患者中,55.4%的患者选择T-DM1辅助治疗,且在后续奈拉替尼强化辅助治疗中未出现新的安全性信号,奈拉替尼强化辅助治疗的中位持续时间为11.9个月[17]。另一项探索奈拉替尼强化辅助治疗在真实世界中应用情况的回顾性研究——NEAR研究也提供了有力支持,该研究结果显示[18],中位随访28.4个月(范围:4.4~57.9个月),奈拉替尼治疗的中位持续时间为12.3个月。治疗过程中,大多数患者经历了1~2级不良反应,且未观察到新的安全性信号。可见在真实世界临床实践中,接受T-DM1和曲帕双靶辅助治疗后序贯使用奈拉替尼的安全性和可管理性。
腹泻是抗HER2小分子药物治疗过程中较为常见的不良反应[19],预防性止泻可以降低腹泻的严重程度,改善患者治疗的依从性,并降低临床治疗与管理成本。在这一方面,CONTROL研究提供了重要的数据支持。研究结果显示[20],通过预防性使用洛哌丁胺(在首剂奈拉替尼给药时开始洛哌丁胺预防性用药:第1~14天,4mg/次 tid;第15~56天,4mg/次 bid)或采用剂量递增给药模式(奈拉替尼第1~7天:120 mg/d;第8~14天:160 mg/d;此后240 mg/d;洛哌丁胺按需使用),可以有效降低奈拉替尼治疗相关的腹泻发生率。真实世界研究结果也进一步证实了这一点,与ExteNET研究相比,临床发生≥3级腹泻的患者比例明显降低(20.3% vs 39%)[17]。这些措施的实施,不仅优化了患者的治疗体验,也为临床管理提供了更为有效的策略。
[1] Geyer CE Jr, Untch M, Huang CS, et al. Survival with Trastuzumab Emtansine in Residual HER2-Positive Breast Cancer. N Engl J Med. 2025;392(3):249-257. doi:10.1056/NEJMoa2406070.
[2]中国抗癌协会乳腺癌专业委员会,等. 中国抗癌协会乳腺癌诊治指南与规范(2024年版)[J].中国癌症杂志, 2023年第33卷第12期.
[3] Gion M, Trapani D, Cortés A, et al. Systemic Therapy for HER2-Positive Metastatic Breast Cancer: Moving Into a New Era. Am Soc Clin Oncol Educ Book. 2022 Apr;42:1-11.
[4] Ignatov A , Eggemann H , Burger E ,et al. Patterns of breast cancer relapse in accordance to biological subtype[J].Journal of Cancer Research and Clinical Oncology, 2018.DOI:10.1007/s00432-018-2644-2.
[5] NCCN乳腺癌指南.2024.
[6] 中国临床肿瘤学会乳腺癌专家委员会. 中国临床肿瘤学会(CSCO)乳腺癌诊疗指南(2024版)[M].人民卫生出版社.2024.
[7] Sara A Hurvitz 1, Miguel Martin 2, Kyung Hae Jung, et al. Neoadjuvant Trastuzumab Emtansine and Pertuzumab in Human Epidermal Growth Factor Receptor 2-Positive Breast Cancer: Three-Year Outcomes From the Phase III KRISTINE Study.
J Clin Oncol. 2019 Sep 1;37(25):2206-2216. doi: 10.1200/JCO.19.00882. Epub 2019 Jun 3.
[8] Cheng Y,Xiang H,Xin L,et al.Chinese Society of Breast Surgery(CSBrS),Chinese Society of Surgery of Chinese Medical Association.Neoadjuvant therapy for early human epidermal growth factor receptor 2 positive breast cancer in China:A multicenter real-world study(CSBrS-015).Chin Med J(Engl).2022 Oct 5;135(19):2311-2318.
[9] 刘运江, 杨超. HER2阳性乳腺癌新辅助治疗策略和现状[J]. 肿瘤防治研究杂志,2024年,第51卷第1期.
[10] Emanuela Ferraro, Jasmeet Singh, Sujata Patil,et al. Incidence of brain metastases in patients with early HER2-positive breast cancer receiving neoadjuvant chemotherapy with trastuzumab and pertuzumab[J]. NPJ Breast Cancer. 2022 Mar 22;8(1):37. doi: 10.1038/s41523-022-00380-7.
[11] Elli-Noora Hännikäinen, Johanna Mattson, Peeter Karihtala. Predictors of successful neoadjuvant treatment in HER2‑positive breast cancer [J]. Oncol Lett. 2023 Aug 22;26(4):434. doi: 10.3892/ol.2023.14021. eCollection 2023 Oct.
[12] Loibl S, Mano M, Untch M, et al. Phase III study of adjuvant ado-trastuzumab emtansine vs trastuzumab for residual invasive HER2-positive early breast cancer after neoadjuvant chemotherapy and HER2-targeted therapy: KATHERINE final IDFS and updated OS analysis. 2023 SABCS. GS03-12.
[13] Chan A, Delaloge S, Holmes FA, et al. Neratinib after trastuzumab-based adjuvant therapy in patients with HER2-positive breast cancer (ExteNET): a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2016;17(3):367-377.
[14] Martin M, Holmes FA, Ejlertsen B, et al. Neratinib after trastuzumab-based adjuvant therapy in HER2-positive breast cancer (ExteNET): 5-year analysis of a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2017;18(12):1688-1700.
[15] Chan A, Moy B, Mansi J, et al. Final Efficacy Results of Neratinib in HER2-positive Hormone Receptor-positive Early-stage Breast Cancer From the Phase III ExteNET Trial. Clin Breast Cancer. 2021;21(1):80-91.e7.
[16]中国抗癌协会乳腺癌专业委员会, 中华医学会肿瘤分会乳腺肿瘤学组. 中国抗癌协会乳腺癌与中华医学会肿瘤学分会乳腺癌诊治指南与规范(2025年版 精要本).
[17] Bartsch R, Harbeck N, Wrobel D, et al. Interim analysis of 300 patients with HER2+/HR+ early breast cancer enrolled in the multi-national, prospective, observational, non-interventional study ELEANOR treated with extended adjuvant neratinib in clinical routine. 2024ESMO BC,116p.
[18] T. Silovski (presenting), A. Cano Jimenez, M. Križić, et al. HER2+ eBC treated with neratinib as an extended adjuvant therapy in the context of the EAP: NEAR study final results.2024ESMO BC,119p.
[19]王晓稼.奈拉替尼的安全性管理进展[J].实用肿瘤杂志, 2020, 35(2):5.
[20] Chan A, Ruiz-Borrego M, Marx G,et al. Final findings from the CONTROL trial: Strategies to reduce the incidence and severity of neratinib-associated diarrhea in patients with HER2-positive early-stage breast cancer. Breast. 2023 Feb;67:94-101.
排版编辑:TanRongbing











 苏公网安备32059002004080号
苏公网安备32059002004080号


