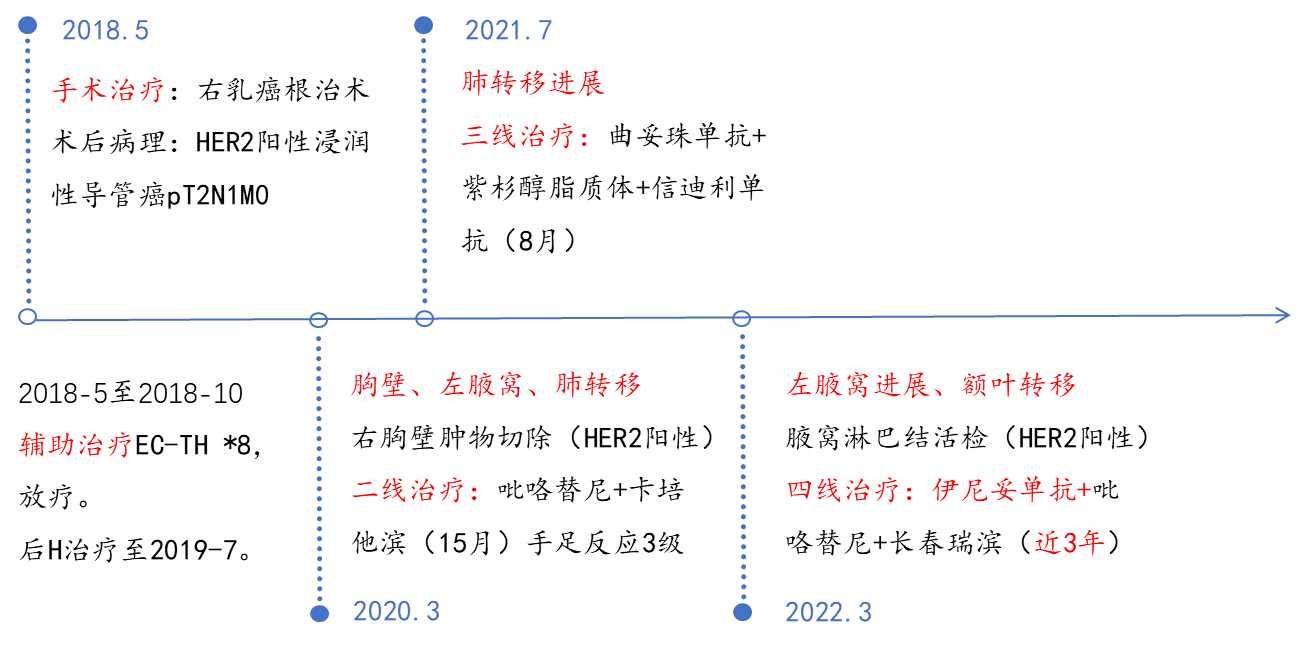
近年来,随着新型抗肿瘤药物的不断涌现,晚期乳腺癌的预后显著改善,其中人表皮生长因子受体2(HER2)阳性乳腺癌的治疗进展尤为突出。抗HER2靶向治疗及其联合治疗策略,为这类患者带来了长期生存的希望。本期特别分享一例HER2阳性多发转移乳腺癌患者的诊疗经历。该患者2018年接受右乳改良根治术,术后EC-TH方案辅助治疗联合辅助放疗,无病生存期(DFS)22月。后出现胸壁转移、腋窝淋巴结转移,二线换用吡咯替尼+卡培他滨治疗,最佳疗效达到部分缓解(PR),无进展生存期(PFS1)为15个月。肺转移后,三线予“曲妥珠单抗+紫杉醇脂质体+信迪利单抗”方案治疗9周期后“曲妥珠单抗+信迪利单抗”维持治疗。维持治疗2周期后,患者出现腋窝淋巴结转移进展、单发无症状脑转移,PFS2为8个月。结合指南推荐、患者既往用药情况、临床疗效、经济因素及药物可及性等,四线予伊尼妥单抗+吡咯替尼+长春瑞滨联合治疗,并针对颅内病灶予局部放疗。至今,PFS3已接近3年,患者一般状况良好,病情稳定。
病例分享
山东省肿瘤医院乳腺内科副主任医师
山东省老年医学学会乳腺综合治疗专业委员会委员
生物医学工程会乳腺病精准治疗委员会委员
山东省抗癌协会肿瘤精准治疗分会委员
生物医学工程学会定向治疗专业委员会常委
擅长:乳腺肿瘤的诊治及规范化治疗
发表论文10余篇,参编著作2部
病例介绍
患者:女,年龄51岁。
主诉:右乳癌术后近7年,胸壁复发术后5年。
家族史、既往史、个人史:无特殊。
月经史:48岁绝经。
现病史:2018年5月4日,患者于外院行“右乳癌改良根治术+前哨淋巴结活检术”。术后病理:非特殊型浸润性癌,Ⅱ级,大小4.5×4.5×4cm,前哨(1/1)。一组、二组、三组(0/21),免疫组化:ER(-),PR(-),Her-2(3+),ki67 20%。2018年5月至2018年10月,术后行EC-TH(表柔比星+环磷酰胺-紫杉醇+曲妥珠单抗)*8周期辅助治疗+辅助放疗,后曲妥珠单抗维持治疗至2019年7月。
2020年3月,发现右胸壁肿物,外院复查CT示“双肺转移(大者0.6cm),左腋窝淋巴结转移(大者1.7×3.1cm)”。2020年3月27日,在全麻下行“右胸壁肿物切除+左腋窝淋巴结活检术”。术后病理:(右胸壁)皮下组织内浸润的腺癌,符合乳腺非特殊型浸润性癌(Ⅱ级),大小0.5×0.5×0.4cm,局部累及底部切除面。“左腋窝”(1/3)淋巴结癌转移。免疫组化:ER (-)、PR (-)、Her2(3+) 。2020年4月至2021年7月,二线使用吡咯替尼+卡培他滨治疗,疗效评价PR。治疗期间出现手足反应3级(手足溃疡,皲裂)。
2021年7月29日外院CT :双肺转移增大(大者右肺下叶1.1×0.9cm);左侧腋窝多发淋巴结,部分较前略饱满(0.9×1.3cm)。2021年7月31日至2022年1月20日,三线开始曲妥珠单抗+信迪利单抗+紫杉醇脂质体*9周期治疗。期间复查(2021-09-12)见:左腋窝淋巴结缩小(0.9×1.2cm),双肺转移缩小(右肺下叶0.6cm)。后复查(2021-12-07、2022-1),病情稳定。疗效评价PR。2022-2-12、2022-03-04分别予曲妥珠单抗+信迪利单抗维持治疗。
2022年3月复查CEA、CA125、CA153 正常,颅胸CT(图1)示:左侧腋窝转移增大(较大短径约2.0cm),双肺转移(较大右肺下叶0.7cm),右额叶转移(1.3cm)。左腋窝淋巴结穿刺病理:符合乳腺非特殊型浸润性癌转移,免疫组化:ER-,PR-,HER2(3+),Ki67(约70%)。
查体示:左腋窝触及肿大淋巴结,约2cm,质硬,活动可。右乳术后缺如,右胸壁可见手术疤痕。
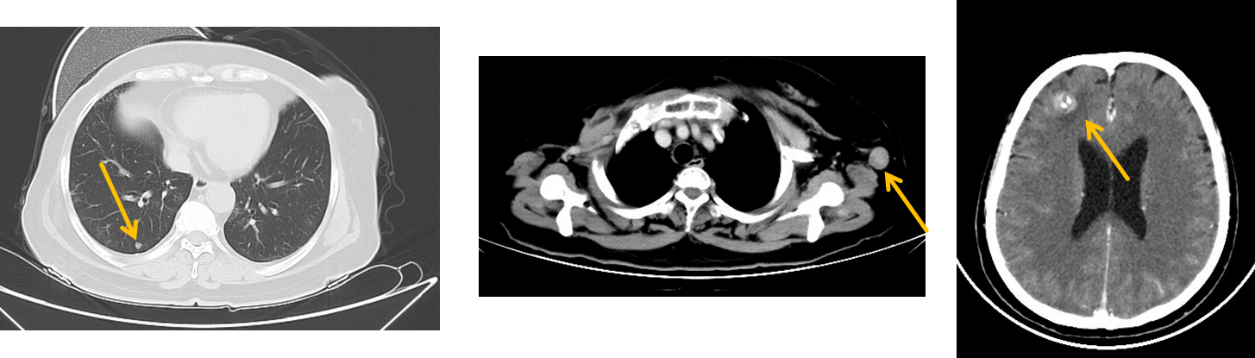
临床诊断:
右乳腺癌(术后pT2N1M0,IIB期→rT1N1M1,IV期)
右胸壁转移术后 肺转移 左腋窝淋巴结转移
脑转移(右额叶转移)
治疗经过:2022年3月24日至2022年9月2日,四线行伊尼妥单抗+吡咯替尼+长春瑞滨*8周期治疗。治疗2周期后,疗效评估:PR;治疗4、6周期后疗效评估为:维持PR;治疗8周期后(2022-9-26),疗效评估为:颅内PD,颅外SD。予颅脑局部放疗(3Gy/次*15次,DT45GY)。
2022年9月26日至今,予伊尼妥单抗+吡咯替尼+长春瑞滨胶囊维持治疗,病情保持稳定,最近一次随访时间为2025年2月2日,无疾病进展。
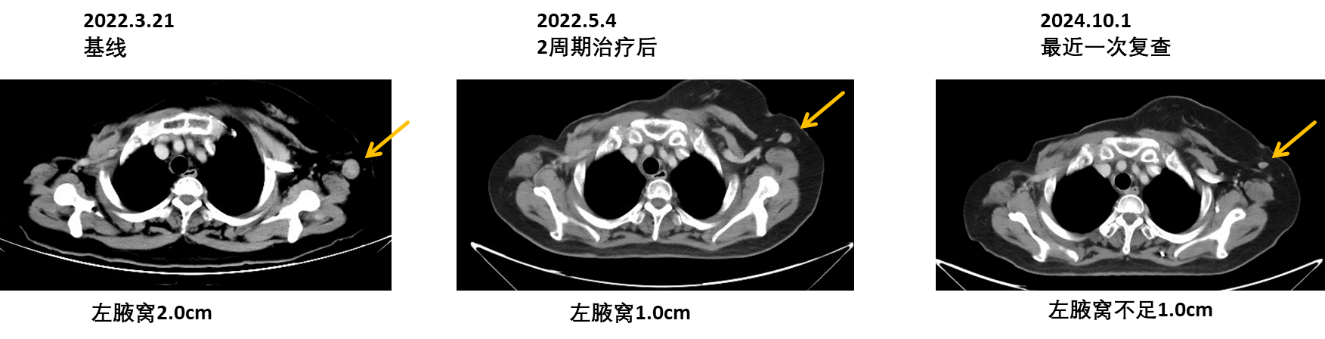
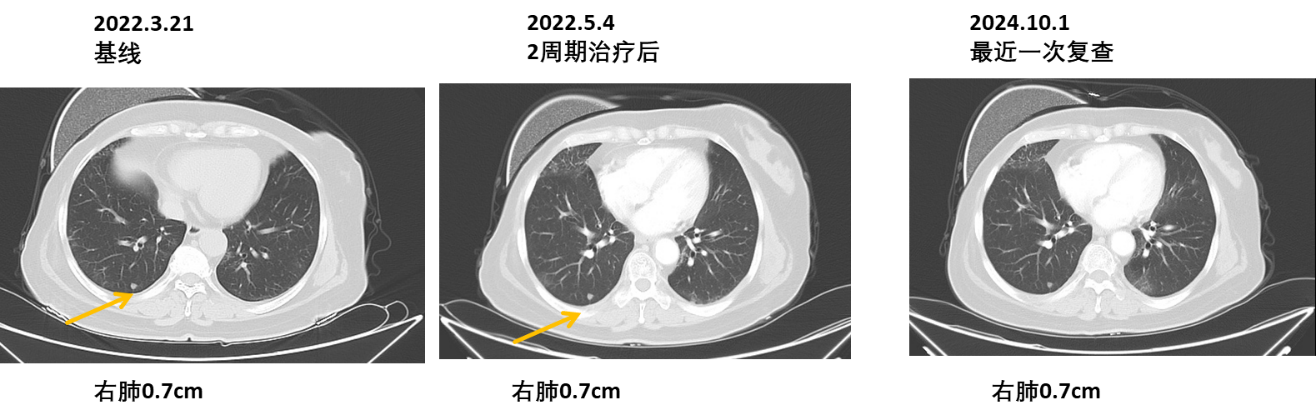
影像学结果:胸部CT(左腋窝淋巴结缩小,并持续稳定;肺转移持续稳定)
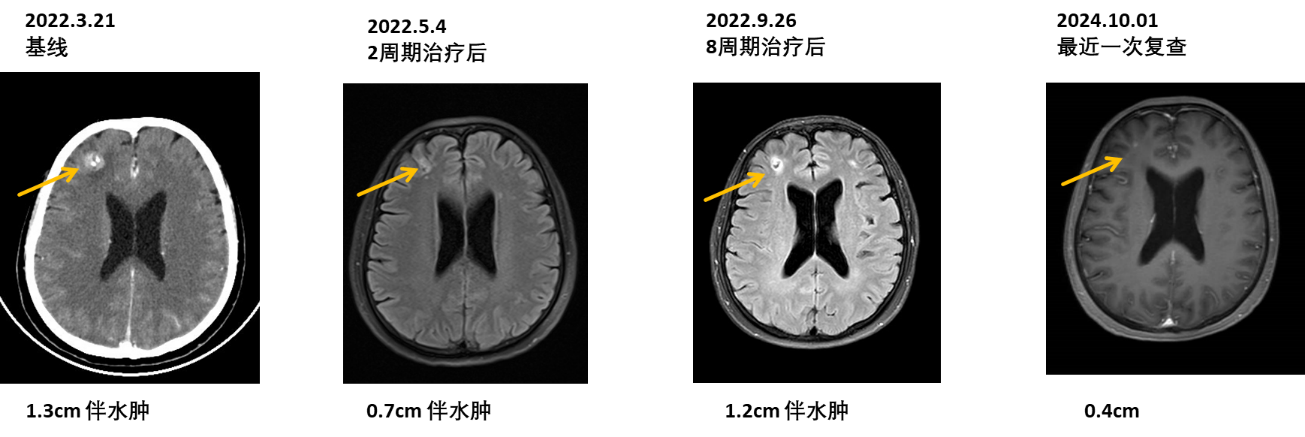
颅脑影像(额叶病灶缩小,并持续稳定)
治疗流程图
专家点评
山东省肿瘤医院乳腺内科主诊医师
山东抗癌协会乳腺肿瘤专业委员会常委
山东省老年医学会乳腺专业委员会常委
山东省老年医学会乳腺综合治疗专委会常委
山东抗癌协会心理专业委员会常委
山东老年医学会老年肿瘤专委会常委
山东抗癌协会淋巴瘤专委会首届常委
山东临床肿瘤学会乳腺专家委员会委员
中国抗癌协会淋巴瘤第五届专委会委员
山东抗癌协会化疗专业委员会委员
跨线治疗,持续抗HER2治疗为患者带来长期生存获益
HER2过表达是乳腺癌预后不良的独立危险因素之一,同时也是抗HER2靶向治疗疗效的重要预测指标。与其他乳腺癌分子分型相比,HER2阳性乳腺癌具有更高的恶性程度,复发及转移时间更早,预后也相对较差。抗HER2治疗是HER2阳性乳腺癌治疗的核心策略[1-4]。自1998年曲妥珠单抗获批用于HER2阳性晚期乳腺癌患者以来,抗HER2治疗药物不断推陈出新,从单克隆抗体到酪氨酸激酶抑制剂(TKI),再到抗体偶联药物(antibody-drug conjugates,ADC),极大地改善了HER2阳性乳腺癌患者的长期生存预后,使长期生存不再遥不可及。目前对于早期HER2阳性乳腺癌患者,术后采用曲妥珠单抗为基础的辅助治疗序贯奈拉替尼强化辅助可进一步降低复发风险;对于转移性HER2阳性乳腺癌患者,在各个治疗线数均需考虑持续的抗HER2治疗。PRECIOUS试验[5]等多项研究进一步表明了抗HER2靶向后线再诱导可带来更多生存获益。本例患者多次进展后持续抗HER2治疗联合不同全身治疗方案,使得生存期进一步延长。
强强联合,口服长春瑞滨胶囊联合靶向治疗成为后线的优选方案
长春瑞滨作为一种经典的化疗药物,凭借其高效低毒的特点,已成为国内外权威指南推荐的乳腺癌治疗基石药物。在NorBreast-231研究中[6],口服长春瑞滨软胶囊显示出了不劣于紫杉醇的疗效,两组的疾病控制率(DCR)分别是75.8% vs 75.4%。此外,口服长春瑞滨软胶囊在保障疗效、安全性的同时,在治疗便利性和安全性方面具有显著优势,能够进一步提高患者的依从性,降低患者的患病主观感受[7]。与静脉注射紫杉醇相比,口服长春瑞滨软胶囊的脱发和周围神经病变等不良反应的发生频率和严重程度更低[6]。同时在所有化疗药物中,长春瑞滨与曲妥珠单抗的CI值(联合指数,CI值越低,表明化疗药物与曲妥珠单抗的协同作用越强)最低,仅为0.34,提示长春瑞滨联合曲妥珠单抗具有最佳的协同作用,能够发挥出最佳疗效[8-11]。总之,口服长春瑞滨软胶囊凭借其良好的疗效、安全性以及治疗便利性,已成为乳腺癌临床联合治疗中的优先选择。
伊尼妥单抗是我国首个自主研发的抗HER2单克隆抗体类药物,通过Fc段修饰和生产工艺优化,具有更强的抗体依赖的细胞介导的细胞毒效应(ADCC)。它不仅可以阻断HER2通路直接抑制肿瘤细胞的增殖和生长,还能诱导ADCC效应,使机体免疫系统识别并杀伤肿瘤细胞。在HOPES研究中[12],伊尼妥单抗联合长春瑞滨治疗组的中位PFS为39.1周,显著优于长春瑞滨单药治疗的14.0周(HR=0.24;95%CI:0.16~0.36;P<0.0001),联合治疗组的客观缓解率(ORR)和疾病控制率(DCR)亦显著提高,且具有良好的安全性。另一项前瞻性、多中心、单臂临床研究进一步探索了伊尼妥单抗联合吡咯替尼及卡培他滨/长春瑞滨用于曲妥珠单抗经治HER2阳性晚期乳腺癌的疗效及安全性。结果显示[13],研究共纳入40例患者,中位治疗线数为3线,总体患者的中位PFS为8.2个月(95%CI:2.8-13.5)。此外,真实世界研究数据显示[14],伊尼妥单抗联合治疗在脑转移患者中也具有可喜的疗效:30例脑转移患者中,中位PFS为12个月(95%CI:4.7-19.3个月),ORR为53.3%(16/30),DCR为96.7%(29/30)。亚组分析显示,接受脑转移放疗的患者(N=22)的中位PFS可达12个月(95%CI:5.5-18.5个月)。这些结果支持伊尼妥单抗联合治疗方案在HER2阳性转移性乳腺癌,尤其是脑转移患者中的应用潜力,为临床治疗提供了更多选择的依据。
鉴于本例患者的病情特点,患者接受了伊尼妥单抗+吡咯替尼+长春瑞滨方案进行四线治疗,并接受了颅内局部放疗以有效控制颅内病灶的进展,疗效达到PR,PFS3已接近3年。我们将持续关注患者的病情变化,及时调整诊疗方案,进一步延长生存,提高生活质量。
[1]刘滨, 李健斌, 江泽飞. 乳腺癌抗HER2靶向治疗20年历程[J]. 中华外科杂志, 2023, 61(2) : 89-94. DOI: 10.3760/cma.j.cn112139-20220926-00406.
[2]Dongshao Chen, Fei Xu, Yongkui Lu, et al. NPJ Breast Cancer. 2024 Jun 13;10(1):45. doi: 10.1038/s41523-024-00646-2.
[3]Kurozumi S, Padilla M, Kurosumi M, et al. Breast Cancer Res Treat. 2016;158(1):99-111.
[4]Seol H, Lee HJ, Choi Y, et al. Mod Pathol. 2012;25(7):938-948.
[5] Bartsch R. SABCS 2020: update on triple-negative and metastatic HER2-positive breast cancer. Memo. 2021;14(3):247-251.
[6] Aapro M, et al. Randomized phase II study evaluating weekly oral vinorelbine versus weekly paclitaxel in estrogen receptor-positive, HER2-negative patients with advanced breast cancer (NorBreast-231 trial)[J]. Breast. 2019;45:7-14.
[7] Catania C, et al. Breast Cancer Res Treat. 2005,92(3):265-272.
[8] Foucquier J, Guedj M.Pharmacd. Res Perspect. 2015 Jun;3[3]:e00149.
[9]Fujimoto-Ouchi Kaori. Cancer Chemother Pharmacol 2002;49:211-216.
[10]Pegram M, et al. Oncogene 1999;18:2241-2251.
[11]Pietras RJ, et al. Oncogene 1998;17:2235-2249.
[12]边莉,徐兵河,邸立军,等.重组抗HER2人源化单克隆抗体联合长春瑞滨治疗HER2阳性转移性乳腺癌随机对照Ⅲ期临床研究[J].中华医学杂志,2020,100(30):2351-2357.
[13] Yan Xue,Junmei Zhang, Xuezheng Wang, Donghui Li, et al. A prospective, multicenter, single-arm clinical study of inetetamab combined with pyrotinib and capecitabine/vinorelbine in the treatment of HER2-positive metastatic breast cancer resistant to previous trastuzumab treatment. SABCS. 2024. P5-05-07.
[14]Liping Chen, Caiwen Du. Inetetamab-base regimens for patients with HER2-positive metastatic breast cancer and brain metastases: a real-world retrospective study SABCS.2024. P5-05-08.
排版编辑:TanRongbing











 苏公网安备32059002004080号
苏公网安备32059002004080号


