在乳腺癌的治疗中,转移性乳腺癌一直是临床医生面临的重大挑战。随着医学研究的不断深入,抗体偶联药物(ADCs)在不同亚型转移性乳腺癌的治疗中展现出独特的优势。本文基于领域综述1,深入梳理ADC在HER2阳性、HER2(超)低表达及HR阳性转移性乳腺癌中的研究进展,旨在为临床实践提供参考。
HER2阳性转移性乳腺癌
HER2阳性转移性乳腺癌曾经治疗手段有限,但 ADC 的出现显著改变了这一局面。恩美曲妥珠单抗(T-DM1)是首个在乳腺癌治疗领域获批的 ADC。它由曲妥珠单抗与美登素连接而成,凭借高度稳定的硫醚连接子,精准地将美登素输送到 HER2 阳性癌细胞中。
2012 年基于 EMILIA 试验结果,T-DM1 被FDA批准作为HER2 阳性转移性乳腺癌的二线治疗药物。该试验显示,接受T-DM1治疗的患者无进展生存期(PFS)达到9.6 个月,总生存期(OS)为29.9个月,相比卡培他滨联合拉帕替尼治疗的患者有显著提升。
然而,T-DM1并非HER2阳性转移性乳腺癌治疗的终点。德曲妥珠单抗(T-DXd)的出现,进一步改写了HER2阳性转移性乳腺癌的治疗格局。T-DXd 同样靶向HER2,它的独特之处在于采用了可裂解的四肽连接子和具有膜通透性的德鲁替康有效载荷。这种结构使得T-DXd不仅能精准作用于HER2 阳性癌细胞,还能通过旁观者效应扩散到附近癌细胞,扩大了杀伤范围。
基于DESTINY-Breast03试验,T-DXd在二线治疗中展现出卓越的疗效。与T-DM1相比,接受T-DXd治疗的患者PFS显著延长至28.8个月,客观缓解率(ORR)高达79%,完全缓解率(CRR)达到 21%,包括中枢神经系统(CNS)疾病患者也有良好的疗效。在T-DXd 用于HER2阳性乳腺癌的适应症获批方面,FDA 最初基于DESTINY-Breast01研究对其进行了加速批准,随后又依据DESTINY-Breast03试验给予了完全批准。
目前,多项临床试验正在探索 T-DXd 的联合治疗方案,旨在进一步优化 HER2 阳性转移性乳腺癌的治疗效果。DESTINY-Breast07是一项Ib/II期多中心、开放标签、多队列研究,旨在评估T-DXd联合其他抗癌药物用于HER2阳性转移性乳腺癌的疗效、耐受性和安全性,包括剂量探索和剂量扩展两个阶段。中期结果显示,T-DXd 联合帕妥珠单抗的 ORR 有所提高,12 个月 PFS 也得到改善 。
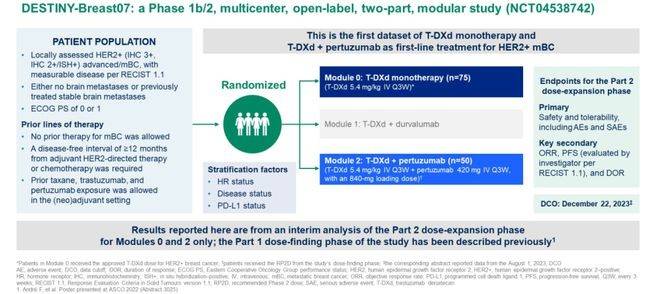
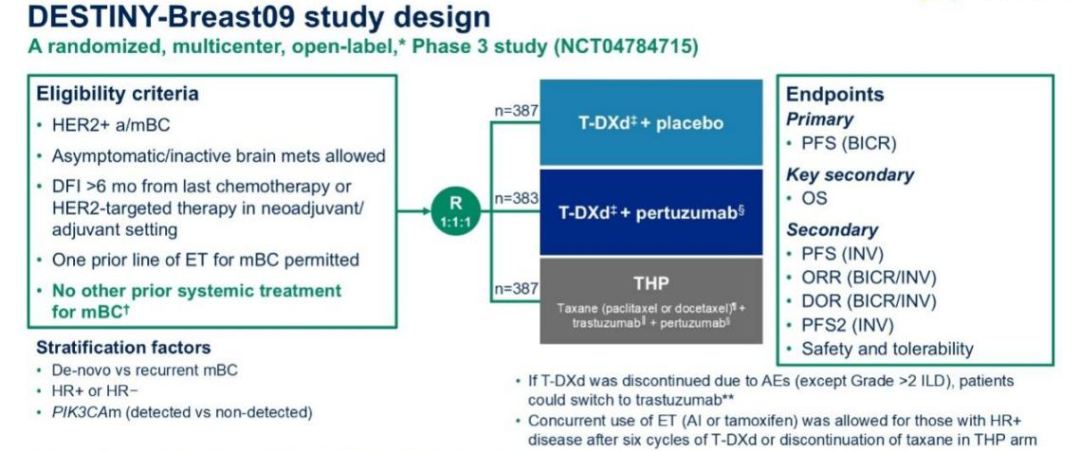
III 期 DESTINY-Breast09 试验旨在进一步评估T-DXd联用或不联用帕妥珠单抗与THP相比一线治疗HER2阳性转移性乳腺的安全性和疗效。2025年ASCO会议公布的中期分析数据中报告了T-DXd+P组和THP组的疗效结果。
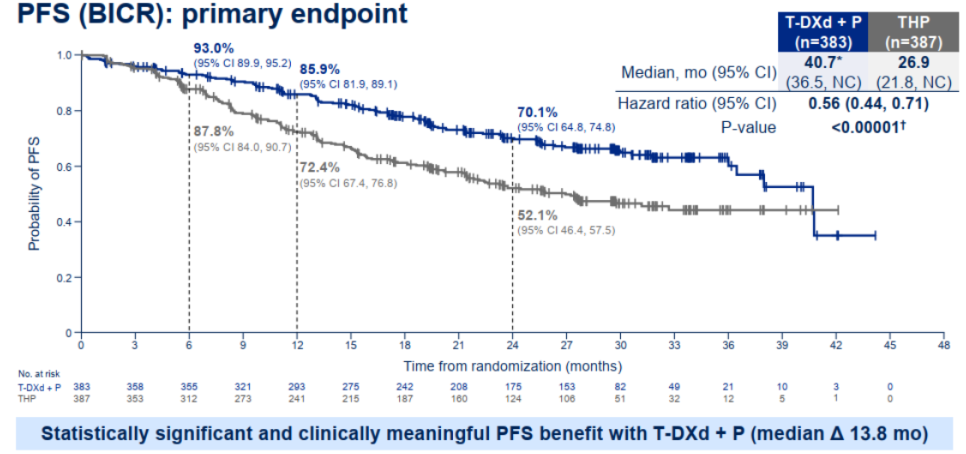
主要终点PFS分析结果显示,T-DXd+P与THP相比,取得了具有统计学显著性和临床意义的PFS改善。BICR评估的中位PFS分别为40.7个月 vs. 26.9个月(HR=0.56, 95%CI 0.44-0.71;p<0.00001 )。1年PFS率为85.9% vs. 72.4%;2年PFS率为70.1% vs. 50.1%。在所有预设亚组中,T-DXd+P均显示出与总人群一致的PFS获益。T-DXd单药治疗组仍处于盲态,研究将继续进行直至完成最终的PFS分析。
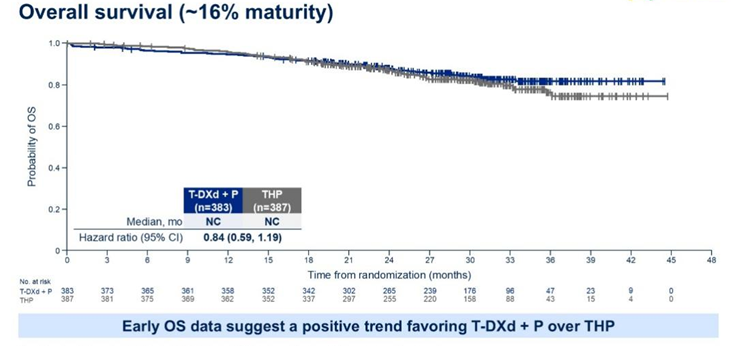
目前OS这一关键次要终点的数据尚未成熟(成熟度16%)。但从分析曲线看,与THP方案相比,T-DXd+P联合治疗方案已呈现出积极的获益趋势(HR=0.84, 95%CI 0.59- 1.19)。
HER2(超)低表达转移性乳腺癌
在 T-DXd 获批用于HER2阳性转移性乳腺癌治疗后,“HER2 低表达” 乳腺癌被确认为一种独特的实体瘤。其定义为HER2表达水平较低,免疫组织化学(IHC)评分为 1+ 或 2+,且荧光原位杂交(ISH)检测无基因扩增。HER2 低表达肿瘤占所有转移性乳腺癌的 45%-55%,以往由于缺乏有效的 HER2 靶向治疗选择,常被视为 HER2 阴性乳腺癌进行治疗。
具有里程碑意义的 III 期DESTINY-Breast04研究改变了这一现状。该试验表明,对于激素受体阳性(HR+)/HER2 低表达转移性乳腺癌患者,在接受一线转移性化疗后,与医生选择的治疗方案(TPC)相比,接受 T-DXd 治疗的患者 PFS 达到 10.1 个月,OS 为 23.9 个月,均有显著获益 。对 HR-/HER2低表达肿瘤患者的亚组分析也显示出类似的优势。
HER2 超低表达乳腺癌是一个新兴概念,其 HER2 表达水平更低,目前在临床病理报告中归类为 IHC 0 。这些肿瘤的 HER2 表达水平虽可通过敏感技术检测到,但低于HER2低表达的分类阈值。DESTINY-Breast06试验是首个针对HER2超低表达疾病患者的注册研究。该试验显示,与 TPC 相比,接受 T-DXd 治疗的 HER2 低表达和HER2超低表达患者队列的 PFS 有相似的获益趋势,不过HER2超低表达组的OS获益未达到统计学显著性,可能与样本量不足有关。

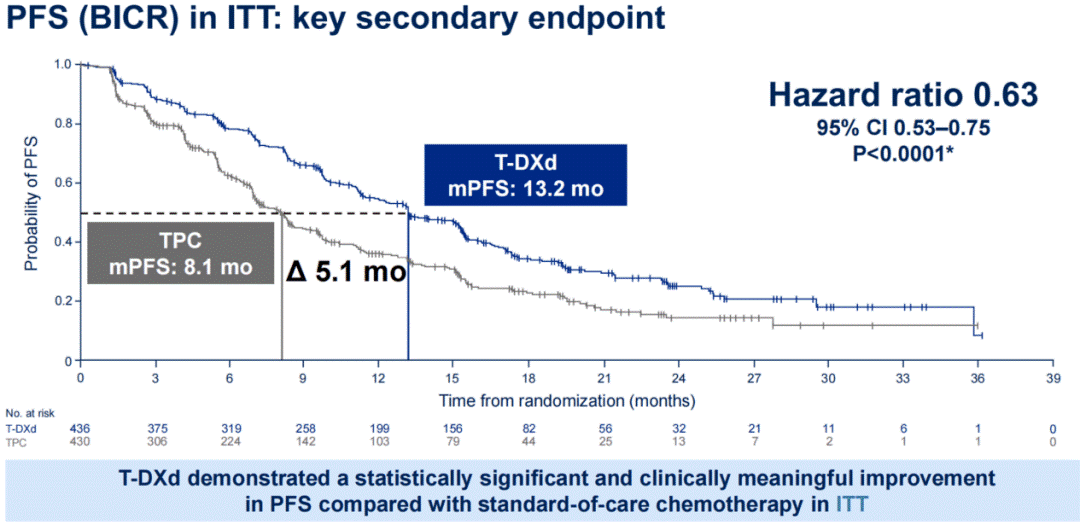
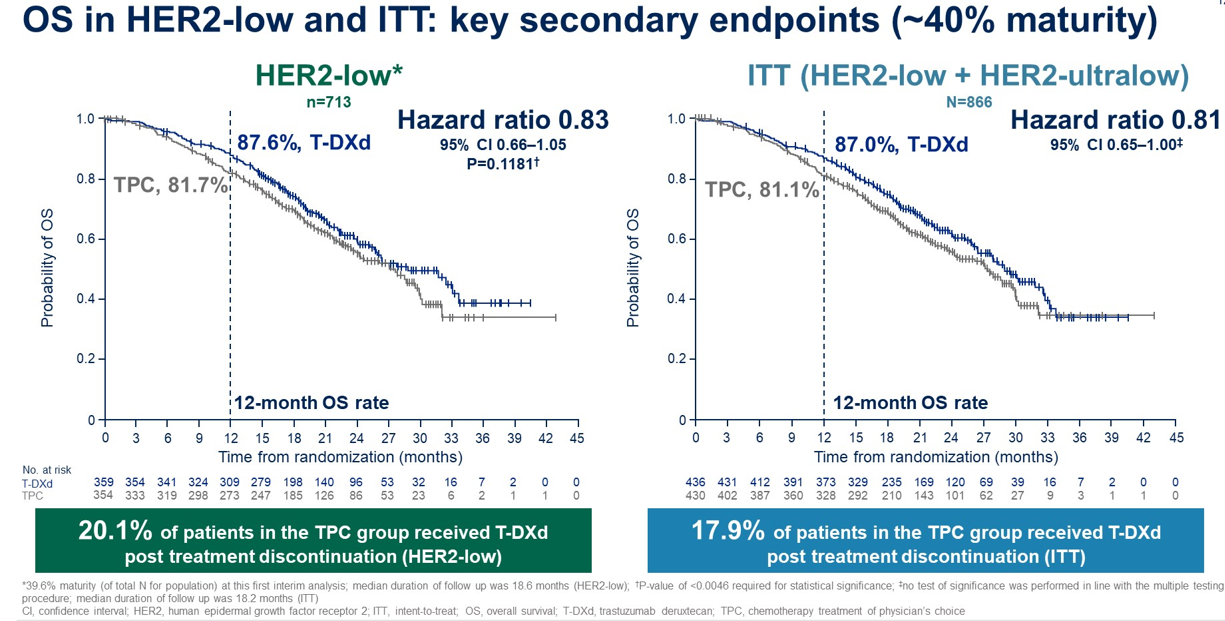
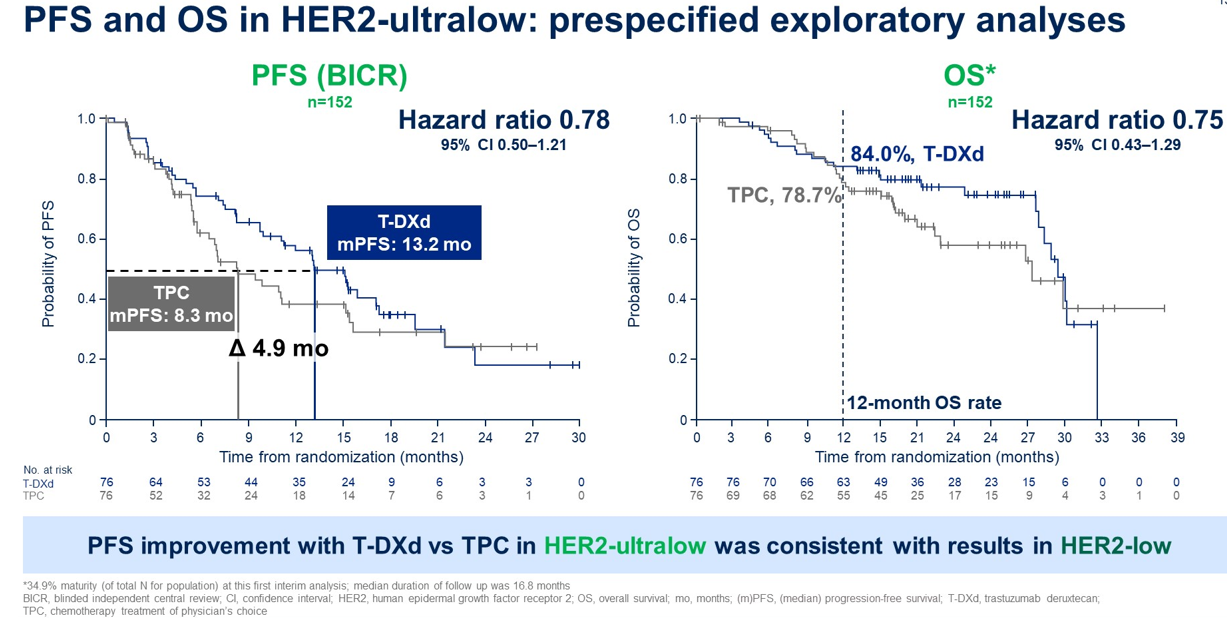
循证证据指导下的用药选择
在考虑 HER2 低表达和超低表达转移性乳腺癌的治疗时,需要权衡T-DXd 与其他治疗方案的风险。DESTINY-Breast06 试验显示,服用 T-DXd 的患者中40.6%发生≥3 级治疗相关不良事件(TRAE),高于服用 TPC 的患者;两组间间质性肺疾病(ILD)或肺炎的诊断率分别为11.3% 和 0.2%,T-DXd 组有 3 例 ILD 病例死亡 。因此,对于转移性HR+/HER2 低表达或超低表达疾病,在接受内分泌治疗后,仅有局限性或骨转移的患者可能更适合从一线口服化疗药物卡培他滨中获益,而高肿瘤负荷或内脏转移的患者则可能从一线 T-DXd 治疗中获得更好的疾病控制。
这些试验也引发了关于 HER2 表达水平与 T-DXd 疗效关系的思考。在DESTINY-Breast04 试验中,T-DXd 相对于TPC的中位PFS获益在HER2 2+/ISH 阴性和 HER2 1+ 肿瘤患者中相似;然而,DESTINY-Breast06 试验显示,HER2 2+/ISH 阴性组中 T-DXd 相对于 TPC 的 PFS 获益更大 。II 期 DAISY 试验在至少接受过一线化疗的 HR + 或 HR 阴性转移性乳腺癌患者(无论 HER2 状态如何)中使用 T-DXd,结果表明 HER2 表达水平影响 T-DXd 的疗效,同时也支持 T-DXd 在部分 IHC 0 肿瘤中的疗效。
值得注意的是,HER2 低表达是一个动态的生物标志物,先前 HER2 低表达的肿瘤可能变为 HER2 阴性,反之亦然。这种变化可能与 HER2 表达的空间异质性有关,研究表明同一患者甚至同一肿瘤内可同时存在 HER2 低表达和 HER2 阴性疾病。T-DXd 似乎在 HER2 低表达稳定的肿瘤中疗效最佳。
HR+/HER2-转移性乳腺癌
对内分泌治疗耐药的 HR+/HER2- 转移性乳腺癌依然是临床治疗的一大难题,且目前 T-DXd 尚未获批用于这类患者。然而,另一种 ADC 药物 —— 戈沙妥珠单抗(SG),为这些患者带来了新的希望。SG 主要由针对 Trop-2 的人源化单克隆抗体、可水解连接子以及拓扑异构酶 I 抑制剂 SN38 组成。TROPiCS-02 试验结果显示,在接受过 2-4 线先前化疗和至少一种 CDK4/6 抑制剂治疗后,对内分泌治疗耐药的 HR+/HER2-(包含 HER2 低表达和 HER2 阴性)转移性乳腺癌患者中,使用 SG 进行治疗后,患者的 PFS、OS和ORR均得到了显著改善。
Ⅲ 期、多中心、随机对照的 EVER-132-002 研究是在 TROPiCS-02 研究的基础上开展的一项桥接研究,该研究主要针对以中国为主的亚洲 HR+/HER2- 乳腺癌患者,对 SG 的临床应用效果进行了验证,结果证实 SG 能够为患者带来 OS 与 PFS 的双重获益,并且这种获益不受患者既往是否接受过 CDK4/6i 治疗以及 HER2 水平的影响。EVER-132-002 研究的结果成功复现了 TROPiCS-02 研究在全球人群中的 OS、PFS 双重获益和良好的安全性表现,进一步印证了 SG 在临床应用中的重要价值。
此前,SG 已在中国获批用于治疗接受过至少 2 种系统治疗(其中至少 1 线为针对转移性疾病的治疗)的不可切除的局部晚期或转移性三阴性乳腺癌成人患者。
ADC+
目前,针对 HER2 低表达疾病,多项试验正在探索 ADC 与其他治疗药物的联合应用。Ib 期DESTINY-Breast08研究正在招募HR+/HER2低表达转移性乳腺癌患者,这些患者最多接受过一线内分泌治疗,将接受 T-DXd 联合阿那曲唑或氟维司群治疗。T-DXd 还在 HER2 低表达、超低表达和阴性转移性乳腺癌中与伐美妥司他联合进行评估(NCT05633979),并在 HR+/HER2 低表达转移性乳腺癌中与camizestrant 联合进行评估(NCT06271837)。
由于临床前数据表明 ADC 可能增加 HR+ 肿瘤的免疫原性和免疫检查点抑制剂(ICI)的有效性,一些研究正在 HR+转移性乳腺癌中探索ADC联合ICI 的疗效。SACI-IO HR+ 是一项 II 期试验,探索SG±帕博利珠单抗用于既往接受过≥1次内分泌治疗和0-1次化疗的HR+/HER2-转移性乳腺癌患者。在该试验中,向 SG 中添加帕博利珠单抗并未改善PFS。然而,一个数值趋势显示程序性死亡配体 1 阳性(PD-L1+)组有所改善,这支持在PD-L1+、HR+转移性乳腺癌中进一步研究 ADC 和 ICI 的联合应用。
ADC 在 HER2 阳性与 HER2 低表达/超低表达转移性乳腺癌的治疗中取得了显著进展,为患者带来了更多生存希望。但在临床应用中,仍需根据患者的具体情况,权衡不同治疗方案的利弊,选择最适合的治疗策略。后续我们还将继续探讨 ADC 在转移性三阴性乳腺癌以及早期乳腺癌治疗中的应用,敬请关注。
O'Meara, Tess A et al. “Antibody-Drug Conjugates in Breast Cancer: The Road Towards Biologically-Informed Selection and Sequencing.” Current oncology reports vol. 27,1 (2025): 68-79. doi:10.1007/s11912-024-01628-0
排版编辑:肿瘤资讯-Jina












 苏公网安备32059002004080号
苏公网安备32059002004080号


