在精准医疗迅速发展的时代,NTRK基因融合作为一类重要的致癌驱动因素,备受临床关注。NTRK基因融合不局限于某些组织类型,在身体的各个部位都可能发生。NTRK基因融合一些最常见肿瘤类型(肺癌和肠癌等)中较为少见,发生率通常低于5%,而在少数罕见肿瘤(唾液腺癌和分泌性乳腺癌等)中频发(高于80%)[1]。针对NTRK融合的靶向药物研发进展迅速,拉罗替尼基于临床试验的积极结果写入国内外权威临床指南,并于2022年获得NMPA批准用于治疗NTRK基因融合的局部晚期或转移性实体瘤成人和儿童患者,为NTRK基因融合肿瘤患者带来了新的治疗选择。本文将结合今年的研究进展,分析拉罗替尼治疗NTRK基因融合肿瘤成人患者的最新临床数据,以期为临床实践提供更多参考依据。
大放异彩,NTRK基因融合肿瘤成人患者治疗进展
NTRK基因融合肿瘤成人患者数据
随着拉罗替尼临床研究随访时间的延长,2024 ESMO年会报告了拉罗替尼治疗NTRK基因融合肿瘤成人患者的最新研究结果。在最新的研究分析中,纳入203例非原发性CNS TRK融合肿瘤成人患者,结果显示在所有患者中客观缓解率(ORR)为54% (95% CI:47%-61%),其中15%的患者可达到完全缓解。数据截止时,中位缓解持续时间(mDoR)为55个月,5年DoR率为37%;中位无进展生存期(mPFS)为16个月,5年PFS率为30%;中位总生存期(mOS)为49个月,5年OS率为46%[2]。

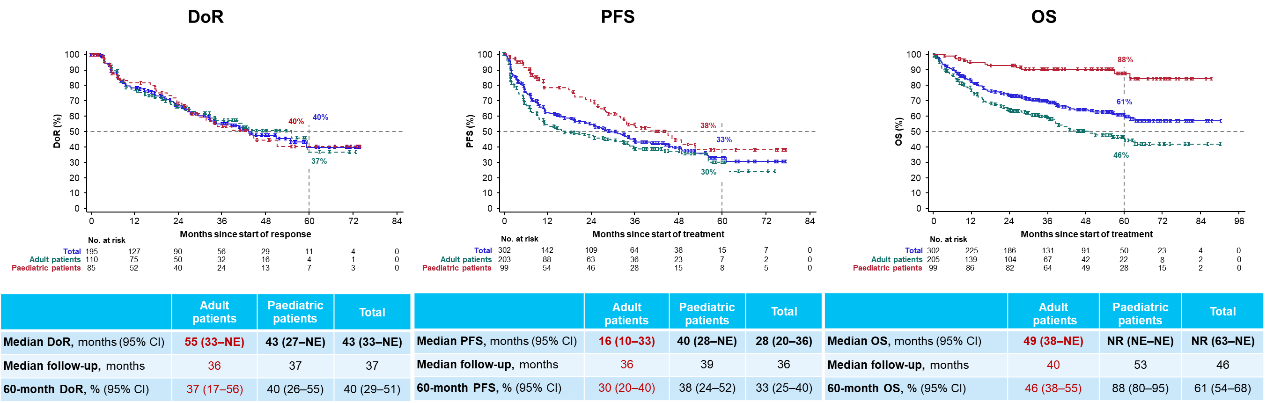
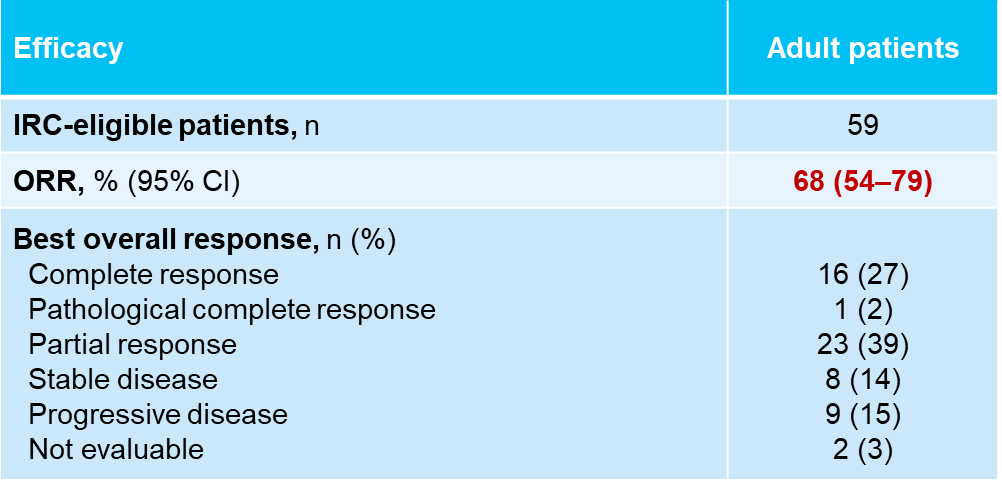
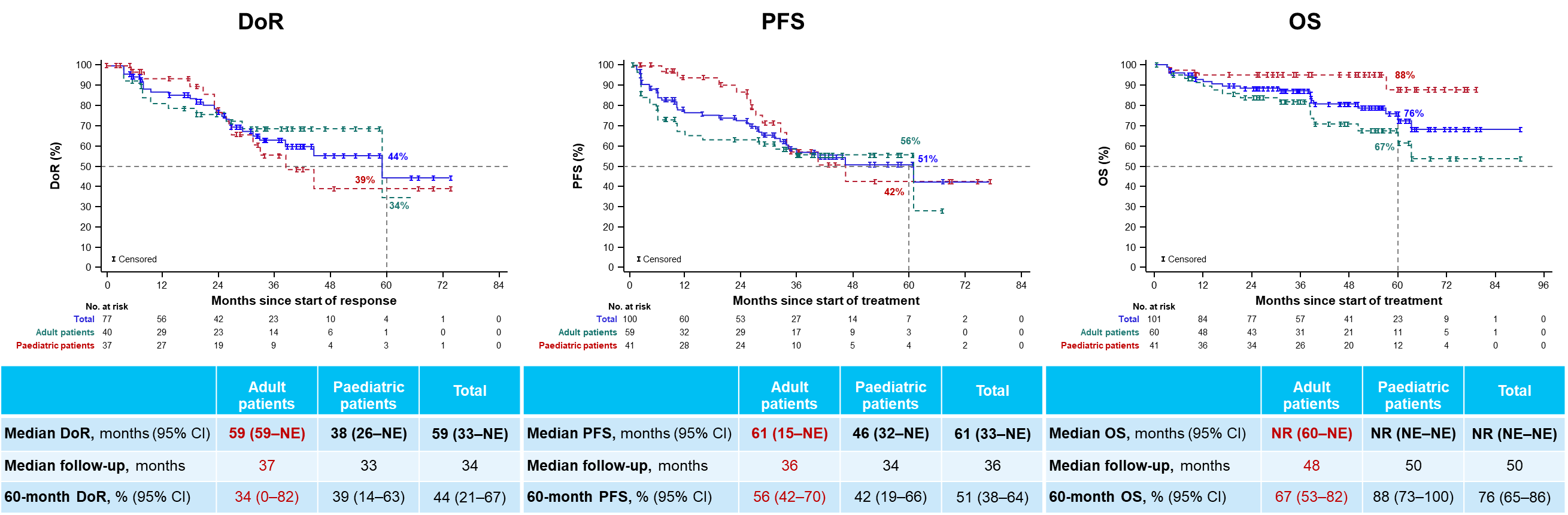
在2024 ESMO年会也报告了拉罗替尼作为一线治疗用于既往未接受系统治疗的局部晚期或转移性TRK融合肿瘤患者的最新疗效和安全性[3],在IRC可评估的59例成人患者中,拉罗替尼一线治疗的ORR达68% (95% CI:54%-79%),数据截止时,中位DoR为59个月,5年DoR率为34%;中位PFS为61个月,5年PFS率为56%;中位OS尚未达到,5年OS率为67%。在安全性方面,拉罗替尼治疗的不良事件是可控的,治疗相关不良事件(TRAEs)多为1/2级。随着随访时间的延长,拉罗替尼持续为患者提供快速且持久的缓解,延长生存获益,并保持良好的安全性,逐步为TRK融合肿瘤患者的治疗增加循证医学证据。
NTRK基因融合肺癌患者
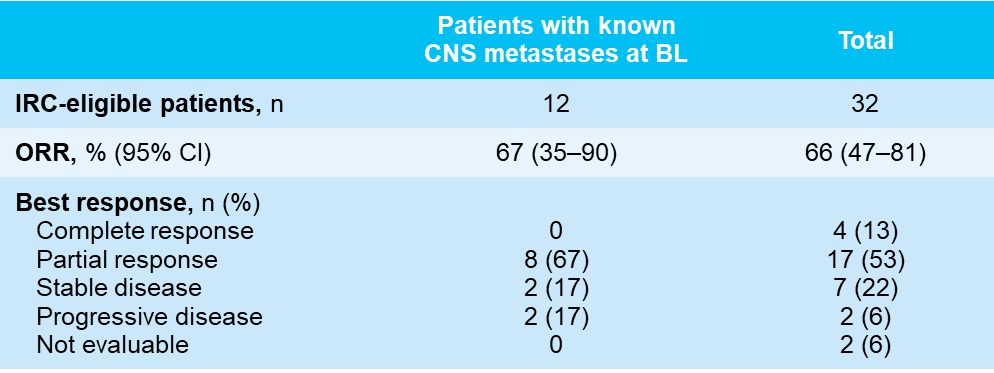
肺癌是我国发病率和死亡率最高的恶性肿瘤[4],随着精准医疗的快速发展,在肺癌中发现了多种致癌驱动基因,其中NTRK基因融合已被确认为肺癌的重要致癌驱动因素。针对NTRK基因融合靶向药物的出现,为这类患者的临床诊疗带来了新的转机。2024 WCLC大会报告了拉罗替尼治疗TRK融合肺癌患者的最新结果[5] ,这项研究纳入了2项拉罗替尼关键试验(NCT02576431和NCT02122913)的数据,共32例NTRK融合阳性NSCLC患者,其中12例基线时伴中枢神经系统(CNS)转移,研究结果显示,接受拉罗替尼治疗的肺癌患者,中位至缓解时间仅为1.8个月(范围:1.5-7.3),IRC评估的ORR为66%,中位DoR为34个月,中位PFS为22个月,中位OS为39个月,进一步验证了拉罗替尼可为NTRK融合阳性肺癌患者带来的快速且持久的临床获益。此外,对于基线伴伴CNS转移的患者,IRC评估的ORR为67%(95% CI:35%-90%),与整体人群数据相当,证明了拉罗替尼出色的颅内疗效。
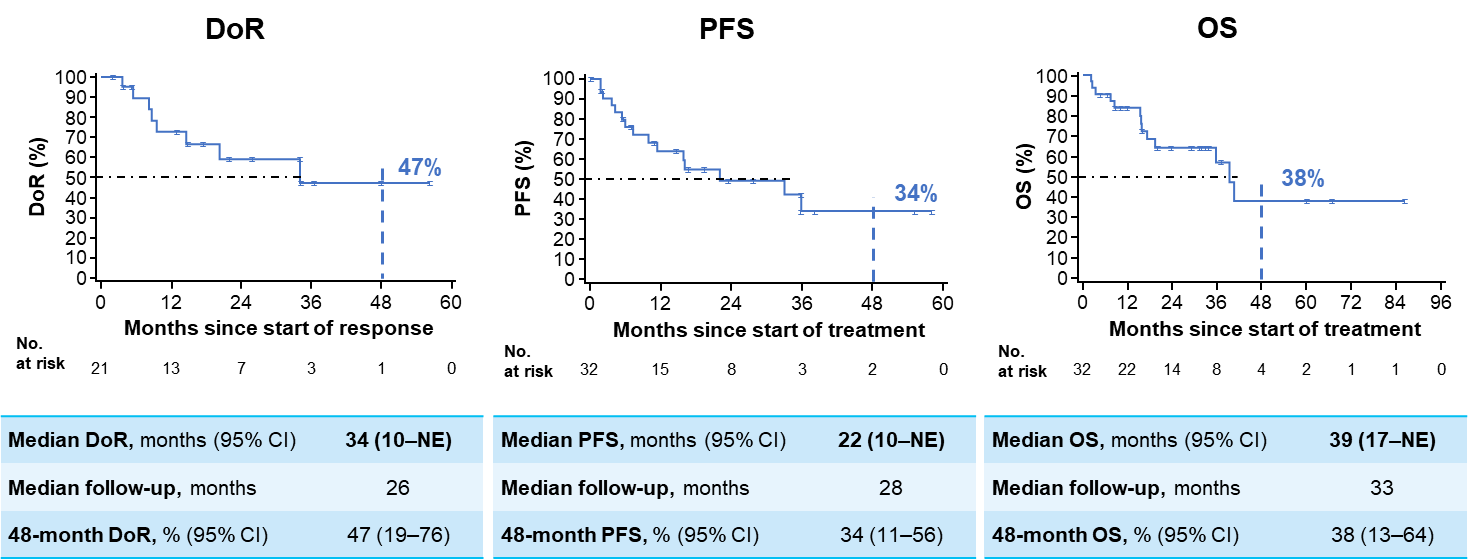
NTRK基因融合甲状腺癌患者
甲状腺癌(TC)已成为全球范围内增长迅速的疾病负担,其发病率近年来急剧上升。分化型甲状腺癌(DTC)约占TC患者的90%左右,放射性碘是转移性DTC的主要治疗手段之一,但仍有部分DTC患者为放射性碘难治性。TRK抑制剂拉罗替尼的出现,为TC患者提供了更多治疗选择。2024 ATA大会报告了拉罗替尼治疗TRK融合TC患者的疗效和安全性分析的更新结果[6],研究共纳入31例TRK融合TC患者进行IRC疗效评估分析,其中包括24例DTC患者和7例未分化型甲状腺癌(ATC)患者。在所有TC患者中,拉罗替尼治疗的中位至缓解时间为1.9个月(范围:1.6-16.2),ORR为65% (95%Cl:45%-81%),其中DTC和ATC患者的ORR分别为79%和14%。数据截止时,中位DoR为41个月,4年DoR率为32%;中位PFS为44个月,4年PFS率为42%;中位 OS尚未达到,4年OS率为72%。安全性分析显示,拉罗替尼治疗的TRAEs主要为1-2级,没有患者因TRAEs而停药。这些长期随访数据再次证明了拉罗替尼在兼顾疗效和安全性方面的可靠性。

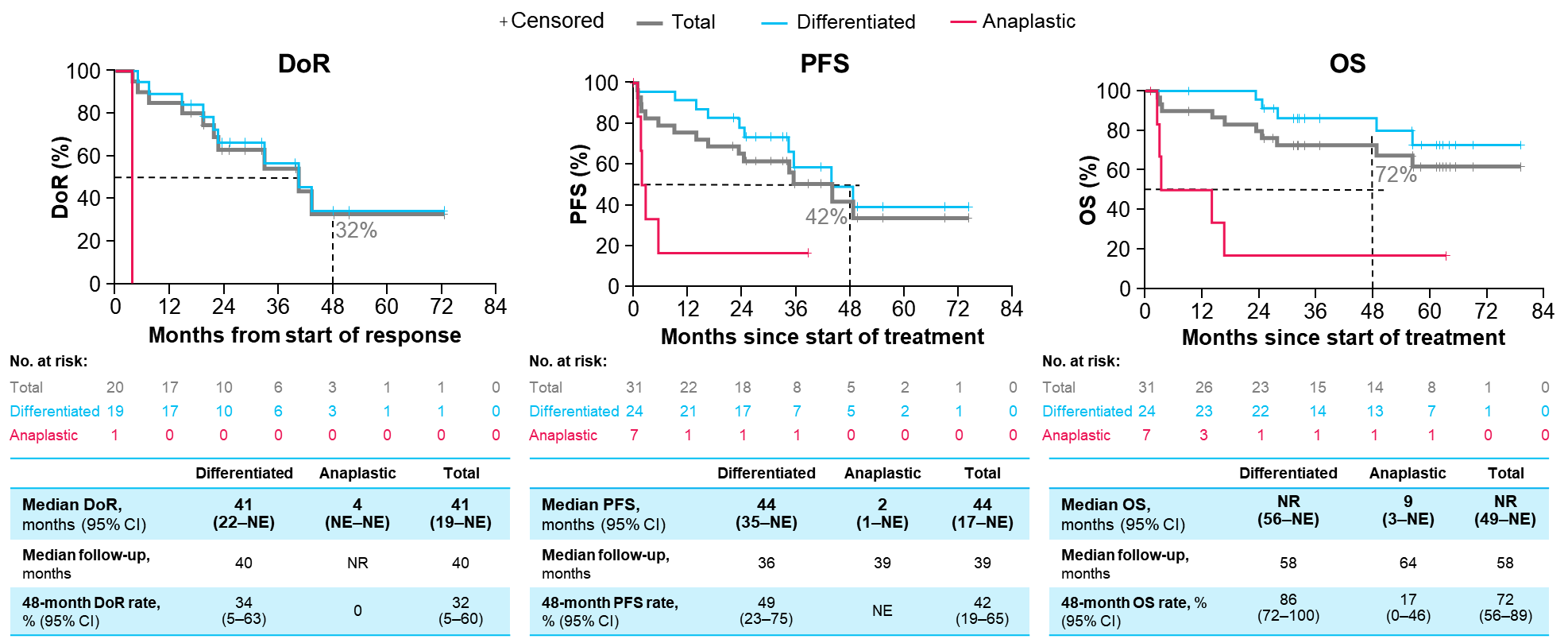
NTRK基因融合消化道肿瘤患者
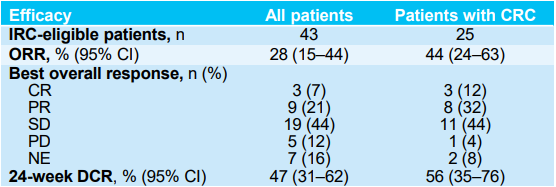
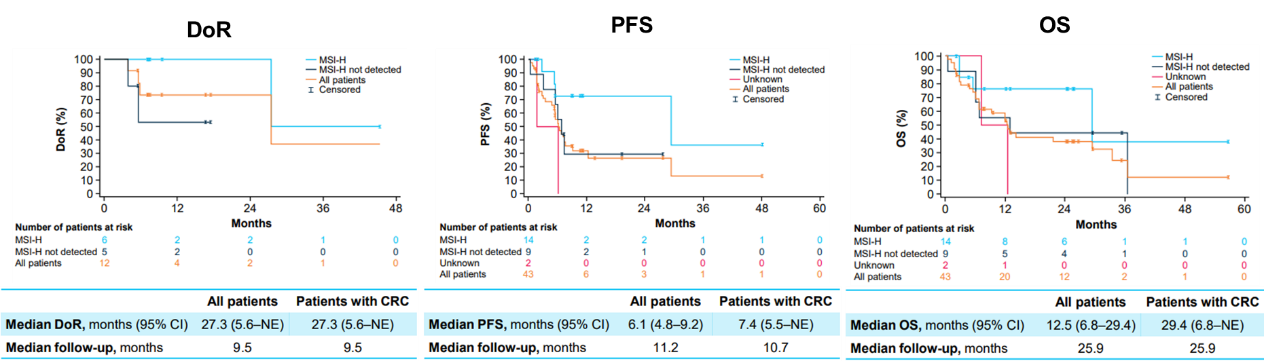
消化道肿瘤是我国常见的恶性肿瘤之一,其中结直肠癌发病率最高,排在第二位。NTRK基因融合在消化道肿瘤中的总体发生率小于1%,但由于我国人口基数庞大,其病患总数仍不容小觑。既往研究数据已证实拉罗替尼在消化道肿瘤中的实力,在今年的ASCO GI大会上,报告了拉罗替尼治疗TRK融合胃肠道肿瘤患者的更新数据[7]。在最新的研究分析中,共纳入NAVIGATE(NCT02576531)研究中44例接受拉罗替尼治疗的转移性TRK融合胃肠道肿瘤患者,其中包括25例结直肠癌(CRC)患者。在所有IRC可评估患者中,拉罗替尼治疗的中位至缓解时间为1.8个月(范围:1.7-11.1),ORR为28%(95% Cl:15%-44%),其中CRC患者的ORR为44%(95% CI:24%-63%)。拉罗替尼治疗消化道肿瘤患者的中位DoR为27.3个月,中位PFS为6.1个月,中位OS为12.5个月,其中CRC患者的中位OS长达29.4个月。拉罗替尼治疗的大多数不良事件是可控的,TRAEs多为1-2级。更新的研究数据进一步证实了拉罗替尼对于TRK融合胃肠道肿瘤患者是一种快速有效的治疗选择。
精准检测,筑牢NTRK基因融合肿瘤诊疗根基
目前临床上NTRK基因融合抑制剂靶向治疗实体瘤的疗效优异,在肿瘤精准治疗领域具有巨大的潜力。精准治疗,检测先行。NTRK基因融合的识别有助于癌症的精准诊断,对于评估癌症患者的疗效、预后情况以及指导靶向药物治疗方案的选择具有重要意义。我国首部NTRK融合基因临床诊疗共识提出,所有晚期成人实体瘤和儿童实体瘤患者均建议进行NTRK融合基因检测,并且根据不同癌种的特性采取不同的检测策略[8]。随着国内基因检测技术的不断研发和规范,以及临床学者对NTRK基因融合的认知和重视程度的不断提升,未来这类罕见靶点的患者能够尽早获得精准诊疗,使得跨癌种靶向治疗先行者拉罗替尼能够造福更多NTRK基因融合患者。
专家点评
主任医师,博士研究生导师
广东省肺癌研究所副所长
教育部长江学者特聘教授
国际肺癌研究协会(IASLC)职业发展与奖学金委员会委员
中国胸部肿瘤研究协作组(CTONG)副会长兼秘书长
广东省医师协会临床试验专委会主委
广东省基层医药学会肺癌专委会主委
擅长领域:以靶向治疗、免疫治疗为主的肺癌多学科综合治疗,对生物标志物指导下的肺癌精准治疗、靶向治疗耐药机制和克服耐药策略研究方面有深入研究。
科研论文:发表SCI论文100余篇包括Nature Reviews Clinical Oncology(IF=81.1), Nature Medicine(IF=58.7), Annals of Oncology(IF=56.7) , Cancer Cell(IF=48.8), Lancet Oncology(IF=41.6) and Journal of Clinical Oncology(IF=42.1) ,其中第一作者或通讯作者54篇,单篇最高影响因子81.1分,影响因子>40分总共8篇,影响因子>20分总共13篇,总影响因子762.3分。
科研获奖:主持完成国家十三五重点研发计划项目一项、国家自然科学基金项目五项和多项省级科研课题。主译译著一部,参加100余项国际、国内多中心临床研究,获得国家科学技术进步奖二等奖一项,中华医学科技奖一等奖两项,广东省科学技术奖一等奖三项、二等奖两项,广东医学科学技术奖一等奖一项。
周清教授:拉罗替尼是全球首个不限瘤种、高选择性单靶点、适应证覆盖全年龄段(含新生儿)的TRK抑制剂,展现了基于基因突变的个性化治疗方案的巨大潜力,为肿瘤治疗带来了全新的理念和希望。基于拉罗替尼在临床试验中展现出良好的疗效和可控的安全性,2022年拉罗替尼已获得NMPA批准用于NTRK基因融合肿瘤患者,是唯一上市双剂型的NTRK基因融合靶向药。在今年持续更新研究中,拉罗替尼依旧不负众望,不断传递出令人振奋的临床获益,同时表现出良好的安全性,为NTRK基因融合肿瘤患者带来了高质量生存的希望。值得关注的是,拉罗替尼纳入2025年国家医保目录,将进一步提高药物的可及性,减轻患者的经济负担,为更多患者带来福音。
教授、博士生导师、广东省杰出青年医学人才
中国临床肿瘤学会(CSCO)肿瘤生物标志物专家委员会主任委员
中国临床肿瘤学会(CSCO)理事会常务理事
广东省肺癌研究所所长(2017-2021)
广东省肺癌转化医学重点实验室副主任
全国研究生教育评估监测专家库专家
广东省转化医学会肿瘤学分会主任委员
广东省抗癌协会分子诊断委员会候任主任委员
广东省抗癌协会靶向治疗专业委员会副主任委员
广东省药理学会肿瘤药理专业委员会副主任委员
广东省第二届干(体)细胞临床研究专家委员会委员
广东省人民医院干细胞临床研究伦理委员会主任
国际任职:ASCO、AACR、ESMO、IASLC会员;British Medical Journal中文版 青年编委;Journal of Thoracic Oncology中文版 编委;Journal of Clinical Oncology中文版编委/肿瘤标志物专刊 主编 等
研究方向为肿瘤微环境细胞与分子生物学机制,获得国家自然科学基金3项,省部级科研基金多项。参与获得国家科技进步奖二等奖1项、中华医学会医学科技一等奖1项、广东省科技成果奖3项。作为主要完成人获得国家发明专利4项。在Science增刊发表综述,在Molecular Cancer, Signal Transduction and Targeted Therapy,Nature Communications, Journal of Clinical Oncology, Annual of Oncology, Clinical Cancer Research, Oncogene等杂志以共同第一作者、第一作者或参与作者发表SCI文章一百余篇
张绪超教授:NTRK基因融合已成为跨年龄和组织类型且有靶向药物可用的“钻石”靶点,虽然NTRK基因融合在多个常见瘤种中的发生率较低,但由于中国庞大的肿瘤患者人群基数,具有该融合突变的患者数量仍然不可忽视。拉罗替尼开启了广谱抗癌时代,打破传统治疗的局限性,根据肿瘤患者基因特征,个体化制定精准靶向治疗方案。拉罗替尼治疗NTRK基因融合肿瘤患者的长期随访数据持续证实了拉罗替尼在兼顾疗效和安全性方面的显著优势。为了确保真正具有NTRK基因融合的患者得到及时的精准诊断,提高NTRK检测率势在必行,让更多NTRK基因融合患者更早地开始应用拉罗替尼。而拉罗替尼从获批到纳入国家医保药品目录,加速药物可及,降低患者用药经济负担,使临床医生有更多选择为患者制定更高效的治疗策略。
[1] Hsiao SJ, et al. Detection of Tumor NTRK Gene Fusions to Identify Patients Who May Benefit from Tyrosine Kinase (TRK) Inhibitor Therapy. J Mol Diagn. 2019 Jul;21(4):553-571.
[2] Alexander Drilon,et al. Long-term efficacy and safety of larotrectinib in non-primary central nervous system TRK fusion cancer. 2024 ESMO. Abstract 627P.
[3] David S. Hong, et al. Efficacy and safety of larotrectinib as first-line treatment for patients with TRK fusion cancer: an updated analysis. 2024 ESMO. Abstract 628P.
[4] 郑荣寿, 陈茹, 韩冰峰, 等. 2022年中国恶性肿瘤流行情况分析 [J] . 中华肿瘤杂志, 2024, 46(3) : 221-231.
[5] Jessica J. Lin, et al. Updated Efficacy, Safety, and Biomarker Analysis in Patients with TRK Fusion Lung Cancer Treated with Larotrectinib. 2024 WCLC. Abstract 24.
[6] Steven G. Waguespack, et al. Efficacy, Safety, and Genomic Data in Patients With TRK Fusion Thyroid Carcinoma (TC) Treated With Larotrectinib. ATA 2024.
[7] Shen lin, et al. Updated efficacy and safety of larotrectinib (laro) in patients (pts) with TRK fusion gastrointestinal (GI) cancer. 2024 ASCO GI. Abstract 109.
[8] Xu C, Si L, Wang W, et al. Expert consensus on the diagnosis and treatment of NTRK gene fusion solid tumors in China. Thorac Cancer, 2022;13(21):3084-3097.
医学审批号:MA-LAR-CN-0270-1
排版编辑:肿瘤资讯-jyy











 苏公网安备32059002004080号
苏公网安备32059002004080号


