结直肠癌(CRC)是我国最常见的恶性肿瘤之一,近年来发病率呈明显上升趋势。尽管随着治疗手段的改进、新药物的使用以及分子分型的普及使得CRC患者的整体预后得到改善,但仍存在许多挑战。临床中转移性结直肠癌(mCRC)二线化疗疗效有限,可供选择的治疗方案也很少。因此,mCRC的二线治疗方案亟待优化设计,以提高缓解率,延长患者生存期。曲氟尿苷替匹嘧啶(TAS-102)是一种已经获批用于mCRC治疗的新型口服化疗药物,在晚期mCRC的治疗中发挥了重要作用。近期,一项Ⅰ期研究[1]证实对于氟尿嘧啶类和奥沙利铂一线治疗无效的转移性结直肠癌患者,TAS-102联合伊立替康和贝伐珠单抗方案具有可耐受的抗肿瘤活性。本文特邀中国医学科学院肿瘤医院孙永琨教授对本研究数据进行深度解读和点评。
【研究速览】

北京整合医学学会结直肠肿瘤分会委员
北京癌症防治学会胃癌青委会委员
第二届北京精准诊断研究会青委会委员
北京整合医学学会肺癌专业委员会第一届委员
河北省白求恩精神研究会肿瘤分会委员
《肿瘤健康管理》编委
2017-2018年赴英国伦敦Queen Mary University of London学习,于Barts Cancer Institute进行肿瘤相关课题研究
2020年获南昌大学临床医学学位与英国玛丽女王大学生物医学专业双学位
硕士、博士研究生就读于北京协和医学院,目前共发表SCI论文9篇,其中以第一作者身份发表6篇;发表中文核心期刊论文2篇
研究设计
该研究为单臂、开放标签、I期剂量递增临床研究。入组患者为既往接受过以奥沙利铂为基础的一线治疗,未接受过伊立替康治疗的转移性结直肠癌患者。该研究遵循3+3设计,TAS-102剂量预设4个剂量20、25、30和35 mg/m2,每天接受2次治疗,第1-5天;伊立替康剂量预设4个剂量135、150、165和180 mg/m2,第一天接受治疗;并在第一天接受固定剂量的贝伐珠单抗5 mg/kg治疗,每14天重复一次。考虑到疗效因素,初始剂量创新性的设置为中间剂量组,即伊立替康150 mg/m2,TAS-102为30 mg/m2,根据耐受情况增加或降低剂量。治疗持续至RECIST定义的疾病进展或临床疾病进展、不可接受的毒性、患者要求停止治疗,以及连续30天的无治疗期。I期的主要研究目的旨在确定TAS-102、伊立替康和贝伐珠单抗联合治疗的II期研究推荐剂量(RP2D),并评估其安全性。
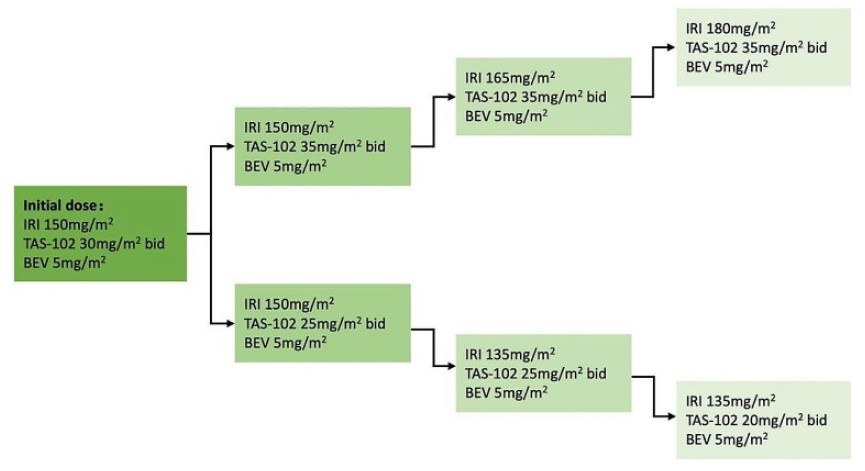 图1 研究方法
图1 研究方法
研究结果
患者基线特征
从2022年11月1日至2023年9月30日,共招募18例患者。18例患者均接受至少3个周期的治疗方案。中位年龄为58.5岁(34-70岁),其中10例女性患者(55.6%)。15例(83.3%)患者ECOG PS为1分,3例为0分。16例 (88.9%) 左半结肠癌,2例(11.1%) 右半结肠癌患者。18例患者中,14例为复发型,4例不可切除。肝转移12例,肺转移7例。17例患者进行了基线KRAS/NRAS/BRAF基因状态分析。12例患者存在RAS基因突变,1例患者存在BRAF基因突变。
既往治疗方面,10例患者曾接受贝伐珠单抗治疗,2例患者一线治疗接受过抗表皮生长因子受体单克隆抗体治疗(表1)。
表1 mCRC患者基线特征
确定RP2D
剂量水平1(TAS-102 30 mg/m2, 每天2次,伊立替康150 mg/m2 +贝伐珠单抗5 mg/kg)下观察到1例患者发生剂量限制性毒性(DLT),该患者在第1个周期出现4级血小板减少。在剂量水平2(TAS-102 35 mg/m2, 每天2次,伊立替康150 mg/m2+贝伐珠单抗5 mg/kg)下观察到2例DLT,1例患者在第1周期出现4级中性粒细胞减少和3级腹泻,1例患者在第2周期出现4级中性粒细胞减少。因此,该剂量不能耐受。根据剂量水平1和剂量水平2的结果,剂量水平3设计为TAS-102 30 mg/m2, 每天2次,伊立替康165 mg/m2 +贝伐珠单抗5 mg/kg,共观察到2例DLT,1例患者在第1周期出现3级乏力,1例患者在第2周期出现4级中性粒细胞减少。因此,该剂量也不可耐受。在此基础上,Ⅱ期的RP2D确定为TAS-102 30 mg/m2,每天2次,和伊立替康150 mg/m2 +贝伐珠单抗5 mg/kg(剂量水平1)。
安全性分析
研究显示,18例患者中,13例(72.2%)患者发生了1种或多种不同级别的治疗相关不良反应(TRAEs)。10例(55.6%)患者发生3-4级TRAE。不良反应主要为血液学或胃肠道相关不良反应。最常见的TRAE为中性粒细胞减少(55.6%)、腹泻(22.2%)、血小板减少(11.1%)和恶心(11.1%)。最常见的3-4级TRAE为中性粒细胞减少(33.3%)、腹泻(16.7%)和血小板减少(11.1%)。
没有患者因TRAEs而终止研究。数据截止时,本研究中无患者死亡。(表2)
表2 在mCRC患者中的TRAEs
有效性分析
截至2023年9月30日,全部18患者的总缓解率(ORR)为11.1%(2例部分缓解,PR;14例病情稳定,SD;2例疾病进展,PD)。14例SD患者中,12例肿瘤缩小。如表3所示,剂量水平1的ORR为33.3%。疾病控制率(DCR): 剂量水平1为83.3%,剂量水平2为83.3%,剂量水平3为100%。中位PFS(无进展生存期)和中位OS(总生存期)未达到。
表3 mCRC患者有效性分析
研究结论
该Ⅰ期剂量递增研究提示,对于氟尿嘧啶和奥沙利铂一线治疗后耐药的mCRC患者,TAS-102、伊立替康和贝伐珠单抗三联疗法具有抗肿瘤作用,且安全性可接受。该方案值得进一步探索和研究。
大咖点评
从事消化系统、泌尿系统肿瘤内科治疗
负责和参与多项抗肿瘤新药的I~IV期临床研究
中国医疗保健国际交流促进会消化肿瘤多学科诊疗学分会常务委员
中国医疗保健国际交流促进会肿瘤内科分会委员
中国医药教育协会肿瘤化学治疗专业委员会常务委员
中国临床肿瘤学会CSCO青年专家委员会委员
中国临床肿瘤学会CSCO抗肿瘤药物安全委员会委员
北京癌症防治学会胃癌防治专业委员会副主任委员
北京癌症防治学会食管癌专业委员会常务委员
《肝癌电子杂志》编委
晚期结直肠癌治疗困局亟待突破
结直肠是我国第二大癌症,2022年2月国家癌症中心发布的最新统计数据显示,每年新发肠癌达40.8万人[2]。对于不可手术切除的转移性结肠直肠癌(mCRC)患者,在接受标准治疗化疗±靶向治疗进展后,生存期有限。mCRC的二线治疗一直是临床上的一个难题。
目前,化疗仍是CRC患者治疗的基石,化疗联合靶向治疗被推荐为 mCRC患者的二线标准治疗,但mCRC患者对二线化疗的应答有限,因此二线治疗往往面临疗效有限和不良反应较高的双重挑战。此外,虽然免疫治疗的出现为微卫星不稳定型或错配修复蛋白缺陷(dMMR/MSI-H)患者带来新的治疗策略,但占比更高的微卫星稳定型/错配修复正常(pMMR/MSS)患者无法从免疫治疗中获益。因此,探索新的药物组合,优化现有治疗方案,提高生存率和生活质量,成为临床迫切需要解决的问题。
机制互补TAS-102三药联合模式为mCRC患者带来新希望
mCRC患者,探索更加有效的二线治疗方案迫在眉睫。TAS-102是一种新型口服细胞毒药物,可以视为“升级版”的氟尿嘧啶,在其抑制胸苷酸合成酶作用干扰DNA合成的基础上,还可以磷酸化产物渗入DNA,替代胸腺嘧啶的作用而干扰DNA合成。研究发现,TAS-102联合贝伐珠单抗可增加肿瘤内磷酸化的FTD浓度,显著抑制肿瘤细胞增殖,具有协同作用,因此疾病进展后,在化疗联合贝伐珠单抗的基础上,加用TAS-102可能是管理mCRC的有效策略。
近年来,多项研究探讨了含二联或三联伊立替康的给药方案。日本的一项I期研究将标准TAS-102方案与伊立替康联合使用,显示出初步的抗肿瘤活性,但3/4级不良事件的发生率很高[3],限制了该方案的临床应用。BiTS研究[4]结果表明,双周TAS-102+贝伐珠单抗的疗效与标准TAS-102给药方案相似,但毒性降低。基于此,美国和日本先后开展TAS-102+伊立替康+贝伐珠单抗三联方案的I期研究[5][6],均显示出抗肿瘤活性和可控的安全性。美国研究的ORR和中位PFS分别为12%和7.9个月,日本研究分别为19%和7.1个月。本研究RP2D队列患者的ORR为33.3%,未达到中位PFS和中位OS,且耐受性良好。
未来可期,三联模式开辟mCRC二线治疗新方向
本研究所探索的TAS-102与伊立替康及贝伐珠单抗的联合治疗方案,为mCRC患者提供了一种新的二线治疗选择。结果显示,此联合治疗方案不仅具有可接受的安全性,还初步显示了抗肿瘤活性,这对于二线治疗患者来说,意味着更多的治疗机会并改善生活质量。
I期研究确定RP2D后,期待Ⅱ期临床试验能进一步验证此联合疗法的疗效和安全性,为mCRC的二线治疗提供更为精准的数据支持。总之,这项研究不仅为mCRC患者提供了新的治疗方案,也为未来的肿瘤治疗研究提供了重要的方向。通过不断优化和创新治疗方案,有望为更多患者带来生存上的实质性改善。
[1] Zhang, Jing, et al. "Phase I study of trifluridine/tipiracil (TAS-102) plus irinotecan in combination with bevacizumab as a second-line therapy for patients with metastatic colorectal cancer." Investigational New Drugs (2024): 1-8.
[2] He J, et al. J Natl Cancer Cent.2022,2(1):1-9.
[3] Doi T, Yoshino T, Fuse N, Boku N, Yamazaki K, Koizumi W et al (2015) Phase I study of TAS-102 and irinotecan combination therapy in Japanese patients with advanced colorectal cancer. Invest New Drugs 33(5):1068–1077
[4] Satake H, Kato T, Oba K, Kotaka M, Kagawa Y, Yasui H et al (2020) Phase Ib/II study of Biweekly TAS-102 in combination with Bevacizumab for patients with metastatic colorectal Cancer refractory to standard therapies (BiTS study). Oncologist 25 (12):e1855–e63
[5] Varghese AM, Cardin DB, Hersch J, Benson AB, Hochster HS, Makris L et al (2020) Phase I study of Trifluridine/Tipiracil plus irinotecan and Bevacizumab in Advanced gastrointestinal tumors. Clin Cancer Res 26(7):1555–1562
[6] Taniguchi H, Yamazaki K, Masuishi T, Kawakami T, Onozawa Y, Honda K et al (2023) Bevacizumab, Irinotecan, and Biweekly Trifluridine/Tipiracil for metastatic colorectal Cancer: MODURATE, a phase ib study. Oncologist 28(11):e1108–e13
排版编辑:肿瘤资讯-Zika











 苏公网安备32059002004080号
苏公网安备32059002004080号


