引言:
肺癌是全球范围内发病率和死亡率最高的恶性肿瘤之一。根据国际癌症研究机构(IARC)2022年GLOBCAN数据,全球新发肺癌病例约248.03万例,死亡病例约181.72万例,占癌症死亡总数的近1/5 [1]。在中国,2022年肺癌新发病例约106.06万例,死亡病例约73.33万例[2]。非小细胞肺癌(NSCLC)约占肺癌总数的80%-85%,手术切除仍是早期NSCLC和部分肺转移瘤的标准治疗。然而,仅约30%的肺癌患者适合手术治疗。对于不适合手术的患者,局部肿瘤消融术,如射频消融、微波消融和冷冻消融,已成为重要的替代选择。
冷冻消融技术作为新兴的局部治疗手段,具有创伤小、痛感低、耐受性好、并发症少以及影像下消融边界清晰等优势,适用于早、中、晚期实体肿瘤治疗。此外,冷冻消融直接导致肿瘤细胞原位死亡,释放肿瘤抗原,激发免疫反应,与免疫疗法的联合展示出令人瞩目的前景。本文将聚焦于冷冻消融术治疗肺癌的疗效和安全性,并就其与免疫联合应用的最新进展进行总结,以期为临床实践提供新的思路和参考。
精准把控,构建冷冻消融5项优势
冷冻消融 (cryoablation) 通过快速降温造成细胞冰晶损伤,引起细胞凋亡或死亡,实现肿瘤组织原位灭活,同时刺激机体免疫应答。氩氦冷冻消融(氩氦刀)作为广泛应用的冷冻消融技术,为瓦里安Endocare于1993年首创,基于Joule-Thomson效应,采用氩气-氦气快速循环技术,配合一次性使用冷冻消融针,可在短时间内使肿瘤细胞达到-40 °C~-50°C的细胞致死温度,导致靶细胞结冰、细胞膜破裂、微血管闭塞和组织缺血坏死;随后缓慢复温至20 ℃-40 ℃,通过温度梯度的变化以及多次冻融循环,实现对肿瘤的充分消融。与传统的热消融方法相比,冷冻消融具有独特优势:
· 消融边界清晰:可在CT、超声等影像学引导下监测"冰球"形成,精确区分消融区域与肿瘤边界。
· 耐受性佳:患者疼痛感较轻,可耐受性好。
· 保护重要结构:对胶原纤维破坏小,可保护血管、支气管等结构,适用于肺门部位肿瘤。
· 适形消融:通过多针穿刺几何布针及“差时”冷冻技术,实现适形冷冻,使消融靶区更贴合病灶形态。
· 免疫效应:冻融过程中肿瘤细胞膜破裂释放肿瘤抗原,激活肿瘤特异性免疫,较微波消融、射频消融更为显著[22]
利刃出鞘,尽显非凡实力
高级别循证医学证据:建议冷冻消融用于早期及局部晚期肺癌的治疗
随着肺癌早诊早筛的推广,早期肺癌患者比例不断增加,I期患者约占新发病例的30%[3]。对于因年龄、肺功能障碍、共病、多发病灶或既往多次手术等原因而无法耐受手术的患者。冷冻消融作为一种微创局部治疗手段已成为临床实践中的重要选择。
一项纳入45例T1N0M0 NSCLC患者的回顾性分析结果显示,冷冻消融治疗后5年总生存 (OS)率为67.8%,5年肿瘤特异性生存(CSS)率为56.6%,5年无进展生存 (PFS)率高达87.9%。安全性方面,仅有6.4%的患者出现3级以上并发症[4]。这些数据与手术治疗相当,但并发症发生率更低。
一项纳入7项临床研究共计420例患者的荟萃分析对比了冷冻消融术和射频消融术(RFA)治疗NSCLC的疗效和安全性。分析显示,冷冻消融在3年PFS (P = 0.003) 和并发症如支气管胸膜瘘,肺部感染,疼痛等发生率 (P < 0.00001) 均显著优于RFA,且显著降低局部复发率 (P = 0.05)[5]。
多个国际指南已将肿瘤消融纳入早期及局部晚期肺癌治疗推荐。NCCN(ver2.2023)指南建议,I期、多发原发性肺癌、T1-3、N0及局部复发患者可选择消融治疗;欧洲心血管和介入放射学学会(CIRSE,2020),以及欧洲肿瘤内科学会(ESMO)也推荐Ia期或其他符合条件的患者进行消融治疗[6-8]。我国《原发性肺癌诊疗指南》(2022版)和《中华医学会肿瘤学分会肺癌临床诊疗指南》(2023版)均推荐,对于无法耐受手术和放疗的患者,可采用包括冷冻消融在内的局部治疗[9, 10]。此外,《影像学引导肺癌冷冻消融治疗专家共识(2022版)》,以进一步规范了冷冻消融在肺癌治疗中的应用[11]。
精益求新,激发冷冻消融晚期肺癌治疗新潜能
对于晚期NSCLC患者,冷冻消融也展现出良好的治疗效果。一项回顾性研究纳入22例放化疗后出现疾病进展的IIIB/IV期NSCLC患者,进行经皮冷冻消融治疗并进行评估。研究发现,冷冻消融治疗后1年OS率达81.8%,PFS率为27.8%。更重要的是,患者的生活质量在治疗后1个月显著提高(P = 0.024),身体健康分数也显著提升(P = 0.029)。这一发现为晚期NSCLC患者,特别是对于常规放化疗治疗失败的IIIB/IV期晚期NSCLC患者提供了新的治疗选择[12]。
另一项回顾性研究纳入26例多次手术切除后复发、高龄、肺功能差、拒绝手术或不耐受手术的晚期肺癌患者,接受过单次或多次冷冻消融治疗后随访超过12个月,研究结果显示1年OS率为96%,2年和3年OS率皆为88%[23]。类似地,一项多中心、前瞻性研究纳入40例肺转移瘤患者,结果显示,对于≤3.5cm的肺转移瘤,进行冷冻消融后12个月的局部肿瘤控制率高达94.2%, 1年OS率为97.5%。且无严重不良事件发生,患者生活质量在随访期内保持不变。这一结果与手术切除和立体定向放疗(SBRT)的效果相当,但创伤更小,对肺功能的影响更低[13]。
此外,冷冻消融还具有可重复性强的优势。既往研究证实,对于局部复发的原发性肺部恶性肿瘤或肺转移瘤,再次冷冻消融治疗可以获得与初次治疗相当的疗效,且不增加并发症发生率[5]。为治疗临近病灶或复发病灶进行重复冷冻消融以控制疾病进展奠定了其治疗优势。
增益共进
冷冻消融联合免疫治疗NSCLC前景广阔
近年来,免疫检查点抑制剂(ICIs)靶向CTLA-4、PD-1和PD-L1等分子,重新激活免疫细胞抗肿瘤功能,为肿瘤治疗带来突破。然而,ICIs单药治疗在大多数实体瘤中的总体缓解率仅为15% - 25%[14]。因此,如何提高免疫治疗疗效成为当前研究的热点。基于此,冷冻消融与免疫治疗的联合应用引起了研究者的广泛关注。冷冻消融不仅可以直接杀伤肿瘤细胞,还能通过多种机制增强机体的抗肿瘤免疫反应:
· 释放肿瘤抗原:快速冻融导致细胞膜破裂,释放大量肿瘤相关抗原 (TAAs) 和损伤相关分子模式 (DAMPs),被树突状细胞 (DCs) 摄取和加工,激活肿瘤特异性T细胞。有研究表明,冷冻消融后肿瘤组织中CD8+ T细胞的浸润显著增加[15, 16]。
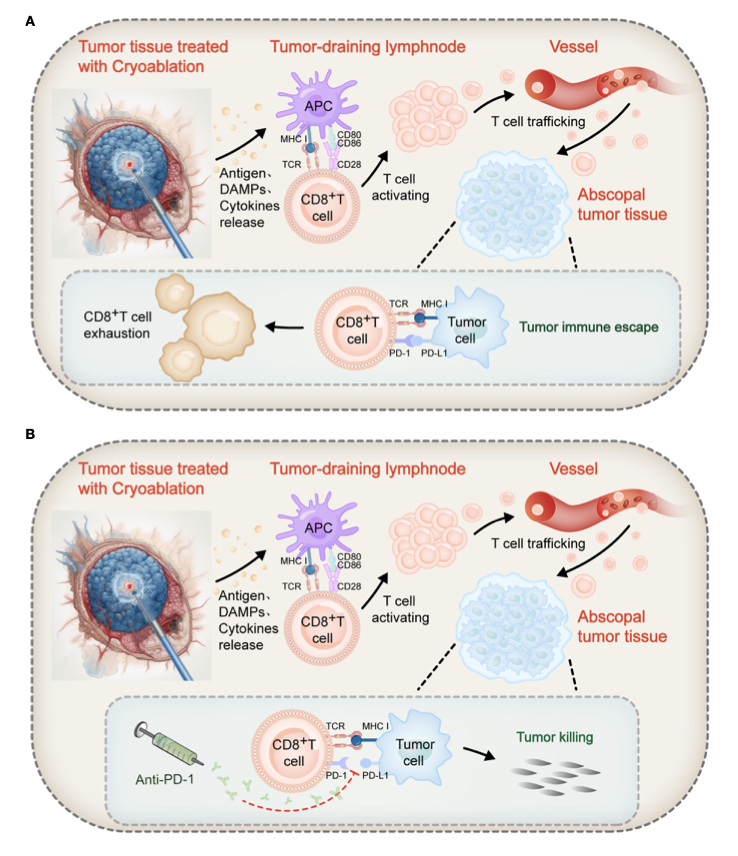
· 远隔效应:冷冻消融导致的肿瘤细胞死亡方式更有利于激活免疫系统[17]。有学者提出,肿瘤冷冻消融或可诱发“远隔效应 (Abscopal effect)”,即冷冻消融可使死亡的肿瘤细胞刺激机体产生特异性抗体,导致远处转移病灶缩小或消失 [18, 19]。一项基于小鼠模型的临床前研究发现, CTLA-4阻断与原发肿瘤冷冻消融的联合应用具有协同效应,可有效预防远处种植的继发性肿瘤生长。我国学者最新研究成果揭示,冷冻消融可通过STING依赖性I型干扰素 (IFN) 信号通路,正向调节NSCLC肿瘤局部和全身的免疫微环境,与免疫治疗协同增效[20]。这种免疫微环境的改变为后续的免疫治疗创造了有利条件。
临床实践中,冷冻消融与免疫治疗的联合应用已取得初步成果。一项回顾性研究比较了单纯冷冻消融与冷冻消融联合纳武利尤单抗(PD-1抗体)治疗晚期NSCLC的疗效。结果显示,联合治疗组的免疫功能和近期疗效均显著改善 (P<0.05),循环肿瘤细胞 (CTCs) 和肿瘤标志物细胞角蛋白21-1 (CYFRA21-1)、神经元特异性烯醇化酶 (NSE) 水平明显降低 (P<0.05)[21]。这为冷冻消融与ICIs协同作用提供了有力的临床证据。
总结
冷冻消融联合免疫治疗为NSCLC患者提供了一种新的治疗选择,有望改善患者的预后和生活质量。未来,随着技术的进步和对免疫机制的深入理解,冷冻消融联合免疫治疗策略有望在肺癌综合治疗中发挥更大的作用。个体化治疗方案的制定、新型生物标志物的开发、多模态治疗策略的优化以及先进影像学技术的应用,都将推动肺癌综合治疗领域的快速发展。同时,这一领域的研究也将为其他实体瘤的治疗提供新的思路和借鉴。
1. Bray, F., et al., Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians, 2024. 74(3): p. 229-263.
2. 郑荣寿, 陈., 韩冰峰等, 2022年中国恶性肿瘤流行情况分析. 中华肿瘤杂志, 2024.
3. Singareddy, A., et al., Trends in Stage I Lung Cancer. Clinical Lung Cancer, 2023. 24(2): p. 114-119.
4. Moore, W., et al., Five-year survival after cryoablation of stage I non-small cell lung cancer in medically inoperable patients. J Vasc Interv Radiol, 2015. 26(3): p. 312-9.
5. Lyons, G.R., G. Askin, and B.B. Pua, Clinical Outcomes after Pulmonary Cryoablation with the Use of a Triple Freeze Protocol. J Vasc Interv Radiol, 2018. 29(5): p. 714-721.
6. Venturini, M., et al., CIRSE Standards of Practice on Thermal Ablation of Primary and Secondary Lung Tumours. Cardiovasc Intervent Radiol, 2020. 43(5): p. 667-683.
7. Genshaft, S.J., et al., Society of Interventional Radiology Multidisciplinary Position Statement on Percutaneous Ablation of Non-small Cell Lung Cancer and Metastatic Disease to the Lungs: Endorsed by the Canadian Association for Interventional Radiology, the Cardiovascular and Interventional Radiological Society of Europe, and the Society of Interventional Oncology. J Vasc Interv Radiol, 2021. 32(8): p. 1241.e1-1241.e12.
8. Network., N.C.C., NCCN Clinical Practice Guidelines in Oncology: Non-Small Cell Lung Cancer (Version 3.2022). .
9. 国家卫生健康委办公厅, 原发性肺癌诊疗指南(2022年版). 协和医学杂志, 2022. 13(4) : 549-570.
10. 中华医学会肿瘤学分会, 中., 中华医学会肺癌临床诊疗指南(2023版). 中华医学杂志, 2023.
11. 张肖, 肖., 李成利, 亚洲冷冻治疗学会, 中国医药教育协会介入微创治疗专业委员会, 中国医师协会介入医师分会磁共振介入专委会, 影像学引导下肺结节冷冻消融专家共识(2022版). 中国介入影像与治疗学.
12. Gao, W., et al., The application effect of percutaneous cryoablation for the stage IIIB/IV advanced non-small-cell lung cancer after the failure of chemoradiotherapy. Asian J Surg, 2018. 41(6): p. 530-536.
13. de Baere, T., et al., Evaluating Cryoablation of Metastatic Lung Tumors in Patients--Safety and Efficacy: The ECLIPSE Trial--Interim Analysis at 1 Year. J Thorac Oncol, 2015. 10(10): p. 1468-74.
14. Ribas, A. and J.D. Wolchok, Cancer immunotherapy using checkpoint blockade. Science, 2018. 359(6382): p. 1350-1355.
15. Yakkala, C., et al., Cryoablation and Immunotherapy: An Enthralling Synergy to Confront the Tumors. Front Immunol, 2019. 10: p. 2283.
16. Liu, Q., et al., Modern cancer therapy: cryoablation meets immune checkpoint blockade. Front Oncol, 2024. 14: p. 1323070.
17. Slovak, R., et al., Immuno-thermal ablations - boosting the anticancer immune response. J Immunother Cancer, 2017. 5(1): p. 78.
18. Chu, K.F. and D.E. Dupuy, Thermal ablation of tumours: biological mechanisms and advances in therapy. Nat Rev Cancer, 2014. 14(3): p. 199-208.
19. Chen, J., et al., The future of cryoablation: An abscopal effect. Cryobiology, 2020. 97: p. 1-4.
20. Gu, C., et al., Cryoablation triggers type I interferon-dependent antitumor immunity and potentiates immunotherapy efficacy in lung cancer. J Immunother Cancer, 2024. 12(1).
21. Feng, J., D. Guiyu, and W. Xiongwen, The clinical efficacy of argon-helium knife cryoablation combined with nivolumab in the treatment of advanced non-small cell lung cancer. Cryobiology, 2021. 102: p. 92-96.
22. Zhang, K., liu, M., Cong, L. et al. A Comparative Study of Antitumor Immunity Induced by Radiofrequency Microwave and Cryoablation in Hepatocellular Carcinoma. Appl Biochem Biotechnol 196, 4088–4104 (2024)
23. Chou HP, Chen CK, Shen SH, Sheu MH, Wu MH, Wu YC, Chang CY. Percutaneous cryoablation for inoperable malignant lung tumors: midterm results. Cryobiology. 2015 Feb;70(1):60-5.
排版编辑:肿瘤资讯-yu











 苏公网安备32059002004080号
苏公网安备32059002004080号


